
- •Передмова
- •ВСТУП
- •1. ТЕРЕЗИ І ЗВАЖУВАННЯ
- •1.2. Аналітичні терези АД-200
- •1.3. Аналітичні терези АДВ-200М і ВЛА-200М
- •1.4. Лабораторні аналітичні одноплечі терези
- •1.5. Експериментальна частина
- •1.5.3. Визначення еквівалента елемента
- •1.6. Запитання і задачі
- •1.7. Література
- •2. ТЕПЛОВІ ЕФЕКТИ ХІМІЧНОЇ РЕАКЦІЇ
- •2.1. Вступ
- •2.2. Експериментальна частина
- •2.2.1. Визначення теплоти нейтралізації
- •2.3. Запитання і задачі
- •2.4. Література
- •3. КОМПЛЕКСНІ СПОЛУКИ
- •3.1. Будова комплексних сполук
- •3.2. Номенклатура комплексних сполук
- •3.2.1 Комплексні сполуки - неелектроліти
- •3.2.2. Сполуки з комплексними катіонами
- •3.2.3. Сполуки з комплексними аніонами
- •3.3. Стійкість комплексних іонів
- •3.4. Експериментальна частина
- •3.4.1. Відмінність між простими і комплексними іонами заліза
- •3.4.2. Комплексні катіони
- •3.4.4. Дисоціація комплексних іонів
- •3.4.5. Комплексні аніони
- •3.4.5. Дисоціація подвійних солей
- •3.4.6. Утворення амінів міді
- •3.5. Запитання і задачі
- •3.6. Література
- •4. ВОДНЕВИЙ ПОКАЗНИК рН
- •4.1. Визначення кислотності
- •4.2. Концентрація водневих іонів і показник концентрації водневих іонів рН
- •4.3. Експериментальна частина
- •4.3.1. Вимірювання рН з допомогою індикаторів
- •4.3.2. Колориметричний метод визначення рН
- •4.4. Запитання і задачі
- •4.5. Література
- •5. БУФЕРНІ РОЗЧИНИ
- •5.1. Обчислення рН буферних розчинів, утворених слабкою кислотою та її сіллю
- •5.2. Обчислення рН буферних систем, утворених слабкими основами та їх солями
- •5.3. Експериментальна частина
- •5.3.1. Приготування буферних розчинів
- •5.3.2. Буферна дія
- •5.3.3. Вплив розбавлення на рН буферного розчину
- •5.3.4. Втрата буферної дії
- •5.4. Запитання і задачі
- •5.5. Література
- •6. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ І ХІМІЧНА РІВНОВАГА
- •6.1. Швидкість хімічних реакцій
- •6.2. Хімічна рівновага
- •6.3. Експериментальна частина
- •6.3.1. Вплив ступеня подрібнення (величини поверхні зіткнення речовин) на швидкість реакції в гетерогенній системі
- •6.3.2. Розчинення карбонату кальцію в соляній кислоті
- •6.3.3. Залежність швидкості реакції від концентрації
- •6.3.4. Вплив температури на швидкість реакції
- •6.3.5. Вплив концентрації реагуючих речовин на хімічну рівновагу
- •6.3.6. Оборотність зміщення хімічної рівноваги
- •6.3.7. Вплив температури на хімічну рівновагу (груповий дослід)
- •6.4. Запитання і задачі
- •6.5. Література
- •7. ВЛАСТИВОСТІ S-ЕЛЕМЕНТІВ
- •7.2. Елементи ІА-підгрупи (водень, натрій, калій)
- •7.3. Елементи ІІА-підгрупи (магній і кальцій)
- •7.4. Експериментальна частина
- •7.4.1. Одержання водню
- •7.4.2. Окислювальні і відновлювальні властивості пероксиду водню
- •7.4.3. Реакції катіона натрію
- •7.4.4. Реакція катіона калію
- •7.4.5. Реакції катіона магнію
- •7.4.6. Реакції катіона кальцію
- •7.5. Запитання і задачі
- •7.6. Література
- •8.2. Елементи ІІІА-підгруш (бор і алюміній)
- •8.3. Елементи ІVА-підгруп (вуглець і кремній)
- •8.4. Елементи VА-підгрупи (азот і фосфор)
- •8.6. Елементи VІА-підгрупи (кисень і сірка)
- •8.7. Елементи VІІА-групи (галогени)
- •8.8.2. Гідроліз бури
- •8.8.3. Якісний аналіз бору
- •8.8.4. Дія лугів і кислот на алюміній (під тягою)
- •8.8.8. Відновлювальні властивості вугілля
- •8.8.9. Гідроліз солей вугільної кислоти
- •8.8.10. Одержання і властивості кремнію
- •8.8.11. Одержання і властивості аміаку
- •8.8.12. Одержання і властивості кальцієвих солей ортофосфорної кислоти
- •8.8.14. Одержання кисню і вплив каталізатора на швидкість розкладу KСlO3
- •8.8.16. Реакція хлорид-іона
- •9.2. Біологічна роль деяких важливих d-елементів
- •9.2.1. Реакції катіона марганцю з лугами (NаОН і KOH)
- •9.2.2. Реакції катіона цинку
- •9.2.3. Реакції катіона кобальту
- •9.2.4. Реакції катіонів срібла
- •9.2.5. Реакції катіонів свинцю
- •9.2.6. Реакції катіонів ртуті (І)
- •9.2.7. Реакції катіонів міді
- •9.3. Література

41
Коли концентрація Н + не має значення, кратного десяти, то, щоб знайти, рН, звертаються до логарифмування за таблицею логарифмів.
Щоб виконати зворотне обчислення, тобто за даним рН визначити відповідну концентрацію іонів водню Н+, необхідно всі обчислення робити у зворотному порядку.
4.3. Експериментальна частина
Для визначення рН застосовують колориметричні та електрометричні методи. При колориметричному методі визначення рН користуються індикаторним папером і рідкими індикаторами.
4.3.1. Вимірювання рН з допомогою індикаторів
Як відомо, індикаторами є речовини, які змінюють забарвлення в залежності від концентрації водневих іонів. Це складні органічні речовини із властивостями або слабкої кислоти, або слабкої основи, чим пояснюється їхнє різне забарвлення. В інших випадках неоднакове забарвлення індикаторів пояснюється різною будовою їх молекул та іонів. Якщо індикатор слабка кислота, то рівняння дисоціації має вигляд:
H Ind ↔ Н+ + Ind − .
Константа дисоціації виражається рівнянням:
K = СН+ СInd− ,
CHInd
де CH+ – концентрація іонів водню в розчині;, CInd−, CHInd − відповідно концентрація аніонів і недисоційованих молекул.
Із рівняння можна записати:
CInd |
= |
K |
. |
|
CHInd |
CH+ |
|||
|
|
Звідси видно, що відношення концентрації дисоційованої частини індикатора до концентрації його недисоційованої частини, яке залежить від рН середовища, визначають забарвлення індикатора в даному середовищі. Індикатори, молекули яких безколірні, а забарвлені лише іони, називають одноколірними. До них. належить фенолфталеїн. Індикатори, молекули яких мають одне забарвлення, а іони – інше, називають двоколірними. Це метилоранж, лакмус.
Кожен індикатор характеризується інтервалом переходу його забарвлення. Під інтервалом переходу розуміють проміжок значень рН, в якому відбувається помітна зміна забарвлення індикатора.
Так, інтервал переводу метилового оранжевого відповідає зміні значення рН від 3,2 до 4,4. Це означає, що в тих розчинах, в яких рН дорівнює 3,2 або менше, індикатор забарвлений в червоний колір; розчин, рН якого дорівнює 4,4 чи більше, забарвлюється в жовтий колір. Це і є інтервал, або область
42
переходу метилового оранжевого.
Наближені значення рН розчинів легко визначати з допомогою індикаторів, користуючись даними наведеної нижче таблиці 4.2. Індикатори в таблиці підібрані так, що вони охоплюють всю шкалу значень рН.
Таблиця. 4.2. Колір індикатора в інтервалі переходу
Назва індикатора |
|
pH |
Колір (відповідно значенням pH) |
Метиловий |
0,5 - 1 - 2 - 3 |
Жовтий - зелений - голубий - |
|
фіолетовий |
|
|
фіолетовий |
Метиловий |
3 - 4 - 5 |
Рожевий - оранжевий - жовтий |
|
оранжевий |
|
|
|
Паранітрофенол |
5 - 6 - 7 |
Безколірний - світложовтий - |
|
|
|
|
темножовтий |
Фенолфталеїн |
8 |
- 9 - 10 |
Безколірний-слабкорожевий- |
|
|
|
червоно-малиновий |
Алізарин жовтий |
10 |
- 11 - 12 |
Жовтий-темножовтий-оранжевий |
Індигокармін |
12 |
- 13 - 14 |
Голубий-зелений-жовтий |
Отримати у викладача 3-5 мл розчину солі і визначити його рН. При виконанні цих дослідів ретельно мити пробірки і споліскувати їх дистильованою водою; рекомендується завжди брати однакові кількості випробуваного розчину (по 1 краплі).
Налити в пробірку випробовуваний розчин і додати розчин фенолфталеїну. Якщо забарвлення стане червоним, то рН 10. Щоб визначити більш точно, треба взяти нову порцію розчину і додати індикатор алізарин жовтий. При жовтому кольорі розчину рН 10, при темно-жовтому – рН 11, при оранжевому – рН 12 чи більше. В останньому вигадку для уточнення значення рН взяти нову порцію розчину і провести визначення з допомогою індикатора індигокарміну: при голубому кольорі розчину рН 12, при зеленому – рН 13 і при жовтому – рН 14.
Аналогічно визначають рН розчину, якщо після додавання фенолфталеїну він залишився безколірним. Тільки індикатори в цьому випадку беруть у такій послідовності: паранітрофенол, метиловий оранжевий, метиловий фіолетовий. До випробовуваного розчину додати паранітрофенол. Якщо він забарвиться, в темно-жовтий колір, то рН 8, в світло-жовтий – рН 7, в жовтий
– рН 6, а якщо залишиться безколірним, то рН 5 або менше 5. В останньому випадку розчин слід випробувати метиловим оранжевим: при жовтому кольорі розчину рН 5, при оранжевому рН 4 і при рожевому рН 3 або менше. Очевидно, в останньому випадку для визначення рН розчину треба застосувати метиловий фіолетовий: фіолетовий колір розчину відповідає рН 3, голубий – рН 2, зелений – рН І і жовтий – рН 0,5.
4.3.2. Колориметричний метод визначення рН
Колориметричнії метод визначення рН заснований на законі Ламберта-
43
Бутера-Бера, згідно з яким для двох розчинів, що однаково поглинають світло, добуток концентрації С на товщину шару розчину h величина постійна:
C1h1 = C2h2 = const
Із цього закону видно, що при співпаданні інтенсивності забарвлення двох розчинів, із яких концентрація одного є величиною відомою (стандарт), можна дізнатися концентрацію іонного розчину. Маючи набір стандартно забарвлених розчинів з різною концентрацією водневих іонів (рН), обирають той із них, який за інтенсивністю забарвлення найближче підходить до досліджуваного розчину. У цьому випадку за умови однакової товщини шару обох розчинів рН досліджуваного розчину дорівнює рН стандартного розчину.
Для порівняння інтенсивності кольору стандартних розчинів із забарвленням досліджуваного розчину користуються різними приладами, фотометрами, колориметрами, компараторами тощо.
Хід роботи
1. За допомогою універсального індикатора визначити приблизне значення рН досліджуваного розчину і, користуючись таблицею, підібрати із серії Міхаеліса індикатор для даної області рН.
Таблиця 4.3. Індикатори серії Міхаеліса
Назва |
Область застосуван- |
Забарвлення |
|
індикатора |
ня індикатора , рН |
кислотне |
лужне |
м-нітрофенол |
6,7 - 8,4 |
безбарвне |
жовте |
п-нітрофенол |
5,2 - 7,0 |
безбарвне |
жовте |
γ-динітрофенол |
4,0 - 5,5 |
безбарвне |
жовте |
α-динітрофенол |
2,8 - 4,5 |
безбарвне |
жовте |
2.Взявши пробірку з апарата Міхаеліса, відміряти в неї піпеткою 0,6 мл досліджуваного розчину і додати при перемішуванні 0,1 мл знайденого індикатора. При цьому повинно з'явитися чітке забарвлення.
3.Пробірку із забарвленим розчином порівнюють з еталонами відповідного ряду. Для цього пробірку ставлять у середній отвір першого ряду компаратора, а в бокові отвори – еталони, що відрізняються на 0,2 рН і найбільш близькі до застосованого еталона рН досліджуваного розчину. У другому ряду компаратора за еталонами ставлять пробірки, що містять 0,6 мл досліджуваного розчину, а в середній отвір другого ряду – просто пробірку з водою. При такому розташуванні пробірок світло проходить через однакові шари рідини при підсумовуванні забарвлень у кожній парі пробірок – рідини і індикатора, в результаті чого власне забарвлення досліджуваної рідини виключається.
4.Пробірку з досліджуваним забарвленим розчином порівнюють з еталонами данного ряду. Можуть бути два випадки: а) забарвлення досліджува-
44
ного розчину співпадає із забарвленням еталона; б) забарвлення розчину блідіше одного, але інтенсивніше забарвлення другого еталона, тоді рН розчину відповідатиме середньому арифметичному із значень їхніх рН.
Примітка: Приготування досліджуваного розчину (грунтової витяжки): змішують у колбі 15 г зразка грунту із 75 мл води, потім збовтують 2-3 хвилини, отриманий розчин фільтрують.
5.Взявши пробірку з апарата Михаеліса, відміряти в неї піпеткою 0,6 мл досліджуваного розчину і додати при перемішуванні 0,1 мл знайденого індикатора. При цьому повинно з'явитися чітке забарвлення.
6.Пробірку із забарвленим розчином порівнюють з еталонами відповідного ряду. Для цього пробірку ставлять у середній отвір першого ряду компаратора, а в бокові отвори – еталони, що відрізняються на 0,2 рН і найбільш близькі до застосованого еталона рН досліджуваного розчину. У другому ряду компаратора за еталонами ставлять пробірки, що містять 0,6 мл досліджуваного розчину, а в середній отвір другого ряду – просто пробірку з водою. При такому розташуванні пробірок світло проходить через однакові шари рідини при підсумовуванні забарвлень у кожній парі пробірок – рідини
йіндикатора, в результаті чого власне забарвлення досліджуваної рідини виключається.
7.Пробірку з досліджуваним забарвленто розчином порівнюють з еталонами даного ряду. Можуть бути два випадки: а) забарвлення досліджуваного розчину співпадає із забарвленням еталона; б) забарвлення розчину блідіше одного, але інтенсивніше забарвлення другого еталона, тоді рН розчину відповідатиме середньому арифметичному із значень їхніх рН.
Примітка: Приготування досліджуваного розчину (ґрунтової витяжки): змішують у колбі 15 г зразка грунту із 75 мл води, потім збовтують 2-3 хвилини, отриманий розчин фільтрують.
Рис. 4.1. Схема розташування розчинів у компараторі: 1, 3 – досліджуваний розчин; 2 – вода; 4,6 – еталони; 5 – досліджуваний розчин + індикатор
4.3.3.Визначення рН ґрунтової витяжки скляним електродом
здопомогою рН-метра-340
Із існуючих методів вимірювання рН розчинів найбільш точним є потенціометричний, що грунтується на вимірюванні ЕРС гальванічної пари, потенціал одного з електродів якої залежить від конценттрації іонів водню, як і потенціали водневого, хінгідронного, сурм'яного, скляного електродів. Другим електродом слугує електрод порівняння - хлор-срібний та ін.
У цікавому для нас випадку для вимірювання рН розчину складається
45
ланцюг із скляного і каломельного електродів, з'єднаних насиченим розчином КCl:
Ag (AgCl; HCl (0,1 н)) |
скло |
/Н+ // КСl; Hg2Cl2 / Н+ |
скляний електрод |
досліджуваний |
каломельний електрод |
|
розчин |
|
Скляний електрод із водневою функ- |
|
|
цією є індикаторним електродом, кало- |
|
|
мельний – електродом порівняння. |
|
|
Скляний електрод із водневою функ- |
|
|
цією являє собою скляну трубочку, що |
|
|
закінчується кулькою із товщиною стінки |
|
|
0,01-0,001 мм. |
|
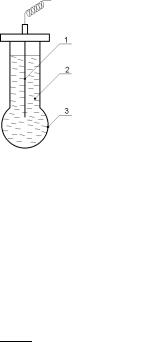
Рис. 4.2. Скляний електрод: |
Кулька заповнена 0,1н розчином HCl, |
||
в який занурено допоміжний хлорсрібний |
1 - Ag/AgCl; 2 - 0,1 н HCl; |
|
електрод (рис. 4.2). |
|
3 - скляна трубка |
Різниця потенціалів в скляному електроді виникає внаслідок обміну катіонами (Н+, Na+, K+, Li+) між склом і розчином. Потенціал скляного електрода залежить від концентрації іонів Н+ в розчині CH+ і в поверхневому шарі СНск+ . :
Еск. = Е0ск. +0,059lg CC+H+ .
Hc+к.
Перед роботою скляний електрод калібрують, тобто встановлюють залежність його потенціалу від рН. Калібрування полягає у вимірюванні потенціалу скляного електрода в буферних розчинах з відомим значенням рН.
Хід роботи
1. Приготування буферних розчинів:
а) ацетатний буферний розчин. Приготувати 100 мл буферного розчину зливанням із бюретки 0,1М CH3COOH і 0,1М CH3COONa при співвідношенні 1:1; рН цього буферного розчину дорівнює 4,65.
б) фосфатний буферний розчин. Приготувати 100 мл буферного розчину зливанням із бюретки 1/15М NaH2PO4 і 1/15М Na2HPO4 при співвідношенні об'ємів 1:1; рН даного буфера дорівнює 6,81.
Буферні розчини добре перемішати і використовувати для налагодження рН-метра.
2.Приготування водної грунтової витяжки. Відважують на лабораторних вагах наважку грунту 20 г, переносять до конічної колби місткістю 200-250 мл і приливають 100 мл дистильованої води. Колбу закривають пробкою і збовтують вміст 5 хвилин Після цього суспензію фільтрують через складчастий фільтр.
3.Вимірювання. Проводять вимірювання за допомогою рН-метра (рис. 4.3).
46
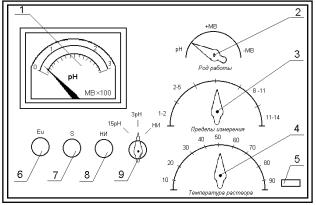
Рис. 4.3. Зовнішня панель рН - метра (рН - 340): 1 – показуючий прилад; 2 – ручка перемикача "Вид роботи"; 3 – ручка перемикача "Межі вимірювання"; 4
– ручка перемикача "Температура розчину"; 5 – контрольна лампочка ; 6 – ручка перемикача "Розмах"; 7 – ручка для вмикання приладу в мережу ; 8 –
(S) – змінний резистор для регулювання шкали; 9 – (Eu) – змінний резистор для плавного настроювання за буферним розчином.
3.1.Підготувати датчик до роботи. Для цього промити електроди дистильованою водою і буферним розчином. Потім налити буферний розчин у скляночку і занурити в неї скляний електрод та трубку від допоміжного електрода.
3.2.Підключити датчик до приладу, для чого штекер кабеля датчика ввімкнути у гніздо "Вим.", а провід заземлення датчика (тонкий) з'єднати із затискачем "Земля" на задній стінці приладу.
3.3.Встановити у вихідне положення: ручку перемикача "Рід роботи" в положення "рН"; ручку перемикача "Розмах " в положення "15 рН"; ручку перемикача "Температура розчину" - на значення температури досліджуваного розчину; ручку перемикача "Межі вимірювання" - в положення що відповідає межі, в якій лежить рН буферного розчину; стрілку показуючого приладу – на початкову позначку шкали.
3.4.Поворотом ручки "HИ-мережа" за годинниковою стрілкою ввімкнути прилад у мережу 220В - 50 Гц. При наявності напруги живлення запалюється контрольна лампочка. Прилад прогріти 30 хвилин.
3.5.Ручку перемикача "Розмах" поставити в положення "3 рН" і зробити відлік значення рН буферного розчину на верхній шкалі показуючого приладу. Відлік робиться таким чином:
вимірювана |
початкове значення рН |
показання , відлічене по |
величина рН = |
для кожного діапазону |
+ верхній шкалі приладу |
(нижня межа вимірювання)
За допомогою резисторів шкала приладу настроюється за буферним розчином.
3.6.По закінченні вимірів рН буферних розчинів ручку "Розмах" поставити в положення "15 рН"
3.7.У скляночці датчика замінити буферний розчин настроювання досліджуваним. При цьому необхідно ретельно промити скляночку та електроди
47
дистильованою водою і досліджуваним розчином.
3.8.Виміряти рН (грубо) за нижньою шкалою приладу й у відповідності з отриманими даними поставити перемикач "Межі вимірювання" в положення, що відповідає потрібному діапозону рН.
3.9.Перемикач "Розмах" поставити в положення "3 рН" і зробити відлік точного значення рН за верхньою шкалою приладу.
3.10.По закінченні вимірів поставити ручку "Розмах" у положення "15 рН". Вимкнути вимикач "НИ - мережа" і шнур, від'єднати дроти датчика і приладу. Промити скляночку й електроди дистильованою водою і залишити
вній електроди.
3.11.Заповнити таблицю:
№ |
Досліджуваний розчин |
рН |
1. |
Буферний розчин №1 |
|
2. |
Буферний розчин № 2 |
|
3. |
Буферний розчин № 3 |
|
4. Приготування буферних розчинів.
У сім однакових пробірок наливають з допомогою бюретки розчини 0,1н оцтової кислоти і 0,1н ацетату Na в об'ємах, вказаних у таблиці:
Показники |
|
|
|
Пробірки |
|
|
|
|
|
1 |
2 |
3 |
4 |
|
5 |
6 |
7 |
Об'єм кислоти в мл |
9,8 |
9 |
8 |
5 |
|
3 |
1,5 |
0,2 |
Об'єм розчину солі в мл |
0,2 |
1 |
2 |
5 |
|
7 |
8,5 |
9,8 |
Знайдене значення рН |
|
|
|
|
|
|
|
|
Обчислене значення рН |
|
|
|
|
|
|
|
|
Розмішавши розчин у пробірках, додають до кожного з них по 3 краплі універсального індикатору і знову збовтують. Розчини забарвлюються в різні кольори. Порівнюючи їх із кольоровою таблицею універсального індикатора, знаходять значення рН суміші.
Визначити рН буферних розчинів можна також з допомогою індикаторів із серії Михаеліса.
Для усіх буферних розчинів обчислюють значення рН і порівнюють їх із експериментальними.
CH+ = K |
N1V1 |
; pH = − lg CH+, |
||
N V |
||||
|
|
|||
|
2 |
2 |
|
|
де К - константа дисоціації оцтової кислоти, дорівнює 1,8 10-5; N1 і N2 - нормальності вихідних розчинів кислоти і солі;
V1 і V2 - об'єми розчинів кислоти і солі. Результати записати в таблицю.
Примітка: Універсальний і.ндикатор поступово змінює забарвлення в широкій області рН. Його готують розчиненням в 1 л еталона 0,2 г метилового червоного, 0,4 г бромтимолового синього, 0,8 г фенолфталеїну. Його забарвлення: рН 4 – червоне, рН 5 – оранжеве, рН 6 – жовте, рН 7 – зелене, рН 8.5 – синє, рН 10 – фіолетове.
