
- •Передмова
- •ВСТУП
- •1. ТЕРЕЗИ І ЗВАЖУВАННЯ
- •1.2. Аналітичні терези АД-200
- •1.3. Аналітичні терези АДВ-200М і ВЛА-200М
- •1.4. Лабораторні аналітичні одноплечі терези
- •1.5. Експериментальна частина
- •1.5.3. Визначення еквівалента елемента
- •1.6. Запитання і задачі
- •1.7. Література
- •2. ТЕПЛОВІ ЕФЕКТИ ХІМІЧНОЇ РЕАКЦІЇ
- •2.1. Вступ
- •2.2. Експериментальна частина
- •2.2.1. Визначення теплоти нейтралізації
- •2.3. Запитання і задачі
- •2.4. Література
- •3. КОМПЛЕКСНІ СПОЛУКИ
- •3.1. Будова комплексних сполук
- •3.2. Номенклатура комплексних сполук
- •3.2.1 Комплексні сполуки - неелектроліти
- •3.2.2. Сполуки з комплексними катіонами
- •3.2.3. Сполуки з комплексними аніонами
- •3.3. Стійкість комплексних іонів
- •3.4. Експериментальна частина
- •3.4.1. Відмінність між простими і комплексними іонами заліза
- •3.4.2. Комплексні катіони
- •3.4.4. Дисоціація комплексних іонів
- •3.4.5. Комплексні аніони
- •3.4.5. Дисоціація подвійних солей
- •3.4.6. Утворення амінів міді
- •3.5. Запитання і задачі
- •3.6. Література
- •4. ВОДНЕВИЙ ПОКАЗНИК рН
- •4.1. Визначення кислотності
- •4.2. Концентрація водневих іонів і показник концентрації водневих іонів рН
- •4.3. Експериментальна частина
- •4.3.1. Вимірювання рН з допомогою індикаторів
- •4.3.2. Колориметричний метод визначення рН
- •4.4. Запитання і задачі
- •4.5. Література
- •5. БУФЕРНІ РОЗЧИНИ
- •5.1. Обчислення рН буферних розчинів, утворених слабкою кислотою та її сіллю
- •5.2. Обчислення рН буферних систем, утворених слабкими основами та їх солями
- •5.3. Експериментальна частина
- •5.3.1. Приготування буферних розчинів
- •5.3.2. Буферна дія
- •5.3.3. Вплив розбавлення на рН буферного розчину
- •5.3.4. Втрата буферної дії
- •5.4. Запитання і задачі
- •5.5. Література
- •6. ШВИДКІСТЬ ХІМІЧНИХ РЕАКЦІЙ І ХІМІЧНА РІВНОВАГА
- •6.1. Швидкість хімічних реакцій
- •6.2. Хімічна рівновага
- •6.3. Експериментальна частина
- •6.3.1. Вплив ступеня подрібнення (величини поверхні зіткнення речовин) на швидкість реакції в гетерогенній системі
- •6.3.2. Розчинення карбонату кальцію в соляній кислоті
- •6.3.3. Залежність швидкості реакції від концентрації
- •6.3.4. Вплив температури на швидкість реакції
- •6.3.5. Вплив концентрації реагуючих речовин на хімічну рівновагу
- •6.3.6. Оборотність зміщення хімічної рівноваги
- •6.3.7. Вплив температури на хімічну рівновагу (груповий дослід)
- •6.4. Запитання і задачі
- •6.5. Література
- •7. ВЛАСТИВОСТІ S-ЕЛЕМЕНТІВ
- •7.2. Елементи ІА-підгрупи (водень, натрій, калій)
- •7.3. Елементи ІІА-підгрупи (магній і кальцій)
- •7.4. Експериментальна частина
- •7.4.1. Одержання водню
- •7.4.2. Окислювальні і відновлювальні властивості пероксиду водню
- •7.4.3. Реакції катіона натрію
- •7.4.4. Реакція катіона калію
- •7.4.5. Реакції катіона магнію
- •7.4.6. Реакції катіона кальцію
- •7.5. Запитання і задачі
- •7.6. Література
- •8.2. Елементи ІІІА-підгруш (бор і алюміній)
- •8.3. Елементи ІVА-підгруп (вуглець і кремній)
- •8.4. Елементи VА-підгрупи (азот і фосфор)
- •8.6. Елементи VІА-підгрупи (кисень і сірка)
- •8.7. Елементи VІІА-групи (галогени)
- •8.8.2. Гідроліз бури
- •8.8.3. Якісний аналіз бору
- •8.8.4. Дія лугів і кислот на алюміній (під тягою)
- •8.8.8. Відновлювальні властивості вугілля
- •8.8.9. Гідроліз солей вугільної кислоти
- •8.8.10. Одержання і властивості кремнію
- •8.8.11. Одержання і властивості аміаку
- •8.8.12. Одержання і властивості кальцієвих солей ортофосфорної кислоти
- •8.8.14. Одержання кисню і вплив каталізатора на швидкість розкладу KСlO3
- •8.8.16. Реакція хлорид-іона
- •9.2. Біологічна роль деяких важливих d-елементів
- •9.2.1. Реакції катіона марганцю з лугами (NаОН і KOH)
- •9.2.2. Реакції катіона цинку
- •9.2.3. Реакції катіона кобальту
- •9.2.4. Реакції катіонів срібла
- •9.2.5. Реакції катіонів свинцю
- •9.2.6. Реакції катіонів ртуті (І)
- •9.2.7. Реакції катіонів міді
- •9.3. Література
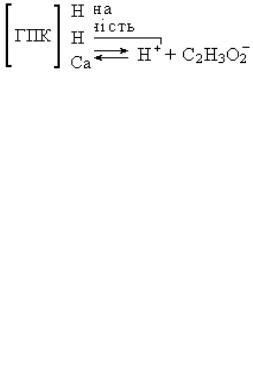
38
4.ВОДНЕВИЙ ПОКАЗНИК рН
4.1.Визначення кислотності
Ваналітичній практиці розрізняють активну (актуальну), потенційну (гідролітичну) і загальну кислотність. Наочно ці види кислотності можна подати такою схемою:
потенційна активна кислотність кислотність
Активна кислотність обумовлена наявністю в розчині іонів водню. У грунтах активна (актуальна) кислотність безпосередньо впливає на корені рослин і мікроорганізми. Ефективність багатьох мінеральних добрив, раціональні прийоми вапнування грунтів, виробництво молочних продуктів, силосування кормів тощо пов'язані з актуальною кислотністю.
Потенційна кислотність грунту обумовлена наявністю поглинутих іонів водню в ґрунтовому поглинаючому комплексі (ГПК):
Поглинуті іони водню можуть бути витіснені в розчин лише впливом на грунт катіонами розчинених солей. Сума актуальної і потенційної кислотності складає загальну кислотність грунту.
Для характеристики грунтів дуже велике значення має визначення активної і потенційної кислотності. Визначення гідролітичної кислотності необхідне при вапнуванні грунтів. Її встановлюють шляхом обробки грунту розчином гідролітичне лужних солей (наприклад, ацетату натрію) і наступним титруванням витяжки.
4.2. Концентрація водневих іонів і показник концентрації водневих іонів рН
Вода – вельми слабкий електроліт і дисоціює дуже малою мірою за рів-
нянням:
Н2О ↔ Н+ + ОН− .
Як відомо, іони водню у водних розчинах гідратовані, тому більш правильно було б подати цей процес таким чином:
2Н2О ↔ Н3О+ + ОН− .
Однак для простоти користуються першим рівнянням, оскільки це не впливає на висновки.

39
Застосувавши до процесу дисоціації води закон діючих мас, отримаємо рівняння:
КН2О = [H ][OH |
|
], |
+ |
− |
(1) |
[H2 O] |
|
|
де КН2О – константа дисоціації води. При 22 °С КН2О = 1,8 10-16 звідки видно,
що тільки незначна частина молекул води дисоційована. Тому концентрацію недисоційованих молекул води можна вважати величиною постійною і рівність (1) подати у вигляді:
КН2О [H2O] = КВ = [Н+] [ОН− ], |
(2) |
де КВ – постійна величина, яка називається іонним добутком води: [H2O] = 18,011000 = 55,56 моль/л.
Підставивши ці числові значення у вираз (2) знайдемо значення іонного добутку води при 22°С:
КВ = [Н+] [ОН− ] = 1,8 10-16 55,56 = 1 10-14. |
(3) |
||||
Ці значення змінюються з температурою таким чином: |
|
||||
|
|
|
|
|
|
Температура, °С |
10 |
22 |
50 |
70 |
100 |
КВ |
0,36 10-14 |
1,0 10-14 |
5,6 10-14 |
21 10-14 |
74 10-14 |
У чистій воді (при 22°С) концентрація іонів водню дорівнює концентрації гіроксид-іонів:
[Н+] = [ОН− ] =  10−14 = 10-7 моль/л.
10−14 = 10-7 моль/л.
Звідси видно, що в 10 000 000 л води тільки 1 моль, тобто 18 г, розпадається на іони. Незважаючи на таке мале значення, дисоціація води відіграє
велику роль. Будь-який водний розчин містить як іони Н+, так і ОН−. Додавання до води кислот підвищує концентрацію іонів Н+ у розчині, при цьому
знижується концентрація іонів ОН−, але значення КВ залишається постійним. Таким чином, підвищення концентрації іонів водню обумовлює відповідне зменшення концентрації гідроксид-іонів, і навпаки. Концентрація водневих іонів Н+ (так само, як і гідроксид-іонів) у водних розчинах може коливатися в інтервалі від 1 до 10-14, але добуток їх концентрацій (при 22°С) зав-
жди дорівнює 10-14.
Отже, кислотність і лужність розчину можна виразити через концентрацію іонів водню або гідроксид-іонів. Звичайно користуються концентрацією іонів водню Н+: [Н+] = 10-7 – нейтральне середовище, [Н+] > 10-7 – кисле середовище; [Н+] < 10-7 – лужне середовище. Якщо відома концентрація іонів Н+, можна розрахувати концентрацію ОН− (і навпаки).
Описаний спосіб вираження кислотності та лужності розчинів створює
40
певні незручності при графічному вираженні і при малих значеннях [Н+]. На початку цього століття датський вчений Зеренсен запропонував для
передачі реакції середовища користуватися не самою величиною [Н+], а так
званим водневим показником - рН: |
|
рН = − lg [Н+]. |
(4) |
Водневим показником називається величина, що характеризує концентрацію водневих іонів і чисельно дорівнює негативному десятковому логарифму цієї концентрації (в моль/л).
Відповідно, [Н+] можна виразити через рН: |
|
[Н+] = 10-pH. |
(5) |
Показник концентрації гідроксид-іонів також, виражають у вигляді
негативного десяткового логарифма їх концентрацій рОН: |
|
рOН = − lg [ОН− ], |
(6) |
[ОН− ] = 10-pOH. |
(7) |
При 22°С у нейтральному середовищі рН = 7, в кислому - рН < 7, а в лужному рН>7.
Логарифмуючи рівняння іонного добутку води (3) і змінюючи знаки,
одержимо: |
|
(− lg [Н+] ) + (− lg [ОН− ] ) = − lg 10-14, або рН + рОН = 14. |
(8) |
Зв'язок між концентраціями [Н+], [ОН− ], величинами рН і рОН розчинів показаний у таблиці 4.1.
Таблиця 4.1. Зв'язок між концентраціями [Н+], [ОН− ], величинами рН і рОН розчинів
КВ |
Н+ |
ОН− |
рН |
рОН |
Характер реакції |
10-14 |
10 |
10-14 |
0 |
14 |
|
10-14 |
10-1 |
10-13 |
1 |
13 |
Сильнокисла |
10-14 |
10-2 |
10-12 |
2 |
12 |
|
10-14 |
10-3 |
10-11 |
3 |
11 |
|
10-14 |
10-4 |
10-10 |
4 |
10 |
Кисла |
10-14 |
10-5 |
10-9 |
5 |
9 |
|
10-14 |
10-6 |
10-8 |
6 |
8 |
Слабокисла |
10-14 |
10-7 |
10-7 |
7 |
7 |
Нейтральна |
10-14 |
10-8 |
10-6 |
8 |
6 |
|
10-14 |
10-9 |
10-5 |
9 |
5 |
Слабколужна |
10-14 |
10-10 |
10-4 |
10 |
4 |
|
10-14 |
10-11 |
10-3 |
11 |
3 |
Лужна |
10-14 |
10-12 |
10-2 |
12 |
2 |
|
10-14 |
10-13 |
10-1 |
13 |
1 |
Сильнолужна |
10-14 |
10-14 |
100 |
14 |
0 |
|
