
Kolloidnaya_khimia_2
.pdf
|
Оглавление |
|
|
|
|
|
стр. |
1. |
Лекция 1. Введение в коллоидную химию |
4 |
|
2. |
Лекция 2. Поверхностные явления |
10 |
|
3. |
Лекция 3. Теория адсорбции Ленгмюра |
16 |
|
4. |
Лекция 4. |
Адсорбция ПАВ и полимеров |
21 |
5. |
Лекция 5. |
Адгезия, смачивание и растекание жидкостей |
23 |
6. |
Лекция 6. |
Электроповерхностные явления |
30 |
7. |
Лекция 7. |
Дисперсные системы |
40 |
8.Лекция 8. Свойства и методы исследования
дисперсных систем |
46 |
9.Лекция 9. Оптические свойства и методы исследования
дисперсных систем |
51 |
10. Лекция 10. Устойчивость дисперсных систем |
56 |
11.Лекция 11. Структурно-механические свойства и
реологический метод исследования дисперсных систем |
66 |
3
1. ЛЕКЦИЯ 1
Литература:
1.Фролов Юрий Геннадьевич, Курс коллоидной химии. Поверхностные явления и дисперсные системы.
2.Фридрихсберг Дмитрий Александрович, Курс коллоидной химии.
3.Воюцкий Сергей Сергеевич, Курс коллоидной химии.
4.Лабораторные работы и задачи по коллоидной химии, под редакцией Фролова Ю.Г. и Гродского А.С.
1.1.Введение в коллоидную химию
По Фридрихсбергу: «Современная коллоидная химия это наука о высокораздробленном состоянии вещества, наука о поверхностях и коллоидах».
Слово коллоид происходит от греческих æολλα – клей, ειδοσ – вид (то есть клеевидный).
По Фролову: «Коллоидная химия это наука о поверхностных явлениях и дисперсных системах. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазовом поверхностном слое».
Основной коллоидно-химической характеристикой является дисперсность, то есть рассеянность, раздробленность вещества. В коллоидной химии понятие дисперсности простирается на широкую область размеров тел: от больших, чем простые молекулы, до видимых невооруженным глазом, то есть от 10-9 до 10-4 м или от 1 нм до 100 мкм. Дисперсионная система в простейшем случае представляет собой дисперсную фазу, распределенную в дисперсной среде. Дисперсные системы с одинаковыми по размеру частицами называются монодисперсными, а с неодинаковыми – полидисперсными.
Коллоидное состояние – это всеобщее особое состояние материи, основными признаками которого являются дисперсность и гетерогенность. Дисперсные системы гетерогенны. Дробя и умельчая любое тело, мы непрерывно увеличиваем его суммарную поверхность, сохраняя неизменным его объем и массу. Таким образом по мере роста дисперсности (раздробленности) увеличивается удельная поверхность, то есть поверхность приходящаяся на единицу массы или объема, достигая весьма больших значений.
4

S |
|
|
S |
или S |
|
|
S |
или, S |
|
|
S |
|
S |
, |
|
уд |
m |
уд |
V |
уд |
m |
V |
|||||||||
|
|
|
|
|
|
|
|
где S уд – удельная поверхность, м2/г;
S – площадь дисперсной фазы, м2; m – масса дисперсной фазы, кг;
V– объем дисперсной фазы, м3;
– плотность дисперсной фазы, кг/м3.
|
Для частиц кубической формы: S |
|
|
6l 2 |
, |
|
|
|
|
|
|
|
|
|
|
уд |
|
|
|
|
|
|
|
|
|
||||
|
|
|
l |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где l |
– длина ребра, м. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для частиц шарообразной формы: S |
|
|
|
4 r 2 |
|
|
3 |
|
6 |
, |
|||
|
уд |
4 |
r |
3 |
r |
|
d |
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
||
где r |
– радиус частицы, м; |
|
|
|
|
|
|
|
|
|
|
|
|
|
d– диаметр частицы, м.
Вобщем случае: S уд Ra RD ,
где R – коэффициент формы частицы; a – линейный размер, м;
D – дисперсность, величина, обратная линейному размеру, м-1.
|
Увеличение S уд |
проиллюстрируем на примере дробления куби- |
|||
ка с длиной ребра в 1 см. (табл. 1). |
|
|
|||
|
|
|
|
|
Таблица 1. |
Длина ребра дробных |
|
Число частиц |
S уд , см-1 |
||
частиц l, см |
|
|
|
|
|
1 |
|
|
1 |
6 |
|
10-1 |
(1 мм) |
|
103 |
6·10 |
|
10-4 |
(1 мкм) |
|
1012 |
6·104 |
|
10-7 |
(1 нм) |
|
1021 |
6·107 |
= 6000 м2/ 1 см3 |
По мере дробления вещества происходит переход количественных изменений к возникновению нового качества. Наряду с изменением свойств веществ, характерных для обычного состояния, появляются и новые, присущие состоянию коллоидному. Реальный окружающий нас мир, как и мы сами, состоит из дисперсных систем, поэтому коллоидную химию можно назвать химией реальных тел. По образному выражению Пескова: «Человек – это движущийся коллоид».
Чем же объясняется своеобразие свойств вещества в коллоидном состоянии? Прежде всего тем, что в этом состоянии значительная
5
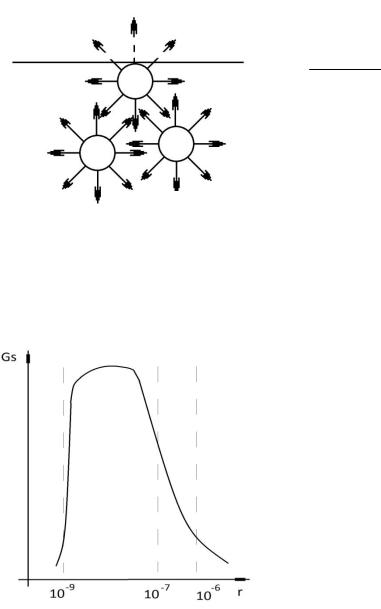
доля от всех молекул или атомов, составляющих вещество, находится на поверхности раздела фаз. Эти молекулы являются «особенными» по своему энергетическому состоянию, они обладают избыточной свободной энергией. Например, для частиц кубической формы с длиной ребра l = 10-6 м, на котором помещается ≈ 5000 молекул (считая
размер одной молекулы в 2·10-10 м или в 2 ), доля поверхностных из
них, т.е. «особенных» составляет ~ 0,1%.
Число молекул на длине ребра n = 10-6/(2·10-10) = 5000 молекул. Поверхностных молекул в кубике: Sмол = 6·5000·5000 = 150·106 молекул, а в объеме кубика Vмол= 5000·5000·5000 = 125·109 молекул, тогда доля поверхностных молекул составит Sмол/Vмол = 150·106/(125·109) ≈
≈ 1·10-3 или ≈ 0,1%.
Для частиц с длиной ребра 2 нм, на котором помещается 10 молекул, доля поверхностных из них составля-
ет: 6 10 10 0,6 или 60%. 10 10 10
Таким образом во сколько раз уменьшается длина ребра кубической частицы, во столько же раз увеличивается доля поверхностных молекул относительно их общего количества в этой частице. Последнее обстоятель-
ство составляет основную и важнейшую особенность коллоидного состояния: значительная доля всей свободной энергии системы сосредоточена в межфазных поверхностных слоях (рис. 1), что является причиной возникновения явлений, получивших название поверхностных.
На рис. 2 показано изменение
|
свободной поверхностной энергии GS |
|
системы по мере дробления (диспер- |
|
гирования) ее частиц. Неограничен- |
|
ное диспергирование гетерогенной |
|
системы переводит ее в гомогенный |
|
молекулярный раствор. Этот переход |
|
сочетает в себе единство непрерыв- |
|
ности и скачка, то есть переход коли- |
|
чественных изменений в качествен- |
|
ные. Границы области коллоидного |
Рис.2 |
состояния ≈ 1 ~ 100 нм, хотя колло- |
|
|
|
6 |
идная химия изучает и более крупные объекты, поскольку в них обнаруживаются признаки, присущие коллоидным системам.
1.2. Классификация дисперсных систем.
Классификация по дисперсности (по размеру частиц)
1. Грубодисперсные с размерами частиц 10-4 ~ 10-6 м;
1 |
|
= 10-10 м (размер молекул); |
|
|
|
1 нм = 10-9 м; 1 мкм = 10-6 м; 1 мм = 10-3 м.
2.Микрогетерогенные с размерами 10-6 ~ 10-7 м.
3.Ультрамикрогетерогенные или истинно коллоидные с размерами частиц 10-7 ~ 10-9 м.
Микрогетерогенные и ультрамикрогетерогенные системы так-
же называют высокодисперсными.
Частица наименьших размеров состоит из нескольких молекул
(5 – 10).
Высокодисперсные системы называются золями. Различают гид- ро-, органо- и аэрозоли.
Грубодисперсные системы неустойчивы: они оседают или всплывают в гравитационном поле; не проходят через бумажный фильтр и видимы глазом или в обычный микроскоп. Это суспензии, эмульсии, взвеси.
Высокодисперсные системы практически не оседают и не всплывают, задерживаются только ультрафильтрами (целлофан, пергамент) и невидимы в оптический микроскоп.
Отметим, что система приобретает коллоидные свойства даже тогда, когда хотя бы одно из трех измерений находится в указанной области высокой дисперсности. Это двумерно и одномернопротяженные системы; в связи с этим различают системы корпускулярные, фибриллярные и ламелярные. Например живые клетки, вирусы, нервы, мышцы, волокна, мембраны, пленки, фольги, асбест, бумага и т.д.
Приведем размеры частиц некоторых корпускулярных систем:
грунты песчаные |
свыше 50 мкм |
|
грунт планеты Венера |
0,1 … 10 мкм |
|
эритроциты крови |
до 7 мкм |
|
мутная вода |
10 |
… 100 нм |
дым сигареты |
30 |
… 40 нм |
золь золота |
20 |
нм |
поры активированного угля |
1 … 10 нм |
|
|
7 |
|

вирус гриппа |
0,1 … 100 нм |
Классификация по агрегатному состоянию
Существуют восемь типов дисперсных систем (табл. 2), благодаря различным сочетаниям агрегатных состояний дисперсной фазы и дисперсионной среды и только газ в газе не образует гетерогенной системы, хотя в атмосфере Земли и наблюдаются флуктуации плотности различных газов, но они короткоживущие, да и различия в плотностях не столь велики. Все это не позволяет создать сколь-нибудь устойчивую дисперсионную систему (гетерогенную) газ в газе.
|
|
|
|
|
|
Таблица. 2 |
|
Дисп. фаза / дисп. |
Условн. |
Тип системы |
Примеры |
|
|
||
среда |
обозн. |
|
|
|
|
|
|
|
|
|
|
Илы, краски, взве- |
|
||
Твердое/жидкость |
Т/Ж |
Золи, |
сус- |
си, пульпы, пасты, |
|
||
пензии |
|
золи |
металлов, |
|
|||
|
|
|
|
||||
|
|
|
|
бактерии и вирусы |
|
||
|
|
|
|
Смазки, |
|
нефть, |
|
|
|
Эмульсии, |
молоко, |
|
вода- |
|
|
Жидкость/жидкость |
Ж/Ж |
масло (сожи), кре- |
|
||||
органозоли |
|
||||||
|
|
мы, вина, сливоч- |
|
||||
|
|
|
|
|
|||
|
|
|
|
ное масло, майонез |
|
||
|
|
|
|
Флотацинные, |
|
||
Газ/жидкость |
Г/Ж |
Пены |
|
мыльные, |
пивные |
|
|
|
|
|
|
пены, шампанское. |
|
||
|
|
|
|
Цветные |
стекла, |
|
|
|
|
|
|
пластмассы, сталь, |
|
||
Твердое/твердое |
Т/Т |
Сплавы, |
|
чугун, |
бетон, са- |
|
|
твердые золи |
моцветы, |
керами- |
|
||||
|
|
|
|||||
|
|
|
|
ка, минералы, си- |
|
||
|
|
|
|
таллы |
|
|
|
|
|
Твердые |
|
Адсорбенты в рас- |
|
||
|
|
эмульсии, |
творах, |
|
почвы, |
|
|
Жидкость/твердое |
Ж/Т |
гели, капил- |
грунты, опал, хо- |
|
|||
|
|
лярные |
сис- |
лодец, |
|
жемчуг, |
|
|
|
темы |
|
перламутр |
|
|
|
Газ/твердое |
Г/Т |
Твердые |
пе- |
Катализаторы в га- |
|
||
ны, пористые |
зах, активирован- |
|
|||||
|
|
|
|||||
|
|
8 |
|
|
|
|
|
|
|
|
и капилляр- |
ный уголь, силика- |
|
|
|
|
ные системы |
гель, пемза, пено- |
|
|
|
|
|
пласт, пенобетон |
|
|
Твердое/газ |
Т/Г |
Аэрозоли |
Дымы, пыли, |
по- |
|
рошки, пудра |
|
|||
|
|
|
|
|
|
|
Жидкость/газ |
Ж/Г |
Аэрозоли |
Тучи, туманы, |
об- |
|
лака, дезодоранты |
||||
|
|
|
|
||
Классификация по структуре |
|
|
|
||
Все дисперсные системы можно разделить на два класса: свободнодисперсные, в которых частицы свободно перемещаются друг относительно друга (золи, эмульсии), и связнодисперсные, в которых одна из фаз структурно закреплена (мембраны, капиллярные системы, гели, студни, пены, твердые растворы).
Классификация по межфазному взаимодействию
Различают лиофильное и лиофобное взаимодействие. Взаимо-
действие между веществами дисперсной фазы и дисперсионной среды за счет межмолекулярных сил на границе раздела фаз протекает всегда, но степень его проявления может быть различной. Лиофильное взаимодействие является сильным («любящее» растворение), лиофобное взаимодействие слабое («боящееся» растворения). Лиофильные коллоиды после выпадения в осадок могут быть снова переведены в раствор добавлением растворителя (белок, желатин и др.). Лиофобные коллоиды выпадают в осадок необратимо.
Мыла и многие глины самопроизвольно «распускаются» в воде, а высокомолекулярные соединения (ВМС) растворяются в «хорошем» растворителе до отдельных молекул – все это характерно для лиофильных систем.
Классификация по фазовой различимости
Растворы ВМС занимают особое место в коллоидно-химической классификации. Являясь по существу истинными, они обладают в тоже время многими признаками коллоидного состояния. Размеры макромолекул являются соизмеримыми с размерами коллоидных частиц. Поскольку растворы ВМС диалектически сочетают свойства молекулярных растворов и коллоидных систем, целесообразно назвать их
9
молекулярными коллоидами, в отличии от типичных высокодисперсных систем, называемых суспензиями.
Коллоидная химия изучает свойства высокодисперсных систем на основе поверхностных явлений, а также физико-химические свойства ВМС и их растворов.
1.3. Значение современной коллоидной химии
Большую роль коллоидная химия играет в следующих областях науки и техники:
– развитие учения о почве, ее плодородии, применении удобре-
ний;
–в геологии и геофизике. в методах исследования грунтов и минералов, разведке полезных ископаемых;
–в производстве стройматериалов (цементов, краски), их качество зависит от дисперсности;
–в методах очистки природных и сточных вод;
–в кожевенной, бумажной, текстильной, пищевой, фармацевтической и парфюмерной отрасли промышленности;
–в производстве пластмасс, эластомеров и искусственных воло-
кон;
–в химической технологии: измельчение сырья, обогащение, флотация, сгущение и т.д.
Явления смачивания, капиллярность, адсорбция, адгезия, пропитка, седиментация и коагуляция и другие рассматриваются в нашем курсе.
ЛЕКЦИЯ 2.
Поверхностные явления
2.1. Классификация поверхностных явлений
Как было уже отмечено, существуют два основных признака коллоидного состояния: гетерогенность, как признак, указывающий на наличие межфазной поверхности (поверхностного слоя) и дисперсность, как мера раздробленности вещества. Дисперсность является количественным параметром, гетерогенность указывает на качественную характеристику объектов.
10
Различают межфазные поверхности между жидкостью и газом, жидкостью и твердым веществом, газом и твердым веществом. Поверхностный слой жидкости отличается большой подвижностью, процессы испарения и конденсации непрерывно обновляют его. Среднее время жизни, например молекул воды на поверхности, ≈ 10-7 с. Плотность граничного слоя непрерывно изменяется от плотности жидкой фазы до плотности ее насыщенного пара. Толщина поверхностного слоя жидкости составляет несколько молекул. Поверхность жидкости эквипотенциальна.
Поверхность твердых тел характеризуется практической неподвижностью атомов и молекул, ее составляющих, что обуславливает неизменность ее формы во времени. Поверхность твердых тел неэквипотенциальна, она изобилует деформациями кристалличекой решетки, микротрещинами, инородными включениями.
Объекты коллоидной химии можно охарактеризовать определенным видом энергии, которым они обладают. Поскольку гетерогенность предполагает наличие поверхностного напряжения, а дисперсность характеризуется площадью поверхности, то произведение этих величин дает поверхностную энергию: GS S уд . Объекты кол-
лоидной химии обладают избыточной свободной поверхностной энергией.
Фактором интенсивности поверхностной энергии является поверхностное натяжение , обусловленное нескомпенсированным полем межмолекулярных сил на межфазной поверхности. можно рассматривать как работу переноса молекул из объема тела на поверхность. Так как связано с работой, расходуемой на разрыв межмолекулярных связей, то оно ими и обусловлено. Чем сильнее эти связи, тем больше на границе с газовой фазой. меньше у неполярных жидкостей и больше у полярных, оно больше у веществ, обладающих водородными связями. Из всех жидкостей вода обладает наибольшим поверхностным натяжением .
|
|
|
|
В СИ размерность , |
Дж |
или |
Н |
|
. Часто пользуются |
эрг |
или |
|||||
|
|
|
|
м 2 |
м |
см 2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
дин |
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
см 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1 |
Дж |
= 1000 |
эрг |
; |
H2O(298) = 71,96·10-3 |
|
Дж |
. |
|
|||||||
м 2 |
см 2 |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
м 2 |
|
|||||
Из объединенного уравнения первого и второго начал термодинамики для гетерогенной системы:
11
dU TdS PdV dS уд i dni i dqi
где U – внутренняя энергия; S – энтропия;
T – температура; V – объем;
P– давление;
– поверхностное натяжение;
Sуд – площадь поверхности;
i – химический потенциал компонента i ; ni – число молей компонента i ;
i – электрический потенциал; qi – количество электричества.
следует, что есть частная производная по площади межфазной поверхности от любого термодинамического потенциала при постоянных соответствующих параметрах
|
U |
|
H |
|
F |
|
G |
|
|
|
|
|
|
|
|
|
S S,V , n, q |
|
S S, P, n, q |
|
S T ,V , n, q |
|
S T , P, n, q |
Свободная избыточная поверхностная энергия дисперсной системы GS может быть превращена в различные виды энергии:
1 |
2 |
3 |
4 |
5 |
GS SdT VdP dS уд i dni |
i dqi |
|||
1. – В энергию Гиббса; 2. – В теплоту; 3 – В механическую энергию; 4 – В химическую энергию; 5 – В электрическую энергию.
Каждое из этих превращений сопровождается возникновением определенного поверхностного явления:
– явление изменения реакционной способности в кинетике гетерогенного и каталитических процессов (рассматривается в курсе физической химии) при изменении поверхности, на которой протекает процесс;
12
