
Физические методы исследования в химии
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ТОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
УТВЕРЖДАЮ Декан химического факультета Ю.Г. Слижов «___» ___________
О.К. Базыль
ФИЗИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ В ХИМИИ
Учебное пособие
Томск
2013
УДК 543.42 ББК 22.344а73 П 25
Базыль О.К.
П25 Физические методы исследования в химии : учеб. пособие. –Томск : Томский государственный университет, 2013. – 88 с.
Дается краткое описание теоретических основ ряда физических методов исследования вещества. Цель данного руководства – знакомство с областями и возможностями применения оптических (колебательной, вращательной, электронной спектроскопии и фотофизики молекул), резонансных (ЭПР и ЯМР) методов и методов измерения дипольных моментов.
Для студентов химического факультета, изучающих курс «Строение вещества».
Рецензент –
канд. хим. наук, проф. кафедры физической и коллоидной химии Т.С. Минакова
УДК 543.42 ББК 22.344а73
I
Базыль О.К., 2013Томский государственный университет, 2013
2
ОГЛАВЛЕНИЕ |
|
ПРЕДИСЛОВИЕ .......................................................................................................................... |
5 |
РАЗДЕЛ ПЕРВЫЙ. Электрический дипольный момент, его природа |
|
и методы определения ......................................................................................................... |
7 |
Глава 1. Теоретические основы метода ................................................................................... |
7 |
1.1. Природа дипольного момента ........................................................................................ |
7 |
1.2. Диполь в статическом электрическом поле. Поляризуемость молекулы .................. |
9 |
1.3. Диэлектрик в статическом электрическом поле. Поляризация диэлектрика .......... |
10 |
1.4. Уравнения Дебая и Клаузиуса–Моссотти ................................................................... |
11 |
1.5. Поляризация диэлектрика при высоких частотах электромагнитного поля. |
|
Молярная рефракция ..................................................................................................... |
13 |
Глава 2. Методы измерения дипольного момента и использование его в химии ........ |
15 |
2.1. Первый метод Дебая ...................................................................................................... |
15 |
2.2. Определение дипольного момента с помощью эффекта Штарка ............................. |
16 |
2.3. Метод электрического резонанса ................................................................................. |
16 |
2.4. Использование данных по дипольным моментам в химии ...................................... |
17 |
Контрольные вопросы .............................................................................................................. |
19 |
Задания ......................................................................................................................................... |
19 |
РАЗДЕЛ ВТОРОЙ. Оптические спектральные методы .................................................... |
21 |
Глава 3. Теоретические основы спектральных методов ................................................... |
21 |
3.1. Постулаты Бора .............................................................................................................. |
21 |
3.2. Разделение энергии молекул на части и основные типы спектров .......................... |
22 |
Глава 4. Вращательные спектры двухатомных молекул .................................................. |
23 |
4.1. Энергия вращательных стационарных уровней ......................................................... |
23 |
4.1.1. Сферических волчок ........................................................................................... |
24 |
4.1.2. Симметричный волчок ........................................................................................ |
25 |
4.2.3. Линейная молекула ............................................................................................. |
25 |
4.2. Правила отбора и вращательный спектр поглощения ............................................... |
26 |
4.3. Определение геометрических параметров молекул из вращательных спектров .... |
27 |
Контрольные вопросы .............................................................................................................. |
28 |
Задания ......................................................................................................................................... |
29 |
Глава 5. Колебания молекул. |
|
Определение структуры и свойств двухатомных молекул ........................................ |
30 |
5.1. Теоретические основы метода ИК-спектроскопии .................................................... |
30 |
5.2. Колебательный спектр гармонического осциллятора ............................................... |
31 |
5.3. Колебательный спектр ангармонического осциллятора ........................................... |
33 |
Глава 6. Колебательные спектры многоатомных молекул .............................................. |
35 |
6.1. Классификация нормальных колебаний ....................................................................... |
35 |
6.2. Групповые и характеристические частоты ................................................................. |
35 |
6.3. Применение ИК спектроскопии ................................................................................... |
37 |
Контрольные вопросы .............................................................................................................. |
38 |
Задания ........................................................................................................................................ |
41 |
Глава 7 . Электронные спектры поглощения и излучения молекул. |
|
Внутримолекулярные фотофизические процессы ....................................................... |
42 |
3
7.1. Электронные состояния и спектры двухатомных молекул ...................................... |
42 |
7.2. Принцип Франка-Кондона для внутримолекулярных процессов ............................ |
44 |
7.3. Электронные спектры поглощения многоатомных молекул. |
|
Закон Ламберта – Бера .................................................................................................. |
46 |
7.4. Классификация электронных переходов .................................................................... |
49 |
7.5. Процессы дезактивации поглощенной энергии. |
|
Диаграмма энергетических уровней ............................................................................ |
50 |
7.6. Флуоресценция и ее законы ......................................................................................... |
53 |
7.7. Применение электронных спектров ............................................................................ |
55 |
Контрольные вопросы ............................................................................................................. |
58 |
Задания ........................................................................................................................................ |
59 |
РАЗДЕЛ ТРЕТИЙ. Резонансные методы исследования .................................................... |
63 |
Глава 8. Спектроскопия электронного парамагнитного резонанса ................................ |
63 |
8.1. Теоретические основы метода. Эффект Зеемана ....................................................... |
63 |
8.2. Условие простого резонанса. g - Фактор ................................................................... |
64 |
8.3. Электрон - ядерное взаимодействие ............................................................................ |
65 |
8.4. Сверхтонкая структура спектров ЭПР ........................................................................ |
67 |
8.5. Применение спектров ЭПР в химии ............................................................................ |
68 |
Контрольные вопросы .............................................................................................................. |
69 |
Задания ........................................................................................................................................ |
70 |
Глава 9. Спектроскопия ядерного магнитного резонанса ................................................ |
71 |
9.1. Магнитный момент ядра и его взаимодействие с магнитным полем. |
|
Условие простого ядерного резонанса ........................................................................ |
71 |
9.2. Химический сдвиг сигнала ЯМР ................................................................................. |
74 |
9.3. Спин-спиновое взаимодействие и мультиплетность сигналов ЯМР ....................... |
76 |
9.4. Применение спектров ЯМР в химии ........................................................................... |
78 |
Контрольные вопросы ............................................................................................................. |
80 |
Задания ........................................................................................................................................ |
80 |
ПЛАНЫ СЕМИНАРСКИХ ЗАНЯТИЙ ................................................................................. |
82 |
ЛИТЕРАТУРА ............................................................................................................................ |
85 |
4
ПРЕДИСЛОВИЕ
В настоящее время очевидно, что развитие химии невозможно без широкого использования физических методов исследования строения и свойств вещества. Арсенал современных физических методов в химии настолько обширен, а применение их настолько разнообразно, что требует систематического изучения теоретических принципов, лежащих в основе того или иного метода для грамотного понимания возможностей метода, практического применения и трактовки результатов измерений.
Измеряемые характеристики вещества в одних случаях необходимы для устанавливания закономерностей, связывающих физические и химические свойства вещества с химическим строением отдельных молекул, а в других - для оптимизации технологических процессов. Кроме определения основных характеристик и свойств молекул некоторые из физических методов исследования позволяют изучать кинетические равновесия и механизмы химических реакций.
Наряду с совершенствованием оборудования и приборов, применяемых при исследовании, важной тенденцией современного использования физических методов является их комплексное использование, особенно в целях идентификации вещества и установления его химического строения. Наиболее широко в этих целях применяются оптические и резонансные спектральные методы (ИК-, УФ-, ЯМР- (ПМР-) спектры) и массспектроскопия. В настоящее время для полного и достоверного решения задачи требуются данные возможно большего числа методов.
Учебный план раздела "Физические методы исследования в химии" курса "Строение вещества" включает в себя лекции, семинарские и лабораторные занятия. Настоящее учебное пособие составлено в помощь студентам при подготовке к семинарским занятиям. В силу ограниченного числа часов, отведенных планом на семинарские занятия, на них рассматриваются только методы оптической и резонансной спектроскопии, а также методы измерения дипольного момента молекул. Именно эти методы рассмотрены в пособии. В пособии изложены теоретические основы каждого из методов без загромождения математическими выкладками и сложными формулами, что важно для первого знакомства студентов с предметом, определены области их применения и возможности.
Пособие состоит из трех разделов, содержащих 9 глав, каждая из которых посвящена одному методу. В пределах главы коротко изложена теория, на которой базируется метод, область применения данного метода, его
5
достоинства и недостатки. Следующие за теорией контрольные вопросы рассчитаны на проверку понимания студентом изучаемого материала, задания – на попытку применения знания каждого из рассматриваемых методов. По каждому методу приведен план семинарского занятия.
На лабораторных занятиях студенты занимаются расшифровкой ИК-, ПМРспектров многоатомных молекул и масс-спектрограмм. В лекционном курсе по разделу "Физические методы исследования в химии" рассматриваются все наиболее часто используемые в настоящее время в химии физические методы, их современная техническая база. Таким образом, данный курс охватывает знакомство со всеми наиболее часто используемыми в настоящее время физическими методами исследования вещества.
6

РАЗДЕЛ ПЕРВЫЙ. Электрический дипольный момент, его природа и методы измерения
ГЛАВА 1. Теоретические основы метода
1.1.Природа дипольного момента
Вобщем случае под электрическим диполем понимают любую систему, состоящую из равных по величине и противоположных по знаку электрических зарядов qi, расположенных на расстоянии li:
µ = qi li, |
(1.1) |
Радиус - вектор li, направлен от центра тяжести отрицательного электронного заряда к центру тяжести положительного ядерного заряда (рис.1.1). Из выражения (1.1) следует, что дипольный момент является величиной векторной. Различный характер распределения электронной плотности в молекулах делит их на два основных класса - полярные и неполярные. Полярные молеку-
|
|
|
|
лы обладают дипольным |
|||
|
|
µ |
|
моментом, неполярные - |
|||
A |
|
|
B |
нет. Понятие полярности |
|||
|
|
||||||
|
OQ+ |
CQ- |
(или |
неполярности) |
мо- |
||
Рис. 1.1. Центры тяжести положительного (OQ+) и отрицательного |
жет |
быть отнесено |
и к |
||||
каждой из химических |
|||||||
(CQ-) зарядов и направление дипольного момента в двухатомной |
|||||||
молекуле. |
|
|
связей, образующих мо- |
||||
|
|
|
|
лекулу. |
|
||
Т а б л и ц а 1.1
Зависимость полярности молекулы АВX
от геометрического расположения атомов для общего случая полярной связи А-В
Тип молекулы |
Геометрия |
Наличие дипольно- |
Примеры |
|
го момента |
||||
|
|
|
||
АВ2 |
линейная |
нет |
СО2, СS2 |
|
АВ2 |
угловая |
есть |
H2O, SO2 |
|
АВ3 |
плоская |
нет |
BF3, SO3 |
|
АВ3 |
пирамидальная |
есть |
NH3, PF3 |
Если в молекуле несколько полярных связей, при определении дипольного момента молекулы дипольные моменты этих связей суммируются по закону суммирования векторов, поэтому величина дипольного
7

момента молекулы определяется не только величиной связевых дипольных моментов, но и их расположением в пространстве относительно друг друга. То есть, в сходных молекулах величина дипольного момента характеризует геометрию молекул (таблица 1.1).
Причинами возникновения дипольного момента молекул являются: 1) Смещение центра тяжести зарядов электронов, образующих хими-
ческую связь в сторону более электроотрицательных атомов связи. В симметричных двухатомных молекулах в отсутствии внешнего электри-
|
ческого |
поля |
электронное |
облако |
|
симметрично относительно ядер. Сле- |
|||
|
довательно, центр тяжести положитель- |
|||
|
ных зарядов ядер и отрицательных |
|||
Рис. 1.2. Схема возникновения |
зарядов связывающих электронов каждого |
|||
гомополярного диполя в моле- |
из атомов связи совпадают и дипольный |
|||
куле НCl |
момент равен нулю. |
|
||
|
|
|||
|
2) Появление |
гомополярного |
диполя. |
|
По причине различий в размерах атомных орбиталей, образующих химическую связь, область перекрывания орбиталей, т.е. область более вероятного нахождения связывающих электронов (отрицательного заряда), оказывается смещенной относительно центра положительных зарядов ядер атомов, образующих химическую связь. Эта ситуация приводит к возникновению гомополярного диполя химической связи (рис. 1.2).
3) Ассиметрия несвязывающей электронной пары. Возникновение диполя из-за наличия в молекуле неподе-
|
ленной пары электронов удобно рас- |
||||
|
смотреть на примере молекул NH3(а) и |
||||
|
NF3(в) |
(рис.1.3). Сравнение электроот- |
|||
|
рицательностей атомов Н (2.1), N (3.0) и |
||||
Рис. 1.3. Сложение векторов свя- |
F (4.0) показывает, что несмотря на бли- |
||||
зевых дипольных моментов с ди- |
|||||
зость дипольных моментов связей N-H и |
|||||
польным моментом неподеленной |
|||||
N-F, дипольные |
моменты |
связей N-H |
|||
пары |
|||||
|
аммиака |
дают |
суммарный |
дипольный |
|
момент, направление которого совпадает с направлением дипольного момента неподеленной пары электронов азота. В случае молекулы NF3 суммарный связевый момент направлен против дипольного момента неподеленной пары азота. В результате дипольный момент аммиака больше дипольного момента NF3.
Все изложенное выше касается дипольного момента молекулы вне электрического поля.
8
1.2. Диполь в статическом электрическом поле. Поляризуемость молекулы
Во внешнем электрическом поле заряды, образующие молекулу (электроны больше, ядра меньше), испытывают смещение в разных направлениях. В результате этого в постоянном электрическом поле центры тяжести положительных и отрицательных зарядов даже в неполярных молекулах перестают совпадать и молекула приобретает дипольный момент под действием поля называемый наведенным или индуцированным дипольным моментом.
Свойство молекулы приобретать дипольный момент под действием электрического поля называется поляризуемостью. Величина индуцированного дипольного момента молекулы зависит от величины напряженности электрического поля и от свойств самой молекулы
µ ≈ ε0αЕ, (1.2) где ε0- диэлектрическая проницаемость вакуума, α - поляризуемость мо-
лекулы, Е - напряженность внешнего электрического поля.
В зависимости от типа смещения заряда поляризуемость можно разделить на следующие составляющие.
1). Электронная поляризуемость - αэл. Возникает при упругом смещении электронных орбит относительно ядер в молекуле. Данный тип поляризуемости является безинерционным: αэл исчезает со снятием напряженности внешнего электрического поля.
2). Ядерная поляризуемость - αяд.. Возникает при смещении ядер в молекуле относительно друг друга. Ядерная поляризуемость также практически безинерционна, но по величине много меньше электронной:
αяд.<< αэл.
Вместе эта два типа поляризуемости называют деформационной поляризуемостью:
αдеф.= αяд.+ αэл.
Оба типа поляризуемости присутствуют в полярных и неполярных молекулах, для неполярных молекул полная поляризуемость равна деформационной.
Во внешнем электрическом поле в полярных молекулах, т.е молекулах имеющих собственный дипольный момент, помимо деформационной поляризуемости возникает ориентационный дипольный момент благодаря стремлению собственного дипольного момента молекулы ориентироваться по направлению внешнего электрического поля и, соответственно, ориентационная поляризуемость αор.. Таким образом, полная поляризуемость полярных молекул равна:
9
α = αдеф.+ αор.= αяд.+ αэл.+ αор..
Поскольку тепловое движение разрушает ориентацию собственных дипольных моментов молекул в постоянном электрическом поле, ориентационная поляризуемость обладает инерцией, т.е. αор., как и полная поляризуемость полярных молекул, при снятии напряженности внешнего электрического поля снижается с некоторой задержкой.
1.3. Диэлектрик в постоянном электрическом поле. Поляризация диэлектрика
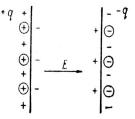
Вещества, состоящие из полярных и неполярных молекул, в основном являются диэлектриками. Если диэлектрик поместить в электрическое поле конденсатора, произойдет поляризация диэлектрика, которая изменит напряженность электрического поля конденсатора. В плоском конденсаторе с площадью пластин А, расстоянием между ними d и плотностью заряда на пластине конденсатора σ напряженность электрического поля равна Е.
На поверхности диэлектрика, находящегося в электрическом поле конденсатора, возникают наведенные заряды плотности Р, дипольный момент созданный ими равен: µ = Р×А×d, а средний дипольный момент единицы объема диэлектрика, заполняющего все пространство конденса-
тора, равен:
µср = µ/V=(Р×А×d)/V=P, здесь V- объем диэлектрика в конденсаторе.
Из полученного выражения можно заключить, что поляризация диэлектрика есть средний дипольный момент единицы объема диэлектрика.
Заметим, что напряженность электрического поля, созданного наведенными зарядами поверхности конденсатора, направлена против напряженности поля самого конден-
сатора и уменьшает его (рис. 1.4).
Поскольку поляризация диэлектрика - результат сложения собственных и наведенных дипольных моментов его молекул, можно говорить о деформационной и ориентационной составляющих поляризации всего диэлектрика, если отнести величину наведенного дипольного момента к единице объема:
10
