
практические работы по кинетике
.pdfФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ТОМСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Практикум по кинетике гомогенных
каталитических реакций
Под редакцией О.В. Водянкиной
Томск
2009
УДК 544.431-3; 544.422 ББК 24.542; 44 П 691
Практикум по кинетике гомогенных каталитических реакций / Под ред. О.В. Водянкиной. – Томск: Томский государственный ун-т, 2009. – 89 с.
ISBN
Практикум предназначен для студентов химического факультета, обучающихся по специальностям «Химия» и «Охрана окружающей среды и рациональное использование природных ресурсов». В практикуме рассмотрены некоторые теоретические аспекты кинетики гомогенных химических реакций, особенностей протекания каталитических реакций, подробно изложена методика экспериментального исследования кинетических закономерностей гомогенных каталитических реакций. В приложениях приведено описание и практические способы работы на Спектрофотометре UNICO 2800 и Сахариметре СУ-5.
Табл. 16, иллюстр. 21, библиогр. 10 источников
Практикум подготовлен коллективом кафедры физической и коллоидной химии Томского государственного университета в рамках Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России».
Рецензенты:
Профессор кафедры общей и неорганической химии Томского политехнического университета, д.х.н. Г.Г. Савельев Доцент кафедры химии Томского архитектурно-строительного университета, к.х.н. И.А. Курзина
Авторы и составители: В.Н. Белоусова, Н.Н. Судакова, Л.П. Шиляева, О.В. Водянкина, А.А. Епифанова
Разработчики электронной версии: О.В. Водянкина, А.А. Епифанова
Редактор: О.В. Водянкина
ISBN
ВВЕДЕНИЕ
Одной из основных задач физической химии является изучение закономерностей протекания химических процессов во времени, т.е. изучение кинетики химических реакций.
Известно [1, 2], что реакционная способность химической системы при заданных условиях характеризуется скоростью и возможной глубиной химического превращения. Направление реакции определяется законами химической термодинамики. Условие самопроизвольного протекания реакции G < 0 при постоянном давлении (Р) и постоянной температуре (Т) является термодинамическим критерием реакционной способности. Это условие обязательное, но недостаточное. Так, смесь О2 и Н2 при стандартных условиях практически не взаимодействует, хотя сродство компонентов велико.
Например, для реакции окисления водорода:
О2 + 2 Н2 = 2 Н2О, G = –228,6 кДж/моль.
Таким образом, необходим кинетический критерий реакционной способности. Наиболее общим кинетическим критерием реакционной способности хи-
мическое системы является скорость реакции, поэтому знание экспериментальных методов определения и расчета скоростей реакций, а также выяснение возможностей теоретического расчета кинетических параметров процесса очень важно.
Значение кинетического метода исследования химических реакций возрастает в связи с возможностью применения электронно-вычислительной техники и методов моделирования.
Цель данного пособия – помочь студентам освоить кинетические метода изучения химических реакций и закрепить основные теоретические положения кинетики и катализа.
В результате выполнения предлагаемых в данном пособии работ студент должен знать:
1)методы проведения кинетического эксперимента. Способы определения изменения концентрации реагирующих веществ в ходе реакции (аналитический, волюмометрический, фотоколориметрический и др.).
2)математические способы обработки полученных кинетических кривых для определения порядка реакции (по данному компоненту и общего) и константы скорости реакции.
3)методы определения энергии активации.
4)влияние концентрации катализатора и ионной силы раствора на скорость гомогенных каталитических реакций.
3

1.ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
1.1.Скорость реакции
Скорость химической реакции определяется количеством вещества, реагирующего в единицу времени в единице реакционного пространства. Она может быть рассчитана по изменению количества вещества любого участника реакции, как исходного вещества, так и продукта реакций. В общем случае скорость реакции меняется с течением времени, и поэтому лучше ее определять как производную от количества вещества по времени.
1 dn |
|
W q dti , |
(1) |
где ni – количество вещества; t – время;
q – размер структурного элемента системы, в котором локализована реакция. Для гомогенной реакции таким структурным элёментом является объем
реакционной системы (V). Отсюда для гомогенной реакции:
1 dni |
|
|
W V dt |
, |
(2) |
где V – объем реакционной системы.
Для гетерогенной реакции структурным элементом является поверхность раздела реагирующих фаз:
1 dni |
|
|
W S dt |
, |
(3) |
S – поверхность раздела фаз.
Для гомогенных реакций, если объем реакционной системы не меняется:
W |
d (ni /V ) |
|
dci |
, |
(4) |
dt |
dt |
т.е. скорость определяется изменением концентраций реагента в единицу времени и имеет размерность, зависящую от способа выражения количества веще-
ства. Если оно выражается в молях, то скорость выразится в единицах [моль·л–1·с–1].
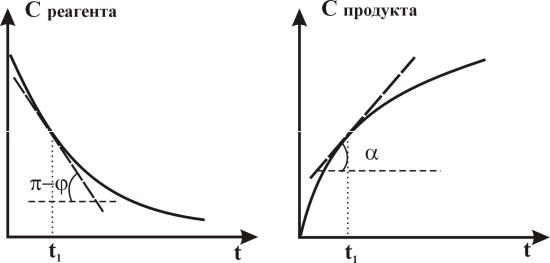
Графически скорость реакции выражается величиной углового коэффи-
циента касательной в точке кинетической кривой с = f(t), соответствующей выбранному моменту времени (рис. 1).
1.2. Кинетическое уравнение
Уравнение, описывающее зависимость скорости процесса от концентрации компонентов реагирующей системы, называется кинетическим уравнением процесса:
4
W f (c1,c2,c3,...,с n) . |
(5) |
W dc |
tg tg |
W dc |
tg |
dt |
|
dt |
|
Рис. 1. Кинетические кривые расходования реагента (а) и накопления продукта (б)
Для элементарной реакции (реакции, протекающей в одну стадию) такая зависимость подчиняется закону действующих масс; тогда для элементарной (простой) реакции:
1A1 + 2A2 продукты
кинетическое уравнение примет вид:
W kcAv1 cAv2 |
; |
|
|
1 |
2 |
|
|
(в общем случае: W k П cAvii ), |
(6) |
||
|
|
i |
|
где Сi – концентрация i-го реагента;
П – символ произведения;
i
k – константа скорости.
Согласно закону действующих масс (ЗДМ), скорость элементарной реакции равна произведению константы скорости реакции (k) на произведение концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам. Для сложной реакции:
1A1 + 2A2 3A3 + 4A4
кинетическое уравнение может иметь вид степенной зависимости:
W kcAn1 cAn2 |
, |
(7) |
|
1 |
2 |
|
|
или еще более сложный вид, где n1, n2 – числа, отличающиеся от стехиометрических коэффициентов. Это уравнение, записанное в общем виде, называется
постулатом химической кинетики.
W k П cAnii . |
(8) |
i |
|
5
Например, для реакции образования йодоводорода:
I2 + Н2 = 2 НI
кинетическое уравнение имеет вид:
WkcH2 cI2 ,
адля, казалось бы, похожей реакции образования бромоводорода:
Br2 + Н2 = 2 НBr
кинетическое уравнение существенно изменяется:
W |
|
|
kcH2 c1/I2 |
2 |
. |
1 |
|
|
|||
|
cHBr / K cBr |
||||
|
|
|
|
2 |
|
(9)
(10)
То есть, если скорость некоторой реакции подчиняется закону действующих масс, это, в общем случае, не означает, что реакция является элементарной.
Современное определение скорости химической реакции [3 ]: число элементарных актов или изменение количества вещества (исходных реагентов или продуктов превращения) в единицу времени в единице объема (V), рассчитанное на единицу его стехиометрического коэффициента ( i), дает не зависящее от природы компонента, используемое для нахождения скорости, общее выражение:
W |
|
1 |
(dni ) . |
|
i V |
||||
|
dt |
|||
Существуют сложные реакции, скорость которых формально описывается ЗДМ. С другой стороны, если скорость реакции не описывается ЗДМ, то это является прямым указанием на ее сложность.
Можно выделить следующие признаки сложных реакций:
1)несовпадение порядка реакции и стехиометрических коэффициентов;
2)возможное изменение состава продуктов в зависимости от температуры, начальных концентраций реагентов и других условий;
3)ускорение либо замедление процесса при добавлении в реакционную смесь небольших количеств веществ;
4)влияние материала и размеров реакционного сосуда на скорость реакции;
5)существенное влияние на скорость химического процесса незначительного изменения условий проведения эксперимента: реакция либо останавливается, либо протекает со взрывом.
6
1.3. Константа скорости реакции
Если кинетическое уравнение имеет вид: |
|
W kcAn1 cAn2 ... |
(W k П cAnii ) , |
1 2 |
i |
то коэффициент пропорциональности (k) называют константой скорости. Константа скорости служит количественной мерой реакционной способности данного вещества в данной реакции. Из уравнения (8) видно, что константа скорости равна скорости реакции при концентрациях реагентов равных 1. Размерность константы скорости зависит от порядка реакции (табл. 1).
|
Т а б л и ц а 1 |
|
|
|
|
Порядок реакции |
Размерность константы скорости |
|
|
|
|
0 |
[концентрация] [время] –1 |
|
1 |
[время] –1 |
|
2 |
[концентрация] –1 [время] –1 |
|
n |
[концентрация]n –1 [время] –1 |
|
Константа скорости не зависит от концентрации реагентов, входящих в кинетическое уравнение, а зависит, главным образом, от температуры.
Нередко скорость сложной реакции не подчиняется степенному уравнению (3), а выражается иной зависимостью, например:
W |
k1cA cA |
(11) |
||
1 k2cA . |
||||
|
1 |
2 |
|
|
|
|
2 |
|
|
Тогда k1 и k2 называют коэффициентами в уравнении для скорости реак-
ции.
1.4. Простые и сложные химические реакции
Химические реакции редко протекают в одну стадию, так как это записано в стехиометрическом уравнении реакции. В обычной одностадийной записи уравнений химических реакций указывается только начальное и конечное состояние системы, что по существу является выражением материального баланса (закона сохранения вещества). В действительности реакция обычно течет через ряд промежуточных стадий, при этом общая скорость реакции определяется скоростью наиболее медленной стадии.
Простой или элементарной реакцией называется реакция, осуществляющаяся путем прямого перехода исходных веществ в продукты через один энергетический барьер. Такая реакция протекает в одну стадию.
Элементарный акт химической реакции – превращение одной или нескольких находящихся в контакте частиц-реагентов в частицы-продукты. Он
7
происходит за короткий отрезок времени порядка 10–13 с. Простая химическая реакция состоит из однотипных элементарных актов, например:
OH – + CH3Br CH3OH + Br –.
Механизм простой реакции – способ взаимодействия и перераспределения атомов и связей в реагентах, превращающихся в продукты. Его описание дается в рамках той или иной теории элементарного акта.
Сложная реакция состоит из нескольких простых реакций (элементарных стадий), связанных друг с другом через реагенты или продукты. Часто продукт одной стадии служит реагентом для другой стадии и является промежуточным веществом. Если оно быстро подвергается дальнейшим превращениям, то является лабильным и присутствует системе в небольших количествах.
Совокупность элементарных стадий, из которых складывается реакция, называется механизмом или схемой химической реакции. Механизм сложной реакции представляет собой кинетическую схему, в которой доказана каждая элементарная стадия и её связь с другими стадиями совокупного процесса.
Так, реакция разложения оксида азота (V)
2 N2O5 2 N2O4 + O2
имеет следующий механизм:
1)N2O5 N2O3 + O2,
2)N2O3 NO + NO2,
3)NO + N2O5 3NO2,
4) 2NO2 N2O4.
При этом первая стадия протекает медленно и определяет скорость процесса в целом.
1.5. Порядок и молекулярность химической реакции
Порядок реакции по данному компоненту – показатель степени в кинетическом уравнении вида:
W kcAn11 cAn22 ,
где n1 и n2 – порядки реакции по компоненту 1 и 2.
Порядок реакций – величина формальная, может быть положительным, отрицательным, целым, дробным числом, а также равным нулю. Обычно, значение порядка реакции варьируется в пределах от 0.5 до 4. Общий порядок реакции равен сумме показателей степеней: n = n1 + n2 ...
Для элементарных стадий процесса или элементарных реакций (идущих в одну стадию) порядок реакция совпадает со стехиометрическими коэффициентами, показывающими: сколько молекул данного вещества одновременно участвует в элементарном акте реакции.
8
Молекулярность реакции характеризует общее число молекул реагирующих исходных веществ, участвующих одновременно в элементарном акте реакции, т.е. равна сумме целочисленных значений стехиометрических коэффициентов исходных веществ. Таким образом, понятие «молекулярность» реакции в отличие от порядка реакции обладает ясным физическим смыслом.
Однако, большинство химических реакций является совокупностью нескольких последовательных (а иногда и параллельных) элементарных стадий, т.е. имеет сложный механизм, поэтому молекулярность, в общем случае, и порядок не совпадают. Численные их значения могут совпадать лишь в элементарных актах химических превращений. Понятие «молекулярность» реакции не применимо к сложным реакциям.
Методы определения порядка реакции достаточно полно описаны в [4, 5].
1.6. Элементы кинетики сложных реакций. Метод Боденштейна
Сложными называются реакции, включающие несколько элементарных стадий, которые связаны между собой через исходные вещества и промежуточные соединения [6].
Изучение кинетики сложных реакций проводят с использованием:
–главного (основного) постулата химической кинетики;
–принципа независимости: если в реагирующей системе протекают не-
сколько элементарных стадий, то каждая из них протекает независимо других, подчиняясь основному постулату химической кинетики (принцип независимости имеет ограничения, в частности, он неприменим к кинетике сопряженных химических реакций);
– принципа лимитирующей стадии: если химическая реакция состоит из нескольких стадий, то стадия, скорость которой наименьшая, определяет скорость всей реакции в целом (лимитирующая стадия).
Сложные реакции можно разделить на несколько основных типов:
1)обратимые реакции: реакции, в которых превращения реагентов в продукты сопровождается превращением продуктов в исходные вещества
A B;
2)параллельные реакции: реакции, в которых исходные вещества превращаются в продукты реакции одновременно по нескольким направлениям
 ;
;
3)последовательные реакции – это реакции, которые протекают в 2 и более стадий таким образом, что продукт, образующийся в первой стадии, выступает в качестве реагента во второй стадии и т.д.
A B C D … K;
9
4)последовательно-параллельные реакции; это реакции, часть стадий которых реализуется параллельно, а часть – по последовательному маршруту
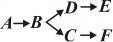 ;
;
5)сопряженные реакции – это параллельные реакции, одна из которых сама по себе не происходит, а протекает под влиянием второй реакции.
Например, бензол в водном растворе не окисляется перекисью водорода. Однако, в присутствии солей Fe2+ окисление бензола в фенол протекает быстро: Первая стадия: 2 Fe2+ + H2O2 2 Fe3+ + 2OH- (индуцирующая реакция), Вторая стадия: C6H6 + H2O2 C6H5OH + H2 (индуцируемая реакция).
Кинетика сложных реакций, исключая сопряженные, может быть описана с позиций формальной кинетики. Кинетика обратимых и параллельных реакций достаточно подробно описана в современной литературе [7]. Остановимся на кинетических закономерностях последовательных реакций.
Рассмотрим простую 2-х стадийную последовательную реакцию:
A B C,
каждая из стадий которой протекает со своей константой скорости k1 и k2, соответственно.
Вид графической зависимости концентрации от времени для такой реакции определяется соотношением констант скоростей 2-х реализующихся стадий (рис. 2а). Чем выше скорость расходования промежуточного вещества В (константа скорости k2), тем ниже максимальная концентрация Вмах и меньше время ее достижения (tмах) (рис. 2б) [8].
В точке достижения максимальной концентрации Вмах и в течение всего отрезка времени, пока максимальная концентрация промежуточного вещества остается постоянной [B]=const, скорость изменения концентрации промежуточного вещества В равна нулю:
d[B] 0 . dt
Исходя из принципов химической кинетики скорость изменения промежуточного вещества В во времени может быть записана следующим образом:
d[B] k1[A] k2[B] 0 . dt
Последнее выражение является математическим представлением метода квазистационарных концентраций Боденштейна.
Границы применимости метода Боденштейна для описания кинетики последовательных реакций:
1)одна из констант скорости должная быть намного меньше всех других, причем, чем больше это различие, тем точнее приближение;
2)время реакции не должно быть слишком малым;
3)промежуточное соединение должно обладать высокой реакционной способностью, тогда k1 << k2.
10
