
практические работы по кинетике
.pdfОбработка результатов эксперимента
1. Результаты работы представить в виде табл. 2. Построить график зависимости в координатах vt f (t) для нахождения v0 .
2.Рассчитать значения констант скоростей йодирования ацетона по уравнению (41).
3.Для иллюстрации первичного солевого эффекта полученные результа-
ты представить в виде графической зависимости k f (СCH3COONa ) .
4.Экспериментальные результаты в виде таблиц и графиков представить
ввиде распечаток, на графические зависимости нанести аппроксимационные уравнения и коэффициент корреляции (для линейных зависимостей).
Задание IV
Цель работы: изучение влияния концентрации йода на скорость йодирования ацетона.
Провести пять-шесть опытов с различной начальной концентрацией йода. Различная концентрация йода создается введением в колбу различных объемов 0,1 н раствора I2 в интервале 10–50 мл (по указанию преподавателя). При этом концентрация йода в колбах емкостью 250 мл изменяется от 0,004 до 0,2 н. При выполнении данного задания следует использовать 0,1 н раствор I2 в 0,2 н KNO3 для исключения влияния KI, вводимого вместе I2. В качестве катализатора использовать 1 М НСl.
Обработка результатов эксперимента
1. Результаты работы представить в виде табл. 2. Построить график зависимости в координатах vt f (t) для нахождения v0 .
2. Рассчитать значения констант скоростей йодирования ацетона по уравнению (41). Убедиться, что реакция йодирования ацетона имеет нулевой порядок по йоду.
Задание V
Цель работы: изучение влияния начальной концентрации ацетона на скорость его йодирования.
Провести пять–шесть опытов с различной начальной концентрацией ацетона. Различная концентрация ацетона создается введением в колбу различных объемов ацетона (от 2 до 10 мл). Начальную концентрацию ацетона рассчитать по уравнению (50). В качестве катализатора использовать 1,0 М соляную кислоту.
41
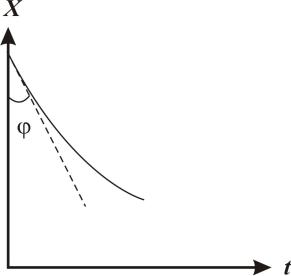
Обработка результатов эксперимента
1. Результаты работы представить в виде табл. 2. Построить график зависимости в координатах vt f (t) для нахождения v0 .
2. Построить кинетические кривые в координатах ln C2 f (t ) . Из началь-
C1
ных участков кинетических кривых определить начальные скорости йодирования ацетона W0.
3. Рассчитать значения констант скоростей йодирования ацетона по уравнению (41).
tg ( xt )x 0 W0
Рис. 15. Определение начальной скорости реакции йодирования ацетона по углу наклона касательной
Результаты представить в виде табл. 3.
Т а б л и ц а 3
C10 , моль/л |
k, мин–1 ·моль–1∙л |
W0, ln ka f (ln Ka ) |
моль |
|
|
|
л мин |
|
|
|
|
|
|
|
Объяснить полученные результаты.
Задание VI
Цель работы: изучение влияния концентрации катализатора–кислоты на скорость йодирования ацетона
Провести пять-шесть опытов с различной концентрацией соляной кислоты. Различная концентрация кислоты (от 0,05 до 0,2 н) создается введением в
реакционную колбу различного объема 1 М раствора НС1. Все остальные условия (температура, количество ацетона и йода) остаются постоянными.
42
|
|
|
Т а б л и ц а 4 |
|
|
|
|
№ колбы |
|
Cодержимое колбы |
|
Количество I2 |
Количество катализа- |
Количество ацетона, |
|
|
(0,1 М), мл |
тора (1,0 М HCl), мл |
мл |
1 |
25 |
10 |
2 |
2 |
25 |
20 |
2 |
3 |
25 |
30 |
2 |
4 |
25 |
40 |
2 |
5 |
25 |
50 |
2 |
Концентрацию кислоты рассчитать по уравнению (43).
Обработка результатов эксперимента
1. Результаты работы представить в виде табл. 2. Построить график зависимости в координатах vt f (t) для нахождения. v 0
2. Построить кинетические кривые в координатах ln C2 f (t) .
C1
3. Значения констант скоростей йодирования ацетона в присутствии различных концентраций кислоты представить в виде табл. 5 и графической зави-
симости в координатах k f (Cкатализатор ).
Т а б л и ц а 5
Концентрация кислоты, моль/л |
k, мин–1·моль–1·л |
|
|
Объяснить полученные результаты.
Задание VII
Цель работы: изучение влияния природы катализатора – кислоты на скорость йодирования ацетона
Провести три опыта, используя в качестве катализаторов – 1,0 М растворы уксусной, монохлоруксусной и дихлоруксусной кислот. Сила кислот (константа протолитического взаимодействия, Ка) приведена в таблице. Все остальные условия (объем кислоты 25 мл, йода 25 мл 0,1 н раствора и ацетона 2 мл, температура 50°С) остаются постоянными.
43
Т а б л и ц а 6
Кислота |
Ка |
СН3СООН |
1,75∙10–5 |
СН2ClCOOH |
1,41∙10–3 |
CHCl2COOH |
5,7∙10–2 |
Обработка результатов эксперимента
1. Результаты работы представить в виде табл. 2. Построить график зависимости в координатах vt f (t) для нахождения v0 .
2.Рассчитать значения констант скоростей йодирования ацетона по уравнению (41).
3.Для проверки правила Бренстеда (уравнение (15)) построить график в
координатах ln ka f (ln Ka ) . Определить постоянные уравнения (15).
Задание VIII
Цель работы: исследование кинетики йодирования ацетона в нейтральной среде (определение констант скорости некаталитической и автокаталитической стадий процесса, установление начальной концентрации ионов водорода, при которой начинается автокаталитический процесс, расчет энергии активации некаталитической и автокаталитической стадий) с помощью колориметрического метода контроля.
В предлагаемой задаче изучение кинетики реакции йодирования ацетона проводится с использованием УФ-ВИД спектрофотометра UNICO UV-2800.
В ходе эксперимента измерения убыли концентрации йода (равной концентрациям образующихся йодацетона и ионов водорода и убыли концентрации ацетона) контролируется по разности оптических плотностей d, измеренных фотоколориметрическим методом в кварцевых (полистирольных) кюветах толщиной 1 см по полосе поглощения йода 490,6 нм (раствором сравнения является дистиллированная вода) в начальный момент времени (d0) и в момент
времени ti (di).
Пересчет полученных экспериментальных значений оптической плотности в концентрацию проводится следующим образом:
X [ |
d0 di |
] C0 (I2 )( |
/ ) . |
(44) |
|
||||
|
d0 |
|
|
|
Используемая во всех задачах начальная концентрация йода обеспечивает выполнение закона светопоглощения Бугера–Ламберта–Бера во всем интервале концентраций рабочих растворов (рис. 16).
Значения X входят в уравнения (35–40), по которым проводится обработка экспериментальных данных.
44
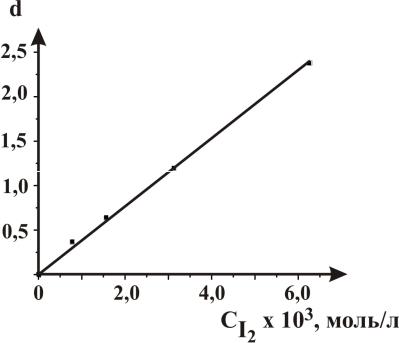
Точность определяемых констант скоростей реакции йодирования ацетона зависит от точности приготовления растворов, точности измерения оптических плотностей реакционной смеси и соответствия температуры реакционной смеси температуре термостата. Поэтому следует строго соблюдать все рекомендации по проведению экспериментов. Особенно следует помнить, что приготовление рабочего раствора и отбор проб для измерения оптической плотности необходимо проводить быстро и около термостата.
Рис. 16. Калибровочная зависимость оптической плотности йода от концентрации раствора йода
Исходные растворы йода готовятся в кварцевых колбах на 250 мл (без ацетона). Использование кварцевых колб связано с выщелачиванием обычного стекла, что ведет к искажению результатов, особенно при низких концентрациях протонов. В колбе на 100 мл готовят раствор ацетона. Колбы на 100 мл используются для того, чтобы при приготовлении рабочего раствора за счет добавления в реакционную смесь ацетона температура рабочего раствора соответствовала температуре термостата.
Методика проведения эксперимента
В колбах на 250 и 50 мл готовят исходные растворы в соответствии с данными, приведенными в табл. 7. В каждую из шести колб емкостью 250 мл влить 0,1 М раствор I2 (в зависимости от выполняемого задания), после чего в каждую колбу долить дистиллированной воды приблизительно до 100 мл (т.е. ниже метки мерной колбы). После этого колбы поместить в термостат, через 10–15 мин, после того, как раствор в термостате примет температуру опыта, в колбу быстро влить 50 мл раствора ацетона (ацетон приготовить в колбе на 50 мл), отмечая время приливания ацетона как время начала реакции. Далее дистиллированной водой, предварительно термостатированной при температуре опыта, долить до метки. Колба тщательно закрывается заранее подготовленной
45
и подогнанной пробкой, встряхивается (быстро!) несколько раз и необходимое для измерения начальной оптической плотности (d0) количество рабочего раствора отбирается в стакан с широким горлом, предварительно охлажденный в снежной бане. Из стакана пробу переносят в кварцевую кювету толщиной 1 см, закрывают крышечкой, при помощи фильтровальной бумаги или специальной салфетки удаляют капли со стенок кюветы, помещают в кюветное отделение спектрофотометра (порядок работы на спектрофотометре приведен в ПРИЛОЖЕНИИ 1) и находят значение оптической плотности d.
После этого колба с рабочим раствором помещается в термостат. Поскольку начальная стадия реакции идет достаточно медленно, то такой способ определения (d0) вполне приемлем. Дальнейший отбор проб производится в зависимости от температуры эксперимента, но не менее чем через 15 минут.
Результаты всех измерений для каждой температуры заносятся в табл. 8 и 9, соответственно.
Во время отбора пробы колбу из термостата не вынимать.
Т а б л и ц а 7
Составы исходных растворов для реакции йодирования ацетона в нейтральной среде
|
|
|
|
Объем |
|
|
|
|
Объем |
Объем |
Объем |
0,1 М |
Общий |
С0 |
|
Температура, |
дистил. |
раствора |
С0 |
||||
оС |
колб, |
воды, |
ацетона, |
йода в 4% |
объем, |
ацетона, |
йода, М |
|
мл |
мл |
мл |
растворе |
мл |
М |
|
|
|
|
|
|
|
||
|
|
|
|
КI, мл |
|
|
|
35 |
250 |
100 |
– |
5 |
250 |
|
|
50 |
25 |
25 |
|
|
|
||
|
|
|
|
|
|||
40 |
250 |
100 |
– |
5 |
250 |
|
|
50 |
25 |
25 |
|
|
|
||
|
|
|
|
|
|||
45 |
250 |
100 |
– |
5 |
250 |
|
|
50 |
25 |
25 |
|
|
|
||
|
|
|
|
|
Начальные концентрации ацетона и йода при всех температурах, рассчитанные самостоятельно для рабочего раствора, заносятся в табл. 7.
|
|
|
|
Т а б л и ц а 8 |
|
Измеренные и рассчитанные значения экспериментальных величин |
|||
|
|
|
|
|
№ |
Время экспозиции, |
Оптическая плот- |
d0-di |
[(d0-di)/d0)]С0(I2), |
|
мин |
ность, |
|
моль/л |
|
|
d0 |
|
|
|
|
|
|
|
После окончания измерений значений заполняют колонку 5 и проводят обработку экспериментального материала по формулам (38) и (40).
46
Обработка результатов экспериментов
При обработке экспериментальных данных этой задачи следует учитывать два обстоятельства.
Во-первых, как уже отмечалось выше, исходный ацетон содержит небольшое количество енольной формы, которая быстро взаимодействует с йодом, и таким образом уже в начальные моменты времени в реакционной смеси присутствует некоторое количество йодацетона (X), что, вообще говоря, необходимо учитывать при расчетах константы скорости некаталитической реакции.
Во-вторых, в автокаталитической области реакции фактически идут два параллельных процесса – некаталитический и каталитический. Однако, поскольку константа скорости некаталитической реакции на 2-3 порядка меньше константы скорости каталитической реакции, то первый процесс в этой области можно практически не учитывать при обработке экспериментальных данных.
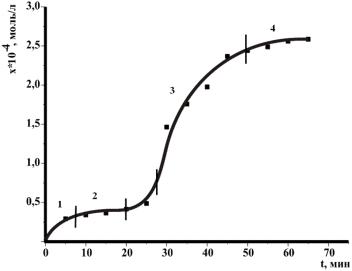
Поэтому обработку экспериментальных данных следует начать с построения графика в координатах (рис. 17). Кинетическую кривую можно примерно разбить на следующие участки:
1 – быстрое йодирование начального количества енола
2 – медленная реакция йодирования образующегося енола
3 – ускорение реакции за счет автокатализа 4 – прекращение реакции йодирования за счет полного расходования йо-
да.
Последний участок этой кривой в проводимых экспериментах не всегда имеет четко выраженную кривую замедления
Значения X на участке 2 используются для расчета константы скорости не каталитической реакции по формуле (38) (при этом наклон прямой не зависит от начальной концентрации йодацетона), а значения X; на участке 3 – для расчета константы скорости автокаталитической реакции и начальной концентрации [Н+]0 по формуле (40).
Рис. 17. Кинетическая кривая реакции йодирования ацетона в нейтральной среде
47
Представление результатов
Представление результатов включает:
1.Краткое описание содержания работы с указанием всех уравнений, необходимых для расчетов искомых величин.
2.Табл. 1 и все табл. 2.
3.Графики зависимости в координатах X = f(t) для всех температур с выбором участков некаталитической и автокаталитической стадий.
4.Графики для расчета констант скоростей реакции по уравнениям (51a)
и(51в) с результатами обработки на ПК.
5.Рассчитанные значения [Н+]0.
6.Графики для расчета энергии активации некаталитической и автокаталитической стадий по уравнению (12б) с обработкой на ПК.
Задание IX
Цель работы: изучение кинетических закономерностей реакции йодирования ацетона в кислой среде (нахождение констант скоростей и энергии активации каталитического процесса).
В предлагаемой задаче изучение кинетики реакции йодирования ацетона проводится с использованием УФ-ВИД спектрофотометра UNICO UV-2800.
Методика проведения эксперимента
В колбах на 250 мл 50 мл готовят растворы, согласно данным табл. 9. Во второй колбе на 250 мл готовиться раствор для определения d0 (без содержания ацетона!).
Т а б л и ц а 9
Состав исходных растворов для реакции йодирования ацетона в кислой среде
|
Объем |
Объем |
Объем |
|
|
|
|
|
|
0,1 М р-ра |
Объем |
С0 |
С0 |
С0 |
|||
Темпера- |
1М р-ра |
дистилл. |
||||||
тура, °С |
НС1, |
йода в 4% |
воды, |
ацетона, |
НС1, |
I2, |
ацетона, |
|
растворе КI, |
мл |
М |
М |
М |
||||
|
мл |
мл |
||||||
|
мл |
|
|
|
|
|||
|
|
|
|
|
|
|
||
комн. |
25 |
25 |
100 |
— |
|
|
|
|
|
|
48 |
2 |
|
|
|
||
|
|
|
|
|
|
|||
25 |
25 |
25 |
100 |
— |
|
|
|
|
|
|
48 |
2 |
|
|
|
||
|
|
|
|
|
|
|||
35 |
25 |
25 |
100 |
— |
|
|
|
|
|
|
48 |
2 |
|
|
|
||
|
|
|
|
|
|
48

Начальные концентрации соляной кислоты, йода и ацетона для каждой температуры рассчитываются студентами для рабочих растворов и заносятся в табл. 9.
После приготовления исходных растворов все колбы второго и третьего экспериментов помещаются в термостат. Через 10–15 минут, когда температуры растворов и термостата сравняются, сначала измеряют оптическую плотность раствора, не содержащей ацетона. Это значение оптической плотности принимается за d0. Так как в отсутствие ацетона реакция не идет, то этот раствор может быть использован для контрольных измерений d0. Затем содержимое колбы на 50 мл количественно переносится в колбу на 250 мл с одновременным включением секундомера. Это время принимается за t=0. Колба тщательно закрывается заранее подобранной по размеру пробкой, содержимое ее перемешивается встряхиванием и помещается обратно в термостат.
Отбор проб для фотоколориметрического анализа при комнатной температуре проводится через 5 минут, при температурах 25 и при 35°С время экспозиции сокращается до 2–3 минут. Все результаты измерений для каждой температуры заносятся в табл. 10.
|
|
|
|
Т а б л и ц а 10 |
|
Измеренные и рассчитанные значения экспериментальных величин |
|||
|
|
|
|
|
№ |
Время экспозиции |
Оптическая |
d0-di |
[(d0-di)/d0)]С0(I2), моль/л |
|
мин. |
плотность, |
|
|
|
|
d0 |
|
|
|
|
|
|
|
После окончания измерений заполняют колонку 5 и проводят обработку экспериментального материала по формуле (36):
ln ba xx ln ba (a b)kt .
Представление результатов
Представление результатов включает:
1.Краткое описание содержания задачи с указанием всех уравнений, необходимых для расчетов искомых величин.
2.Табл. 3 и все табл. 4.
3.Графики зависимости в координатах Х=f(t) всех исследуемых температур (по указанию преподавателя).
4.Графики для вычисления констант скоростей реакции по уравнению
(36)для всех температур с результатами обработки на ПК.
5.График для расчета энергии активации каталитической реакции по уравнению (12б) с результатами обработки на ПК.
49
Вопросы к работе
1.Дайте понятие скорости химической реакции по данному компоненту
2.Что такое кинетическое уравнение?
3.Каков физический смысл константы скорости реакции? Дайте понятие порядка реакции по данному компоненту, общего порядка реакции.
4.Какова размерность константы скорости второго порядка?
5.Почему реакция йодирования ацетона является реакцией второго порядка?
6.Каков механизм йодирования ацетона в кислой среде?
7.Запишите кинетическое уравнение реакции йодирования,
8.Зависит ли скорость йодирования от концентраций йода в реакционной смеси?
9.Запишите интегральную форму кинетического уравнения для константы скорости второго порядка
10.Какова размерность константы скорости второго порядка?
11.Как графически определить константу скорости йодирования? Как рассчитать начальные концентрации ацетона, катализатора? Для чего при титровании йода тиосульфатом натрия в колбочку для титрования вносится раствор гидрокарбоната калия?
12.В чем сущность вторичного солевого эффекта?
13.Как можно объяснить существование минимума на зависимости
k=f(Cсоли)?
14. В чем сущность первичного солевого эффекта? Почему при добавлении соли, не содержащей одноименного иона с катализатором, скорость йодирования должна увеличиваться? Дайте объяснения исходя из механизма йодирования.
15. Какой метод контроля над скоростью реакции йодирования Вы можете предложить еще?
50
