
практические работы по кинетике
.pdf
Построив графическую зависимость в координатах ln a x x f (t) при извест-
ной начальной концентрации реагента А можно найти константу скорости автокаталитической реакции по тангенсу угла наклона прямой.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1.Что понимают под термином «скорость химической реакции»? В каком случае скорость реакции может быть выражена изменением концентрации реагирующего вещества в единицу времени? Может ли скорость реакций быть отрицательной величиной? В каких единицах измеряется скорость химической реакции? От каких факторов зависит скорость химической реакции?
2.Дайте понятие кинетического уравнения. Какой вид имеет кинетическое уравнение для элементарной реакции, для сложной реакции? Могут ли входить
вкинетическое уравнение концентрации продуктов реакции и промежуточных веществ?
3.Что называется порядком реакции по данному веществу и общим (полным) порядком реакции? Может ли порядок реакции быть нулевым, дробным, отрицательным? Что подразумевается под термином «псевдопорядок» реакции? От каких факторов зависит порядок реакции? Может ли порядок измениться в ходе реакции?
4.Поясните термин «молекулярность» реакции. Какие значения может принимать молекулярность реакции? Может ли молекулярность быть дробной величиной? Для каких реакций порядок и молекулярность всегда совпадают?
5.Каков физический смысл константа скорости реакции? Имеет ли размерность и если имеет, то какую константа скорости реакции? Можно ли сравнивать константы скорости разных порядков? От каких факторов зависит величина константы скорости реакции? Нарисуйте ход зависимости константы скорости реакций от концентрации исходных веществ?
6.Что понимают под механизмом химической реакции? Дайте понятие элементарной стадии. Нарисуйте энергетический профиль одностадийной и двухстадийной реакции.
7.Дайте определение сложной реакции. Какие типы сложных реакций Вы
знаете?
8.Перечислите признаки сложных реакций?
9.В чем сущность метода стационарных концентраций? Напишите математическое выражение, отражающее суть метода Боденштейна?
10.Как влияет температура на скорость химической реакции? Для всех ли реакций скорость увеличивается с ростом температуры? Напишите уравнение зависимости константы скорости реакции от температуры в дифференциальной и интегральной форме. Какая форма уравнения Аррениуса (дифференциальная или интегральная) носит более общий характер и почему? Какой вид имеет зависимость логарифма константы скорости от обратной температуры?
31
11. Каков физический смысл энергии активации? Каким образом происходит активация молекул? Назовите способы расчета энергии активации. Какая из приведенных ниже реакций имеет наименьшую энергию активации:
CO + Cl2 COCl2
Na + CH3Cl NaCl + CH3
Cl + Cl + Cl2 Cl2 + Cl2
12.Дайте определение понятия «катализ». В чем заключается основная причина увеличения скорости в присутствии катализатора? Какая существует классификация каталитических процессов? Что называется скоростью гетерогенной каталитической реакции?
13.Как зависит скорость гомогенной реакции от ионной силы раствора? В каких случаях проявляется первичный солевой эффект? Когда имеет место вторичный солевой эффект?
14.Напишите уравнение, связывающее термодинамические и кинетические параметры химической реакции.
32
3. ПРАКТИЧЕСКИЕ РАБОТЫ ПО КИНЕТИКЕ КИСЛОТНО-ОСНОВНЫХ КАТАЛИТИЧЕСКИХ РЕАКЦИЙ
3.1. Исследование кинетики реакции йодирования ацетона
Реакция йодирования ацетона:
CH3COCH3 + I2 CH3COCH2I + H+ + I–
идет с заметной скоростью и в кислотной и в щелочной среде. Механизм реакции в той и другой среде различен.
3.1.1.Йодирование ацетона в нейтральной среде
Вотсутствие катализатора йодирование ацетона протекает по следующей схеме [10]:
1)Первая стадия превращения кетона в енол:
 .
.
2) Вторая стадия присоединения йода с образованием промежуточного соединения:
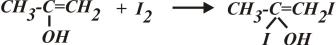 .
.
3) Третья стадия разложения промежуточного соединения на продукты реакции:
 .
.
Механизм галогенирования подтвержден экспериментально на основании того, что:
1)константы скорости галогенирования карбонильных соединений хлором, бромом и йодом, обычно различающиеся по реакционной способности, одинаковы;
2)такую же константу скорости имеют и процессы, скорость которых определяется первой стадией, например, рацемизация и дейтерообмен [10].
В этом случае скорость всего процесса определяется скоростью первой стадии (т.е. суммарная скорость процесса не зависит от концентрации йода).
Ацетон всегда содержит некоторое количество енольной формы (примерно 10–4 массовых частей [10]) и поэтому первая стадия формально должна рассматриваться как обратимая реакция первого порядка. Но, поскольку кетоенольное равновесие сильно смещено в сторону исходной кетонной формы, то можно принять, что реакция описывается кинетикой необратимой реакции первого порядка, т.е.:
W k (C1o Х ) , |
(37) |
33

и, соответственно, константа скорости реакции может быть определена выражением:
1 |
Co |
(37а) |
|
k t ln |
Co Х . |
||
|
1 |
|
|
|
1 |
|
|
Последнее выражение можно представить также в виде:
X Co (1 e kt ) |
, |
(37б) |
1 |
где C1o – начальная концентрация ацетона, Х – концентрация образовавшегося йодацетона, равная также убыли концентраций йода и ацетона, моль/л;
k – константа скорости реакции, мин–1; t – время, мин.
Некаталитическая стадия йодирования ацетона протекает достаточно медленно. При комнатной температуре и небольших количествах ацетона (менее 0,15 моль/л) образование йодацетона, фиксируемое по убыли йода, не наблюдается в течение нескольких часов. С увеличением концентрации ацетона и повышением температуры скорость реакции начинает увеличиваться.
Поскольку константа скорости некаталитического процесса мала, то разложение экспоненты в ряд при малых значениях времени позволяет применить для обработки экспериментальных данных уравнение:
X C1o k t . |
(38) |
По мере накопления ионов водорода, являющихся катализатором данной реакции, процесс переходит в автокаталитический режим, меняется механизм процесса, а скорость заметно возрастает. Скорость реакции в этом случае описывается уравнением скорости 2-го порядка. Специфика использования этого уравнения в данном случае заключается в том (см. ссылку [3]), что по мере протекания некаталитического йодирования возникает некоторая начальная концентрация водородных ионов:
С20 Х 0 , X 0 [H ]0 , |
|
|
приводящая к началу каталитического процесса. При этом C1o |
0 и C1o |
, |
через некоторое время Х становится заметно больше Х0, и тогда в достаточно |
||||||||
удовлетворительном приближении можно записать |
|
|||||||
k |
1 |
ln |
X |
|
. |
|
(39) |
|
C0t |
|
|
|
|||||
|
|
X |
0 |
|
|
|
||
1 |
|
|
|
|
|
|||
Данное выражение можно представить в виде: |
|
|
||||||
ln X ln X0 |
|
k C10 |
t. |
(40) |
||||
Таким образом, измерение текущей концентрации йода в некаталитической реакции позволяет определить в начальный период протекания реакции константу скорости некаталитической стадии, используя график в координатах
ln X f (t) , а затем константу скорости автокаталитической стадии, пользу-
ясь графической зависимостью по уравнению (36б), и начальную концентрацию ионов [Н+]0, приводящую к протеканию автокаталитической стадии.
34
Следует отметить, что обе реакции (некаталитическая и каталитическая) протекают по разным механизмам, но при этом имеют одинаковые исходные вещества (ацетон и йод) и одинаковые продукты реакции (йодацетон и йодистоводородную кислоту). Поэтому экспериментальное определение констант скоростей дает возможность сравнить энергии активации, определяемые по уравнению Аррениуса для двух механизмов одной и той же реакции.
3.1.2.Йодирование ацетона в кислой среде
Вкислой среде реакция йодирования ацетона протекает следующим об-
разом:
1) В водном растворе молекула ацетона становится протофильной. Происходит перенос протона от молекулы катализатора (в данном примере – слабой кислоты) к молекуле ацетона:
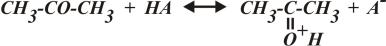 .
.
Водород метильной группы катиона кетоенола становится подвижным и соединяется с молекулой основания (в общем случае):
 .
.
Таким образом, первая стадия сводится к таутомерному превращению кетона в енол и протекает медленно.
2) Во второй стадии енол присоединяет йод:
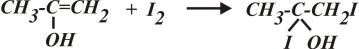 , образующееся промежуточное соединение немедленно разлагается с выделением протона и йодид-иона:
, образующееся промежуточное соединение немедленно разлагается с выделением протона и йодид-иона:
 .
.
Эта стадия протекает быстро. Поэтому скорость йодирования ацетона в кислой среде пропорциональна концентрации ацетона и катализатора (иона гидроксония). Поскольку по мере протекания реакции концентрация ионов гидроксония увеличивается, она является автокаталитической.
3) На последней стадии процесса протекает равновесная кислотноосновная реакция:
 , в которой реализуется регенерация молекулы катализатора.
, в которой реализуется регенерация молекулы катализатора.
Кинетическое уравнение имеет вид:
35
dCdt k C1 C2 ,
где С1 и С2 – текущие концентрации ацетона и ионов водорода. Йодирование ацетона является реакцией второго порядка.
Расчет константы скорости:
Константу скорости реакции йодирования ацетона можно рассчитать по уравнению
1 |
C0 |
1 |
ln |
C0 |
C |
|
, |
(41) |
|
k t |
C0 |
C0 |
C |
||||||
|
|
|
|
|
1 |
|
2 |
|
|
|
1 |
2 |
|
2 |
|
1 |
|
|
|
где C10 и C20 – начальные концентрации соответственно, ацетона и ионов водо-
рода, моль/л,
С1, С2 – текущие (в момент времени t) концентрации ацетона и ионов водорода, моль/л,
Начальная концентрация ацетона C10 рассчитывается следующим обра-
зом:
C10 |
Vацет dацет |
1000 моль/л, |
(42) |
|
|||
|
MrацетVколбы |
|
|
где Vацет – объем ацетона, мл;
dацет – плотность ацетона, г/мл молярная масса ацетона; Mrацет – молекулярная масса ацетона, г/моль;
Vколбы – объем мерной колбы, в которой идет йодирование ацетона, мл. Начальная концентрация катализатора рассчитывается по уравнению:
С20 |
Ск Vk моль/л, |
(43) |
|
Vколбы |
|
где Ск – молярность раствора кислоты, вносимой в колбу для йодирования, моль/л;
Vk – объем кислоты, вносимой в колбу для йодирования, мл.
После превращения X молей ацетона его концентрация в момент времени t рассчитывается:
С1 С10 X .
Т.к. в процессе йодирования ацетона концентрация ионов водорода увеличивается (реакция автокаталитическая), то:
С2 С20 X .
Количество прореагировавшего ацетона может быть определено по результатам йодометрического титрования следующим соотношением:
X (v0 vt ) N 10 1 ,
где v0 – объем 0,01 н раствора Na2S2O3, который должен был пойти на титрование 10 мл пробы в момент начала реакции,
36

vt – объем 0,01 н раствора Na2S2O3, пошедший на титрование текущей пробы, отобранной из реакционной колбы в момент времени t, мл,
N – концентрация раствора Na2S2O3, моль/л,
10–1 – объем титруемой аликвоты изучаемой смеси, мл.
Значение v0 величины экспериментально определить не удается, т.к. от
момента вливания ацетона в реакционную колбу до момента взятия первой пробы проходит значительное время. Поэтому для определения начального
объема ( v0 ) строят график в координатах vt f (t) и экстраполяцией до времени
t=0 находят искомую величину.
Константа скорости йодирования ацетона может быть найдена графически с использованием линейной формы уравнения (41):
ln |
C2 |
ln |
C20 k (C0 |
C0 ) t |
|
|
C |
|
C0 |
1 |
2 |
|
1 |
|
1 |
|
|
из наклона прямой в координатах ln C2 |
f (t) . |
||||
|
|
|
C1 |
|
|
Рис. 14. Определение константы скорости йодирования ацетона в кислой среде графическим методом по уравнению второго порядка
Порядок выполнения работы для заданий (I-VII)
В каждую из шести колб емкостью 250 мл влить 0,1 М раствор I2, 1,0 М раствор HCl или CH3COOH и, если нужно, внести навеску соли (в зависимости от выполняемого задания), после чего в каждую колбу долить дистиллированной воды приблизительно до 200 мл (т.е. ниже метки мерной колбы). После этого колбы поместить в термостат, через 10–15 мин, после того, как раствор в термостате примет температуру опыта, в колбу быстро влить 2 мл ацетона (ацетон отмерить мерной пипеткой на 2 мл), отмечая время приливания ацетона как время начала реакции. Далее дистиллированной водой, предварительно термо-
37
статированной при температуре опыта, долить до метки, закрыть колбу и тщательно перемешать раствор.
После этого берут первую пробу на анализ. Момент отбора пробы отмечают по часам. Во время отбора пробы колбу из термостата не вынимать. Последующие пробы на анализ берут через 10–15 мин таким образом, чтобы разрыв между объемами 0,01 н раствора тиосульфата натрия, пошедшего на титрование двух соседних проб находился в интервале 0,5–1,0 мл.
Анализ на содержимое йода проводят так: предварительно подготовить конические колбочки емкостью 50 мл (7–8 штук); вымыть, залить в каждую по 10 мл 0,1 н NaHCO3, охладить в кристаллизаторе, заполненном снегом. Затем в колбочку с 0,1 н NaHCO3 вливают отобранную мерной пипеткой (10 мл) пробу и титруют 0,01 н раствором тиосульфата натрия. В качестве индикатора используют раствор крахмала.
Результаты эксперимента заносят в табл. 2.
Т а б л и ц а 2
Температура эксперимента – …. Катализатор – ….
Количество добавленной соли – ……..
t, |
vt , мл |
|
1 |
|
C2 |
Yэкс |
|
|
1 |
|
|
1 |
|
C10 C2 |
|
|||
мин |
|
|
|
|
X (v0 vt) N 10 |
ln |
C1 |
Yтеор |
Y |
k t |
|
|
|
ln |
|
|
|
|
Na |
S |
O |
3 |
C0 |
C0 |
C0 |
C |
|
||||||||||
|
2 |
2 |
|
|
|
|
|
|
|
|
1 |
2 |
|
2 |
1 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задание I
Цель работы: изучение влияния температуры на скорость йодирования ацетона. Расчет энергии активации.
Провести не менее четырех опытов при различных температурах (от 30 до 45°С). Концентрация ацетона, катализатора и йода постоянна. В качестве катализатора использовать 1,0 М соляную кислоту.
Обработка результатов эксперимента:
1.Результаты работы представить в виде табл. 2.
2.Построить график зависимости в координатах vt f (t) для нахожде-
ния v0 .
3. Рассчитать значения констант скоростей йодирования ацетона при всех температурах по уравнению (41).
38

4. Для графического расчета констант скорости йодирования ацетона по-
строить график в координатах ln C2 f (t) . Сравнить значения констант скоро-
C1
стей, рассчитанных аналитически и графическим методом.
5. Для расчета энергии активации построить графическую зависимость в координатах ln k f ( 1T) . Все расчеты и графические построения проводить в пакетах Microsoft Excel и Origin 7.0 (8.0).
6.Экспериментальные результаты в виде таблиц и графиков представить
ввиде распечаток, на графические зависимости нанести аппроксимационные уравнения и коэффициент корреляции (для линейных зависимостей).
Задание II
Цель работы: изучение влияния соли, не содержащей одноименного иона с катализатором – кислотой, на скорость йодирования ацетона. Первичный солевой эффект.
Приготовить серию из 6-ти мерных колб, емкостью 250 мл, содержащих различные количества соли (по указанию преподавателя).
|
|
Cодержимое колбы |
|
||
№ колбы |
Количество I2 |
Количество ка- |
Количество |
Количество |
|
(0,1 М), мл |
тализатора (1,0 |
соли, г |
ацетона, мл |
||
|
|||||
|
|
М HCl), мл |
|
|
|
1 |
25 |
25 |
0 |
2 |
|
2 |
25 |
25 |
m1 |
2 |
|
3 |
25 |
25 |
m2 |
2 |
|
4 |
25 |
25 |
m3 |
2 |
|
5 |
25 |
25 |
m4 |
2 |
|
6 |
25 |
25 |
m5 |
2 |
|
Перед началом опыта рассчитать, какую навеску соли в граммах (mi) нужно взять, чтобы создать отделенную концентрацию этой соли в колбе емкостью 250 мл. Первичный солевой эффект наблюдается в присутствии солей KNO3, KCl, K2SO4, Na2SO4,NaNO3 при изменении их концентрации в пределах от 0,1 до 4,0 моль/л. Максимальная концентрация соли определяется ее растворимостью.
При добавлении небольших концентраций соли первичный солевой эффект незначителен, поэтому при выполнении этих опытов требуется особая тщательность.
39
Обработка результатов эксперимента
1. Результаты работы представить в виде табл. 2. Построить график зависимости в координатах vt f (t) для нахождения v0 .
2.Рассчитать значения констант скоростей йодирования ацетона по уравнению (41).
3.Для иллюстрации первичного солевого эффекта полученные результа-
ты представить в виде графической зависимости |
k |
f (m ). |
|
||
|
k0 |
|
|
|
соли |
4.Экспериментальные результаты в виде таблиц и графиков представить
ввиде распечаток, на графические зависимости нанести аппроксимационные уравнения и коэффициент корреляции (для линейных зависимостей).
Задание III
Цель работы: изучение влияния соли, содержащей одноименный ион с катали- затором-кислотой, на скорость йодирования ацетона.
Приготовить серию из 6-ти мерных колб, емкостью 250 мл, содержащих различные количества ацетата натрия. В качестве катализатора использовать 1 н уксусную кислоту.
|
|
Cодержимое колбы |
|
|
№ колбы |
Количество I2 |
Количество ка- |
Концентрация |
Количество |
(0,1 М), мл |
тализатора (1,0 |
СH3COONa в |
ацетона, мл |
|
|
|
М СH3COOH), |
смеси, моль/л |
|
|
|
мл |
|
|
1 |
25 |
25 |
0 |
2 |
2 |
25 |
25 |
0,005 |
2 |
3 |
25 |
25 |
0,01 |
2 |
4 |
25 |
25 |
0,1 |
2 |
5 |
25 |
25 |
0,2 |
2 |
6 |
25 |
25 |
0,3 |
2 |
Перед началом опыта рассчитать, какую навеску соли в граммах (mi) нужно взять, чтобы создать отделенную концентрацию этой соли в колбе емкостью 250 мл. Рекомендуемая температура проведения йодирования 50–55°С. В области малых концентраций ацетата натрия скорость йодирования ацетона сильно замедляется, поэтому рекомендуется для колб № 2 и № 3 интервал между титрованием не менее 25–30 мин.
40
