
практические работы по кинетике
.pdf
Концентрацию промежуточного продукта можно определить из условия равновесия, первой стадии:
K [(C12 H22O11) H3O ] , [(C12 H22O11)] [H3O ]
где K k2 – константа равновесия первой стадии: k1
[(C12 H22O11 ) H3O ] K [(C12H22O11 )] [H3O ].
Тогда скорость гидролиза сахарозы равна:
W k3 K[C12 H22O11 ][H3O ][H 2O].
Поскольку в каждом отдельном эксперименте концентрация ионов гидроксония остается постоянной, а концентрация воды в водном растворе велика по сравнению с концентрацией сахарозы, то:
W k[(C12H22O11)] , где k k3 K[H2O][H3O ].
Таким образом, скорость инверсии сахарозы при данной концентрации катализатора зависит только от концентрации сахарозы и протекает как реакция первого порядка.
Сахароза и продукты ее гидролиза принадлежат к числу оптически активных веществ, что связано с наличием в их молекулах ассиметричных атомов углерода. Молекулы оптически активных веществ способны изменять положение плоскости поляризации проходящего через них поляризованного света (светового потока, в котором колебания происходят в определенной плоскости). Угол поворота плоскости колебаний поляризованного света называется углом вращения плоскости поляризации и обозначается . Его величина прямо пропорциональна толщине слоя и концентрации активного вещества:
bcd ,
где b – коэффициент пропорциональности (постоянная поляризации или удельное вращение), который зависит от природы вещества, длины волны, температуры и растворителя; величина b, которая равна углу вращения при концентрации С = 1 г/мл и толщине слоя d = 1 дм, называется удельным вращением, знаки «+» и «–» отвечают, соответственно, правому и левому вращению.
Тростниковый сахар вращает плоскость поляризации вправо ( = 65,66о), а смесь продуктов инверсии – влево, т.к. глюкоза вращает вправо ( = 52,5°), а фруктоза – влево ( = –91,9о). Поэтому по мере протекания реакции угол вращения плоскости поляризации уменьшается, падает до нуля и затем, становится отрицательным (инверсия вращения). Окончанию реакции соответствует предельное неизменяющееся во времени отрицательное значение угла вращения.
Скорость реакции гидролиза тростникового сахара изучает по измерению меняющегося во времени угла вращения плоскости поляризации водного, раствора сахарозы с добавлением раствора НСl.
61
Для расчета константы скорости инверсии тростникового сахара в выра-
жение |
k |
1ln |
C0 |
вместо |
концентраций |
подставляют |
|
пропорциональные |
им |
||||||||||||||
|
|
t |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разности соответствующих углов вращения: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
1 |
|
|
const( 0 |
) |
|
|
|
1 |
|
0 |
|
|
|
||||||
|
|
|
|
k t ln |
|
|
|
|
|
|
|
|
|
|
|
ln |
|
|
|
, |
(48) |
||
|
|
|
|
const( |
0 |
|
|
) const( |
0 |
) |
t |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
t |
|
|
|
|
t |
|
|
|
|||||
где 0 – угол вращения в момент начала реакции,
t – угол вращения в момент времени t от начала реакции,
– угол вращения, соответствующий концу реакции.
Для определения угла вращения плоскости поляризации используются специальными приборами – поляриметрами, чаще всего применяются так называемые полутеневые поляриметры. Методика работы с поляриметром изложена в ПРИЛОЖЕНИИ 2.
Порядок выполнения работы
В стакан с емкостью 100 мл отобрать пипеткой 25 мл 20%-ного раствора сахарозы (раствор сахарозы предварительно отфильтровать) и туда же влить 25 мл раствора HCl (концентрация HCl указывается преподавателем). Момент слияния кислоты с раствором сахарозы отмечается как начало реакции. Смесь тщательно перемешивается и быстро вливается в хорошо промытую поляриметрическую трубку, предварительно сполоснутую дистиллированной водой и раза 2 – небольшим количеством исследуемого раствора.
При заполнении трубки надо следить за тем, чтобы в неё не попал воздух. Для этого трубку нужно заполнить до краев так, чтобы жидкость образовала выпуклый мениск, затем осторожно надвинуть покровное стекло и навинтить кольцо, прижимающее стекло к торцу трубки. При этом проверить также: не подтекает ли трубка (не образуется ли пузырек воздуха через некоторое время после заполнения).
Наполненную трубку обтереть фильтровальной бумагой, обратив особое внимание на чистоту, сухость и прозрачность стекол, закрывающих торцы трубки и поместить в желобок поляриметра в крайнее положение, ближайшее к окуляру. Отсчеты следует проводить только после получения четкого изображения шкалы и поля зрения при вращении соответствующей муфты на зрительной трубке поляриметра. Чем выше концентрация кислоты, тем чаще следует проводить отсчеты углов вращения, постепенно увеличивая интервал между измерениями. Всего следует сделать 10–12 измерений. Все измерения следует проводить по возможности быстро.
По окончании измерений следует определить угол вращения, соответствующий концу реакции ( ). Для этого ту же трубку заполнить смесью 25 мл
20%-ного раствора сахарозы и 25 мл 6 н раствора кислоты, смесь предварительно выдерживается в термостате 30 мин при температуре 40оС.
62
Так как кислота разрушает металлическую оправу поляриметрической трубки ее необходимо сразу же после окончания опыта тщательно промыть дистиллированной водой.
Результаты измерений заносят в табл. 15.
Т а б л и ц а 15
Температура опыта –___, концентрация HCl –___,–___
|
Время от |
|
|
|
k |
|
|
|
№ изме- |
начала |
t |
t |
Ln( t ) |
|
|
|
|
k |
|
|||||||
рения |
реакции, |
(указать раз- |
|
|||||
|
мин |
|
|
|
мерность) |
|
|
|
|
|
|
|
|
|
|
|
|
По результатам опыта вычислить константу скорости реакции при данной температуре для каждого момента времени по формуле (48).
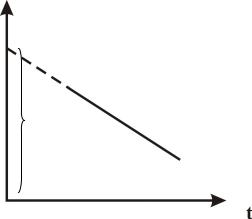
Угол 0 , соответствующий началу реакции, практически измерить не
удается, поскольку от начала реакции до первого измерения проходит значительное время, поэтому значение (точнее ln( t )) определяют по графику в
координатах ln( t ) f (t) (рис. 21).
ln( t )
ln( 0 )
Рис. 21. Определение угла 0 , соответствующего началу реакции
63

Типы выполняемых заданий
Задание I. Изучение зависимости скорости инверсии сахарозы от начальной концентрации катализатора
Целью работы является получение зависимости константы скорости инверсии сахарозы от концентрации катализатора.
В этом случае выполняют 3–4 опыта при постоянной концентрации сахарозы, но при различных концентрациях соляной кислоты (от 4 до 6 н НС1). Результаты опытов вносят в таблицу (см, выше) и представляют в виде графиков; 1. зависимость ln( t ) f (t) (результаты всех опытов представляют на
одном графике, в одном и том же масштабе), рассчитывают константы скорости графически и аналитически,
2. строят график зависимости константы скорости реакций инверсии сахарозы от концентрации катализатора.
Задание II. Изучение зависимости скорости инверсии сахарозы от температуры
Цель работы – расчет энергии активации гидролиза тростникового саха-
ра.
Проводят 3–4 опыта при постоянной концентрации. Сахарозы и соляной кислоты (4–5 М), но при различных температурах в интервале от 20 до 35°С, Результаты измерений сводят в таблицу и представляют в виде графиков.
1. Зависимость ln( t ) f (t) (результаты всех опытов представляют
на одном графике, в одном и том же масштабе). Рассчитывают константы скорости графически и аналитически.
2. Зависимость ln k f ( 1T ) для расчета энергии активации по уравнению Аррениуса.
Порядок расчета
Уравнение для расчета константы скорости инверсии сахарозу (48) можно представить в линейном виде:
ln( t ) ln( 0 ) kt
Случайную погрешность в константе скорости находят методом регрессионного анализа в предположении неоднородности дисперсии воспроизводимости (последнее возможно, когда экспериментальные значения функции при различных значениях аргумента вследствие каких-либо причин имеют различную точность). Для учета неоднородности экспериментальных данных вводится весовая функция wi, обратно пропорциональная дисперсии:
wi |
|
C |
, |
|
S |
2 |
(y ) |
||
|
|
|
||
|
|
|
i |
|
64

n
где С – некоторая константа, которую удойнее выбрать при условии wi 1,
i 1
|
|
|
|
|
|
|
|
n |
|
|
|
|
n |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
wi |
C |
|
|
|
|
|
1. |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
S 2 |
( y ) |
|
|
|
|
|
|
|
|
|||||||||||||||||
Отсюда |
|
|
|
|
|
i 1 |
|
|
|
|
i 1 |
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
2 (yi ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
i 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
wi |
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
S2 (yi ) S2 (yi ) |
|
|
|
|
|
|
|
|
|
|||||||||||||
Т.к. в данном случае |
|
|
|
|
|
|
|
|
|
|
|
i 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
yi |
ln( t ) , |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
2 (yi ) ( дуi |
|
|
|
|
|
|
|
|
дуi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
S |
)2 S 2 ( t ) ( |
|
)2 S 2 ( ) |
или |
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
д |
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
д t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
S 2 (y ) [ |
д ln( t |
) |
]2 |
S 2 ( |
) [ |
д ln( t ) |
]2 |
S 2 ( |
|
) |
, |
||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
i |
|
|
д t |
|
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
д |
|
|
|
|
|
|
|||||
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|||||
S |
2 ( y ) [ |
|
|
]2 S 2 ( |
) [ |
|
|
|
|
]2 S |
2 ( |
|
) |
|
|
|
S 2 |
( ). |
|||||||||||||||
t |
|
|
t |
|
|
( t )2 |
|||||||||||||||||||||||||||
|
i |
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Принимая, что S 2 ( t ) S 2 ( ) S 2 ( ), отсюда:
wi ( t )2 2 . ( t )
Основные параметры линейной зависимости рассчитываются с учетом весовой функции следующим образом:
x wi xi , a0 wi yi ,
b |
wi yi (xi x) |
0 |
wi (xi x)2 . |
Значение константы скорости и ее случайной погрешности находится по формуле:
k b0 t1 ( f ) S (bo ) ,
65

где t1 ( f ) – коэффициент Стьюдента для f – числа степеней свободы ( f n 2 )
и доверительной вероятности ( =0,95), дисперсия S(bo ) рассчитывается по формуле:
S 2 (bo ) S 2 (2) (Xi X )2 .
Расчет константы скорости инверсии тростникового сахара и ее случайной погрешности можно провести с использованием пакетов Microsoft Excel и Origin.
После расчета всех значений констант скорости при различных температурах строится графическая зависимость в координатах уравнения Аррениуса, по тангенсу угла наклона полученной прямой проводится расчет энергии активации инверсии сахарозы.
Вопросы к работе
1.Дать понятие скорости реакции. В каком случае можно использовать запись W dcdti ?
2.В каком случае перед производной ставится знак «–» и почему?
3.Дайте понятие кинетического уравнения.
4.Объясните физические смысл константы скорости, какова ее размерность?
5.Что такое порядок реакции? Почему порядок реакции может иметь дробное, отрицательное значение?
6.Как влияет температура на скорость реакции?
7.На какую из величин, входящие в кинетическое уравнение, главным образом, влияет температура?
8.Запишите уравнение Аррениуса в дифференциальной и интегральной форме, какая из форм уравнения имеет более общий характер и почему?
9.С чем может быть связано отклонение от линейности в зависимости
ln k f ( 1T ) ?
10.Каков механизм гидролиза сахарозы.
11.Напишите кинетическое уравнение, описывающее гидролиз сахарозы.
12.Каким образом контролируется изменение концентрации сахарозы во
времени?
13.Что означаем термин «псевдопервый порядок», запишите уравнение для расчета константы скорости первого порядка. Какова размерность константы скорости первого порядка?
14.Почему реакция гидролиза сахароза является реакцией псевдопервого
порядка?
15.Как доказать псевдопервый порядок?
66
16. Изобразите в одном масштабе зависимость ln( t ) от t для различ-
ных концентраций катализатора при постоянной концентрации сахарозы и постоянной температуре?
17. Изобразите в одном масштабе зависимость ln( t ) от t для одина-
ковых начальных концентраций сахарозы и катализатора при различных температурах?
18. Каким образом, используя зависимость ln( t ) от t графически можно определить константу скорости?
19.Что такое энергия активации? Какой минимум данных необходим для
еерасчета?
20.Почему при вычислении константы скорости реакции гидролиза сахарозы вместо концентраций можно пользоваться значениями угла вращения плоскости поляризации?
21.Как классифицируются кислотно-основные каталитические реакции?
22.Назовите особенности, характерные для реакций специфического кислотного катализа.
67
3.4. Изучение кинетики реакции восстановления гексацианоферрата (III) аскорбиновой кислотой
В присутствии слабых окислителей аскорбиновая кислота дегидрируется до дегидроаскорбиновой кислоты (С6H606). Реакция протекает по уравнению:
С6H8О6 + 2 [Fe(CN)6]3– С6H6О6 + 2 [Fe(CN)6]4– + 2 H+.
Более энергичное окисление приводит к глубокому разрушению аскорбиновой кислоты.
Механизм восстановления гексацианоферрата (III) аскорбиновой кислотой (для краткости АН2) в кислой среде включает промежуточную стадию образования аскорбат-иона АН–:
|
|
|
k1 |
|
- |
|
|
|
|
|
|
|
AH2 |
|
H |
, |
|
(а) |
|||
|
|
AH |
|
|
||||||
|
|
|
k-1 |
|
|
|
|
|
|
|
AH |
|
|
3 |
k2 |
|
* |
|
4 |
. |
(б) |
|
[Fe(CN )6 ] |
AH |
[Fe(CN )6 ] |
|||||||
Стадия (б) – лимитирующая.
Далее свободный радикал аскорбиновой кислоты (АН*) атакуется ионом [Fe(CN)6]3– с образованием продукта реакции – дегидроаскорбиновой кислоты:
AH |
* |
[Fe(CN )6 |
] |
3 |
k3 |
] |
4 |
. |
(в) |
|
|
A [Fe(CN )6 |
|
Скорость изменения концентрации гексацианоферрата (III) в ходе реакции можно рассчитать по следующему выражению:
|
d[[Fe(CN)6]3 ] |
k2[AH ][[Fe(CN)4 ] 3 ] |
k3 [AH *][[Fe(CN)6 ]3 ] . |
(49) |
|
dt |
|||||
|
|
|
|
Кроме концентрации гексацианоферрата (III) в выражение (49) входят текущие концентрации промежуточных веществ: аскорбат-иона АН– и свободного радикала аскорбиновой кислоты (АН*). Для того, чтобы получить кинетическое уравнение окисления аскорбиновой кислоты, которое может быть использовано для расчета скорости реакции, необходимо концентрации всех промежуточных веществ выразить через концентрации исходных реагентов с помощью метода стационарных концентраций Боденштейна. Для нахождения концентрации аскорбат-иона АН– воспользуемся стадиями уравнения (а):
d[AH ] k [AH ] k |
[AH ][H ] k [AH ][[Fe(CN ) |
]3 ] 0 |
(50) |
||
dt |
1 2 1 |
2 |
4 |
. |
|
|
|
||||
Для нахождения концентрации свободного радикала аскорбиновой кислоты (АН*) используем стадии (б) и (в):
d[AH*] |
k2[AH ][[Fe(CN)6 ]3 ] k3[AH *][[Fe(CN)6 ]3 ] 0 . |
(51) |
dt |
|
|
Решая совместно уравнения (49) и (51), получаем:
|
d[[Fe(CN )6 ]3 ] |
k |
[AH |
|
][[Fe(CN ) |
3 |
] k [AH |
|
] k |
|
[AH |
|
][H |
|
]. |
(52) |
|
|
|
|
] |
|
1 |
|
|
||||||||||
dt |
|
|
|
|
|||||||||||||
|
2 |
|
|
4 |
|
1 |
|
|
|
|
|
|
|
|
|||
68

Решение уравнений (50) и (52) приводит к выражению:
|
|
|
|
d[[Fe(CN) ]3 ] |
|
|
2k k [AH ][[Fe(CN) |
]3 ] |
|
|
(53) |
||||||||||
|
|
|
dt |
|
|
k 1[H ] k2[[Fe(CN )6 ]3 ] . |
|
||||||||||||||
|
|
|
|
|
6 |
|
|
|
1 |
2 |
2 |
|
|
|
6 |
|
|
|
|
||
Так как стадия (б) является медленной, определяющей скорость всего |
|||||||||||||||||||||
процесса, а также равновесие |
|
в стадии |
|
(а) |
устанавливается быстро |
(т.е. |
|||||||||||||||
k-1>>k2[[Fe(CN )6 ]3 ] |
при низкой концентрации [[Fe(CN )6 ]3 ] ), то преобразуем зна- |
||||||||||||||||||||
менатель уравнения (53): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
d[[Fe(CN) ]3 ] |
|
|
2k k [AH ][[Fe(CN) |
]3 ] |
. |
|
(54) |
||||||||||
|
|
|
|
6 |
|
|
1 |
2 |
2 |
|
|
|
6 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
dt |
|
|
|
|
|
|
k |
1 |
[H |
] |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
В соответствии с указанным механизмом реакции на одну молекулу АН2 |
|||||||||||||||||||||
расходуется две молекулы К3[Fe(CN)6], поэтому: |
|
|
|
|
|||||||||||||||||
|
1 d[[Fe(CN)6 |
]3 ] |
|
d[AH2 ] |
k |
/ |
|
|
|
|
3 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
[AH |
2 ][[Fe(CN)6 ] |
] , |
(55) |
|||||||
2 |
|
dt |
|
|
|
|
dt |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
где k / 2k1k2 (k |
|
[H ]) . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Правильность предложенного механизма восстановления аскорбиновой кислотой подтверждается характером влияния ионной силы раствора на скорость процесса.
За скоростью реакции следят по определению количества неизрасходованного гексацианоферрата (III) во времени. Содержание [Fe(CN)6]3– определяется на спектрофотометре при 400–450 нм. Благодаря высокому начальному содержанию серной кислоты (рН 1÷2), концентрация ионов [Н+] в течение реакции практически не меняется, поэтому ионную силу раствора можно считать практически постоянной.
Поскольку реакционная смесь содержит 5 10-кратный избыток аскорбиновой кислоты, по сравнению с содержанием [Fe(CN)6]3–, реакция (в соответствии с уравнением (55)) должна иметь первый порядок по [Fe(CN)6]3–. В связи с этим, кривая на графике в координатах lg[[Fe(CN)6]3–] = f(t) должна быть линейной вплоть до протекания реакции на глубину ~ 80 %. Если в этом интервале концентраций раствор подчиняется закону Бугера–Ламберта–Бэра, то вместо концентрации [Fe(CN)6]3– на график можно наносить пропорциональную ей величину оптической плотности.
При эквивалентном содержании реагентов:
[Fe(CN )6 ]3 = 4∙10–4 моль/л; [АН2] = 2∙10–4 моль/л,
согласно уравнению (53), реакция должна иметь второй порядок и зависимость в координатах 1[[Fe(CN)6 ]3 ] f (t) должна быть линейной.
Уравнение (55) показывает, что скорость восстановления гексацианоферрата (III) должна падать с увеличением концентрации ионов [Н+].
69

Порядок выполнения работы
Подготовить спектрофотометр для измерений (см. ПРИЛОЖЕНИЕ 1). Подготовить и термостатировать две колбы с водными сернокислыми растворами реагентов (рН 1÷1,1): одну мерную колбу вместимостью 100 мл заполнить до метки 4∙10–4 М раствором К3[Fe(CN)6], в другую колбу вместимостью 200–250 мл поместить 100 мл 3·10–3 М раствора аскорбиновой кислоты.
После 20–25 мин термостатирования раствор К3[Fe(CN)6] перелить в колбу, содержащую 100 мл аскорбиновой кислоты. Момент сливания растворов отметить по секундомеру как время начала реакции. Колбу с реакционной смесью поместить в термостат. Из реакционной смеси по ходу реакции отбирать пробы по 10 мл (или большего объема в зависимости от используемой кюветы), быстро охлаждать их на ледяной бане и, добавив по 0,5 мл концентрированной серной кислоты (для большего торможения реакции), измерять их оптическую плотность. Первую пробу отбирать через 5 мин после начала реакции, вторую – через 10 мин, а далее – в соответствии с темпом изменения оптической плотности раствора.
Полученные результаты занести в табл. 16 по образцу.
Т а б л и ц а 16
Температура опыта, °С ___;
исходная концентрация К3[Fe(CN)6], моль/л ___; исходная концентрация АН2, моль/л ___; рН ___.
Время |
из- |
Время от нача- |
|
lgd |
|
d |
k, |
|
|
k |
/ |
|
k |
[AH2 |
], |
|
ла |
реакции, |
dt |
(*) |
lg0 |
|
–1 |
|
|
||||||||
мерения |
|
мин |
|
|
t |
d (**) |
мин |
|
|
|
|
|
–1 |
|
||
|
|
|
|
|
|
|
t |
|
|
|
мин·л·моль |
|
||||
|
|
|
|
|
|
|
|
|
|
|||||||
*В |
экспериментах с |
эквивалентным |
количеством |
реагентов |
(например, |
|||||||||||
К3[Fe(CN)6] =4·10–4 моль/л и [АН2]=2·10–4 моль/л) в таблице графу lgdt заменить на
|
1 |
|
, и kск считать по уравнению второго порядка. Для графического определе- |
||||||
|
CK3[Fe(CN )6 ] |
|
|
|
|
|
|
||
ния kск использовать график в координатах |
1 |
|
f (t) . |
||||||
|
C[Fe(CN )6 ]3 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
** Эту графу в таблице заменить на |
1 |
1 |
. |
||||
|
|
|
|
|
|
||||
|
|
CK3[Fe(CN )6 ] |
|
C0 ,K3[Fe(CN )6 ] |
|||||
Рассчитывать kск по уравнению первого порядка, заменив концентрацию значениями оптической плотности:
k 2,3 lg d0 . t dt
70
