
практические работы по кинетике
.pdf3.2. Разложение перекиси водорода
Распад перекиси водорода в водном растворе ускоряется многими ионами, например, Fe2+, Fe3+, Cr2O72–, WO42–, MoO42–. В присутствии ионов Cr2O72–
гомогенно-каталитическое разложение перекиси водорода протекает в две стадии:
1) В первой стадии реакция обратима, образуется промежуточное соединение Cr2O92–:
 .
.
2) Далее промежуточное соединение необратимо распадается с выделением кислорода и исходного иона Cr2O72–:
 .
.
Полагая, что лимитирующей стадией процесса является относительно медленный распад промежуточного соединения, общую скорость процесса можно считать пропорциональной концентрации промежуточного вещества, то есть:
|
dCH2O2 |
k CCr O2 , |
||
dt |
||||
|
2 |
9 |
||
|
|
|||
где k – константа скорости второй стадии.
Концентрацию промежуточного иона можно найти, использую константу
равновесия первой стадии ( Kc ): |
(C |
|
C |
2 ) , |
(45) |
||
Kc C2 |
2 |
||||||
|
|
CCr O2 |
|
|
|
||
|
|
|
2 |
9 |
|
|
|
|
H2O2 |
Cr O |
Cr O |
|
|||
|
|
2 |
7 |
2 |
9 |
|
|
где Kc – константа равновесия первой стадии; CCr2O72 – исходная концентрация катализатора;
(CCr2O72 CCr2O92 ) – концентрация катализатора в условиях равновесия, CCr2O92 – концентрация промежуточного соединения;
CH2O2 – концентрация перекиси водорода.
Вода находится в большом избытке и ее концентрацию можно считать постоянной.
Из уравнения (45) получаем:
C |
|
|
|
|
|
|
|
Kc CH2 |
O |
|
C |
|
|
|
, |
|
|
|
|
||
|
2 |
|
|
|
|
|
2 |
2 |
|
2 |
|
|
|
|
|
||||||
|
1 |
|
|
2 |
|
|
|
|
|
||||||||||||
Cr O |
|
|
|
|
|
Cr O |
|
|
|
|
|
||||||||||
|
2 |
9 |
|
|
Kc CH2O2 |
2 |
7 |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
откуда |
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
dCH O |
k |
Kc |
O |
|
|
C |
|
|
. |
(46) |
||||||||||
|
|
|
2 2 |
|
|
|
2 |
2 |
|
|
2 |
|
|||||||||
|
|
dt |
|
|
|
|
|
|
|
2 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cr O |
|
|
|||||
|
|
|
|
|
|
|
1 Kc CH2O2 |
|
|
|
2 |
7 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Из уравнения (46) следует:
во-первых, скорость процесса разложения перекиси водорода пропорциональна концентрации катализатора,
51

во-вторых, в общем случае порядок реакции по перекиси водорода дробный и может меняться от 0-го до 2-го.
Действительно, если равновесие первой стадии сдвинуто в сторону обра-
зования |
промежуточного |
продукта, |
т.е. |
в |
уравнении |
(46) произведение |
|||||||||
Kc CH2 |
O |
1, то порядок реакции равен нулю: |
|
|
|||||||||||
2 |
2 |
|
|
|
|
|
|
dCH2O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k CCr O2 . |
|
||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
dt |
|
|
|
2 |
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
В случае, когда Kc |
CH2 |
O 1, то есть равновесие сдвинуто в сторону исходных |
|||||||||||||
веществ: |
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
||
|
dCH O |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
k Kc C |
|
|
|
CH2 |
O k * CH2 |
O , |
|||||
|
|
|
|
|
2 2 |
|
|
2 |
|||||||
|
|
|
dt |
|
|
||||||||||
|
|
|
|
|
|
Cr O |
|
|
2 2 |
2 2 |
|||||
|
|
|
|
|
|
|
|
|
|
2 |
7 |
|
|
|
|
|
|
k* k Kc CCr O2 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
2 |
7 |
|
|
|
|
|
|
|
и порядок реакции будет равен 2.
Поскольку сдвиг равновесия в ту или иную сторону зависит от температуры, то и порядок реакции разложения перекиси водорода изменяется от температуры.
Уравнение (46) можно преобразовать в линейную форму, взяв обратное значение скорости реакции:
|
1 |
|
|
|
|
|
1 |
|
|
|
1 |
|
|
1 |
|
|
. |
(47) |
||
dCH O |
|
k K |
|
C |
|
|
C2 |
|
k C |
|
|
|||||||||
|
|
|
c |
2 |
|
|
|
|
|
2 |
|
|
||||||||
|
2 2 |
dt |
|
|
Cr O |
|
H2 O2 |
|
|
Cr O |
|
|||||||||
|
|
|
|
|
2 |
7 |
|
|
|
|
|
|
2 |
7 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Построив график в координатах: |
|
|
1 |
|
|
f ( |
1 |
|
|
) , можно рассчитать кон- |
||||||||||
dCH O |
|
|
C2 |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||||||
|
|
|
|
|
|
|
2 2 |
|
|
|
|
|
H |
|
|
|
|
|||
|
|
|
|
|
|
|
|
dt |
|
|
2 |
|
2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
станту скорости лимитирующей стадии и константу равновесия первой стадии. Для реакций, в ходе которых изменяется число моль в газовой фазе особенно удобным и надежным методом контроля скорости реакции является газометрический метод. Суммарное уравнение разложения перекиси водорода за-
писывается так:
2 Н2О2 Н2О + О2,
т.е. по нарастанию давления в системе или по изменению объема систем при постоянном давлении можно следить за кинетикой разложения перекиси водорода.
Измерительная система (рис. 18) состоит из газометрической бюретки (1) с уравнительной склянкой (2). Уравнительная склянка нужна для того, чтобы отсчеты измерений объема кислорода производить при одном и том же давлении (атмосферном). Уравнительная склянка сообщается с бюреткой при помощи резинового шланга.
Реакционный сосуд (3) резиновым шлангом соединен с измерительной системой. Прежде чем приступить к работе, необходимо проверить герметичность установки, для чего кран (4) повернуть в положение (а), опустить уравнительную склянку ниже уровня бюретки. Уровень воды в бюретке при этом несколько опустится и установится на некотором делении бюретки. Если это по-
52

ложение не изменится в течение 2–3 минут, установку можно считать герметичной. В противном случае уровень воды в бюретке будет непрерывно падать.
Рис. 18. Схема волюмометрической установки
Опыт производится следующим образом: в чистый реакционный сосуд
(В) заливают определенное количество (по указанию преподавателя) раствора перекиси водорода, при этом кран находится в положении (б), далее необходимо быстро прилить в реакционный сосуд раствор бихромата калия и повернуть кран в положение (а) и пустить секундомер. Отсчет времени и соответствующего времени объема кислорода ведут через 10–15 секунд до тех пор, пока реакция практически не прекратится (раствор в реакционном сосуде снова будет иметь оранжевую окраску).
Рекомендуется при замедлении выделения кислорода увеличивать интервал времени между замерами объема кислорода. Для того, чтобы определить максимальное количество выделившегося кислорода, необходимо, не разбирая установку, опустить реакционный сосуд в стакан с горячей водой. После полного разложения перекиси водорода реакционный сосуд охладить до комнатной температуры и измерить уровень жидкости в бюретке, определив тем самым и максимальный объем выделившегося кислорода ( nOmax2 ). Помните, что при изме-
рении объема кислорода уровень жидкости в уравнительной склянке и измерительной бюретки должны быть одинаковы (газ собирается при постоянном давлении).
Расчет концентрации перекиси водорода
Для того, чтобы рассчитать концентрацию перекиси водорода в момент времени (CHt 2O2 ) и начальную концентрацию перекиси водорода (CH0 2O2 ), необхо-
димо знать:
1)объем кислорода при комнатной температуре – vt ;
2)давление насыщенного пара воды при комнатной температуре – PH2O ;
3)максимальный объем кислорода – vmax ;
53
4) комнатная температура – Ткомн.
Тогда число моль кислорода, выделившегося в момент времени nOt 2 и максимальное количество моль кислорода ( nOmax2 ) можно найти, используя следующие выражения:
nOt |
|
(Pбар PH2O ) vt |
, |
|
|
|
|||||
2 |
|
|
R Tкомн |
||
|
|
|
|||
nOmax |
|
(Pбар PH2O ) vmax |
. |
||
|
|||||
2 |
|
|
R Tкомн |
||
|
|
|
|||
Учитывая суммарное уравнение разложения перекиси водорода:
2 Н2О2 Н2О + О2,
концентрация перекиси водорода в растворе определяется по уравнению:
|
|
|
2(nmax nt |
) 1000 |
|
|||||
CHt |
O |
|
O2 |
|
O2 |
|
|
моль/л, |
||
|
|
V |
|
|
||||||
2 |
2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
2 nmax |
1000 |
|
|
||
CH0 |
|
O |
|
O2 |
|
|
моль/л, |
|||
|
|
V |
|
|
||||||
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где V – объем реакционной смеси, мл.
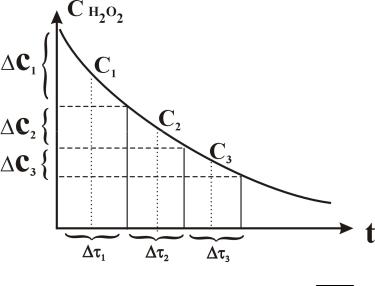
Скорость разложения перекиси водорода можно найти графическим дифференцированием кинетической кривой. Наиболее удобным и достаточно точным методом определения производной в данной точке является метод конечных отрезков.
Пусть дана кривая CH2O2 f (t) (рис. 19)
Рис. 19. Иллюстрация метода графического дифференцирования кинетической кривой
Для нахождения производной ( dCdtH2O2 ) в различных точках на кинетиче-
ской кривой необходимо ось времени (t) разделить на отрезки ti (эти отрезки
можно брать неодинаковыми, а именно большими там, где наклон кривой невелик, и изменения концентрации перекиси водорода во времени мала) и найти соответствующие им изменения концентрации Ci .
Отношение конечных приращений Ci равно производной в некоторой
ti
промежуточной точке. Обычно это значение производной относят к средней
54

точке отрезка. Поэтому при ручной обработке интегральной кривой выбранный отрезок делят пополам и, восстановив перпендикуляр на ось ординат, определяют концентрацию Ci, к которой относится найденное значение производной.
В итоге получают серию значений концентрации перекиси водорода (C1, C2, C3,..) и соответствующие этим концентрациям скорости реакции (W1, W2, W3…).
W1 |
|
C1 f (C1) ; W2 |
|
C2 f (C2 ) ; W3 |
|
C3 f (C3 ) ; W4 |
|
C4 f (C4 ) … |
|
|
t1 |
|
t2 |
|
t3 |
|
t4 |
Задание I
Цель работы: изучение зависимости скорости разложения перекиси водорода от концентрации катализатора. Определение порядка реакции.
Провести серию из 3–4 опытов, в которых варьируется начальная концентрация катализатора (K2Cr2O7), при этом температура опытов и начальная концентрация перекиси водорода поддерживается постоянной. Количество и концентрация растворов перекиси водорода и бихромата калия указывается преподавателем.
Обработка результатов эксперимента
1. Результаты работы представить в виде табл. 11
Т а б л и ц а 11
Начальная концентрация катализатора (K2Cr2O7), моль/л; Начальная концентрация перекиси водорода, моль/л; Температура опыта, К; Объем реакционной смеси, л;
Атмосферное давление Рбар, мм рт.ст., Давление насыщенного пара воды, Рн2о, мм рт.ст.
|
|
|
, мл |
CHt |
O , |
|
Ci |
|
|
|
1 |
|
1 |
|
ln( |
1 |
) |
ln C |
|
№ |
t, c |
t |
Сi |
C |
|
|
|
C |
|
||||||||||
|
2 2 |
|
|
|
|
2 |
|
|
|
||||||||||
|
|
v |
|
ti |
|
|
|
i ti |
|
|
i ti |
|
|
|
|||||
|
|
|
|
моль/л |
|
|
|
|
|
|
Ci |
|
|
|
i |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Построить на одном графике зависимости CH2O2 f (t) для различных
начальных концентраций катализатора, провести графическое дифференцирование кинетических кривых. Кроме того, экспериментальные зависимости аппроксимировать полиномом определенной степени и по найденному уравнению для выбранных значений концентраций рассчитать значение производной.
3. Рассчитать значения констант скорости лимитирующей стадии и констант равновесия первой стадии по уравнению (47) для чего построить график в
координатах |
1 |
|
f ( 1 |
2 ) |
Ci |
|
|||
|
ti |
Ci |
||
|
|
|
||
55

4. Для расчета порядка, реакции и константы скорости суммарного проразложения перекиси водорода построить график в координатах ) f (ln Ci ) . Сравнить значения рассчитанные в пп. 3 и 4.
5.Рассчитать изменение энергии Гельмгольца стадии образования промежуточного продукта по уравнению F 0 RT ln Kc .
6.Полученные данные представить в виде итоговой табл. 12.
Та б л и ц а 12
№ |
Начальная |
Константа ско- |
Константа |
Поря- |
Констан- |
Энергия |
|
концентрация |
рости лимити- |
скорости |
док ре- |
та рав- |
Гельм- |
|
катализатора, |
рующей ста- |
суммарного |
акции, |
новесия, |
гольца, |
|
моль/л |
дии, k |
процесса, k’ |
n |
Kc |
F0 |
|
|
|
|
|
|
|
Задание II
Цель работы: Изучение влияния температуры на скорость разложения перекиси водорода. Расчет энергии активации, теплового эффекта и изменения энтропии на стадии образования промежуточного соединения, порядка реакции.
Провести серию из 3–4 опытов, в которых варьируется температура (25–40°С), а начальные концентрации перекиси водорода и катализатора (бихромата калия) постоянны.
Обработка результатов эксперимента
1. Результаты работы представить в виде табл. 13
Т а б л и ц а 13
Начальная концентрация катализатора (K2Cr2O7), моль/л; Начальная концентрация перекиси водорода, моль/л; Температура опыта, К; Температура комнатная, Ткомн., К; Объем реакционной смеси, мл;
Атмосферное давление Рбар, мм рт. ст.; Давление насыщенного пара воды, Рн2о, мм рт. ст.
|
|
|
|
t |
|
Ci |
|
|
1 |
|
|
|
|
|
1 |
|
|
№ |
|
t, c |
vt , мл |
CH2O2 , |
|
Сi |
|
|
|
1 |
|
|
ln( |
|
) |
ln Ci |
|
|
Ci ti |
Ci2 |
|
Ci ti |
|||||||||||||
|
моль/л |
ti |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
2. Построить на одном графике зависимости CH2O2 |
f (t) |
для различных |
||||||||||||||
температур, провести графическое дифференцирование кинетических кривых. Результаты расчета представить в виде таблицы с использованием пакета Microsoft Excel.
56

3. Рассчитать значения констант скоростей лимитирующей стадии (k) и константу равновесия (Kc) по уравнению (47) для чего построить график в ко-
ординатах |
1 |
f ( 1 2 ) . |
|
|
|
|
|
|
||
|
Ci |
ti |
Ci |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
4. Для расчета порядка реакции и константы скорости разложения пере- |
||||||||||
киси водорода по кинетическому уравнению типа: |
|
dC H2O2 |
k*CHn |
O , для чего |
||||||
dt |
||||||||||
|
|
|
|
|
|
|
2 |
2 |
||
|
|
|
|
|
|
|
|
|||
построить график в координатах ln( |
Ci ) f (ln CH O ) . Сравнить значения k и k*, |
|||||||||
|
|
|
|
ti |
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
||
рассчитанные в пп. 3 и 4.
5.Рассчитать энергию активации методом трансформации по уравнению (12), для чего построить график в координатах ln( c ) f ( 1T ) .
6.Рассчитать энергию активации по температурной зависимости константы скорости по уравнению (11), для чего построить графическую зависи-
мость в координатах ln(k) f ( 1T )
7.Рассчитать изменение стандартной энергии Гельмгольца стадии образования промежуточного соединения по уравнению F 0 RT ln Kc .
8.Рассчитать изменение внутренней энергии ( U 0 Q тепловой эффект) на стадии образования промежуточного продукта по уравнению изохоры Вант-
Гоффа, для чего построить график в координатах ln(Kc ) f (1T ) .
9.Рассчитать изменение энтропии ( S0 ) на стадии образования промежуточного продукта по уравнению F0 U 0 T S0 .
10.Полученные результаты представить в виде итоговой табл. 14.
Та б л и ц а 14
№ |
Кон- |
Констан- |
Поря- |
Энергия |
Энергия |
Тепловой |
Энтропия, |
|
станта |
та равно- |
док |
актива- |
Гельм- |
эффект, |
Дж/моль·К |
|
скоро- |
весия, Kc |
реак- |
ции, |
гольца, |
кДж/моль |
|
|
сти, k |
|
ции, n |
кДж/моль |
F0, |
|
|
|
|
|
|
|
кДж/моль |
|
|
|
|
|
|
|
|
|
|
Вопросы к работе
1.Что понимают под термином «скорость химической реакции»?
2.В каком случае скорость реакций может быть выражена изменением концентрации реагирующего вещества в единицу времени?
3.Дайте понятие кинетического уравнения. Какой вид имеет кинетическое уравнение для элементарной реакции, для сложной реакции?
4.Могут ли входить в кинетическое уравнение концентрации продуктов реакции, промежуточных веществ?
57
5.Что называется порядком реакции по данному веществу и общим по-
рядком?
6.Каков физический смысл константы скорости реакции? Какова размерность константы скорости?
7.Каков механизм гомогенного разложения перекиси водорода в присутствии ионов Cr2O72–
8.Выведите кинетическое уравнение реакции разложения перекиси водорода на основании предложенного механизма? Как графически определить константу скорости лимитирующей стадии и константу равновесия первой стадии?
9.Какая стадия является лимитирующей?
10.Каков порядок этой реакции, и от каких факторов он зависит?
11.Как провести графическое дифференцирование кинетической кривой?
12.Каким образом, зная объём выделившегося кислорода и условия, при которых он собран, рассчитать концентрацию перекиси водорода в растворе?
13.Почему при измерении объема кислорода уровень жидкости в уравнительной склянке и измерительной бюретке должен быть одинаковым?
14.Каким образом проверить герметичность установки?
15.Исходя из поставленной задачи, предложите план эксперимента?
Примечания
Порядок обработки кинетических кривых и дискриминации ошибочных значений
При обработке полученных экспериментальных результатов необходимо отбросить экспериментальные точки, в правильности которых существуют сомнения. В реакции гомогенного разложения перекиси водорода первые точки часто бывают ошибочны, что связано с рядом причин:
1)с неточностью измерения объема выделяющегося кислорода на начальном участке кинетической кривой;
2)с тем, что выделение кислорода в газовую фазу при плохом перемешивании осложняется диффузионным торможением.
Все это приводит к тому, что на начальном участке кинетической кривой появляется изгиб (рис. 20б). Поэтому точки 1,2,3 следует отбросить, так как кинетическая кривая для данной реакции не должна иметь перегибов. Корректный вид кинетической кривой для реакции разложения перекиси водорода представлен на рис. 20а.
58

Рис. 20. Кинетические кривые разложения перекиси водорода:
(а) в отсутствии диффузионных осложнений, (б) на начальном участке наблюдается снижение скорости образования кислорода.
59
3.3. Гидролиз сахарозы в кислой среде
Гидролитическое расщепление тростникового сахара протекает с образованием глюкозы и фруктозы:
С12H22O11 + H2O C6H12O6 + C6H12O6.
Гидролиз тростникового сахара (сахарозы) в нейтральном водном растворе практически не идет. Присутствие ионов водорода как катализатора ускоряет реакцию и делает ее доступной для наблюдения, причем скорость реакции пропорциональна концентрации ионов водорода в растворе. Инверсия сахарозы принадлежит к каталитическим реакциям кислотно-основного типа.
Кислотно-основной катализ делят на «специфический» и «общий». Наиболее важным является специфический кислотно-основной катализ, который осуществляется ионами водорода и гидроксила. Он широко распространен в органической химии: гидролиз эфиров, инверсия сахаров, этерификация кислот и спиртов. В сильнокислых растворах эти реакции катализируются только ио-
нами Н3О+.
Катализ, осуществляемый не только ионами гидроксония, но и веществами донорами и акцепторами протонов – кислотами и основаниями Бренстеда, например, H2O, NH3 и др. называется общим кислотно-основным катализом.
В случае гидролиза сахарозы имеет место специфический кислотный катализ.
Реакция инверсии сахарозы является реакцией псевдопервого порядка, и константа скорости инверсии может быть рассчитана по кинетическому уравнению реакции первого порядка.
k 1ln C0 , t Ct
где C0 – начальная концентрация сахарозы,
Ct – концентрация сахарозы в момент времени t.
Для объяснения роли иона водорода и кажущегося первого порядка был предложен следующий механизм инверсии сахарозы:
1) На первой стадии молекула сахарозы протонируется. Предполагается, что эта стадия протекает очень быстро и равновесие устанавливается мгновенно:
 .
.
2) Следующей стадией является гидролиз протонированных молекул сахарозы:
 .
.
Эта стадия является медленной и лимитирует скорость реакции в целом, т.е. скорость всей реакции гидролиза сахарозы равна скорости второй стадии.
W k3[(C12 H22O11 ) H3O ].
60
