
- •§ 33. Эргодическая гипотеза.
- •§ 34. Распределение Гиббса.
- •§ 35. Идеальный газ. Статистическое уравнение идеального газа.
- •§ 36. Распределение газовых молекул по энергии и скоростям (распределение Максвелла).
- •§ 37. Опытное определение скорости молекул.
- •§ 38. Распределение Больцмана. Барометрическая формула.
- •§ 39. Макроскопические системы в состоянии равновесия. Энергия системы.
- •§ 40. Энтропия. Закон возрастания энтропии.
- •§ 41. Теорема Нернста (третье начало термодинамики).
- •§ 42. Флуктуации. Распределение Гаусса. Влияние флуктуаций на предельную погрешность измерительных приборов.
- •Тема 7. Явления переноса.
- •§ 55. Диффузия.
- •§ 56. Теплопроводность.
- •§ 57. Внутреннее трение.
§ 39. Макроскопические системы в состоянии равновесия. Энергия системы.
Распределение Гиббса определяет вероятность обнаружить незамкнутую систему в состоянии с энергией Е. Оно включает произведение двух множителей: быстроубывающего exp(E/kT) и быстровозрастающего Г(Е). Произведение таких сомножителей имеет максимум в зависимости от Е.
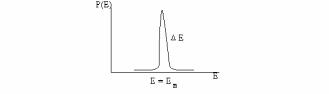


Ев - наиболее вероятная энергия. На самом деле пик очень узкий, следовательно, вероятность обнаружить систему в состоянии с энергией, отличной от Ев, очень мала. Состояние, которому отвечает максимум распределения, наиболее вероятно: оно вносит основную долю в средние значения величин, характеризующих макросистему. Например, средняя энергия
 (39.1)
(39.1)
Очевидно, что в состоянии с энергией Ев система проводит наибольшую часть времени. Системы, в которых истинные значения макровеличин близки к среднестатистическим, называются равновесными.
Изменение
среднего значения энергии
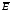 можно определить как
можно определить как
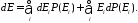 (39.2)
(39.2)
Слагаемое dEP(E)
правой части уравнения (39.2) следует
интерпретировать как вклад в
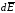 ,связанный с
изменением разрешенных уровней энергии
системы при неизменном распределении
вероятности соответствующих состояний.
Этот вклад отождествляют с работой
внешних сил над системой. Принято считать
работу положительной, если она совершается
системой над окружающими телами, поэтому
,связанный с
изменением разрешенных уровней энергии
системы при неизменном распределении
вероятности соответствующих состояний.
Этот вклад отождествляют с работой
внешних сил над системой. Принято считать
работу положительной, если она совершается
системой над окружающими телами, поэтому
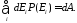 (39.3)
(39.3)
Второе слагаемое
отражает вклад в
 изменения вероятностей состояний при
E
- const. Изменение вероятности эквивалентно
изменению числа частиц в системе,
находящихся в состоянии с энергией Е;
такое изменение имеет место, если
меняется температура системы. Эту часть
изменения средней энергии системы
называют теплотой
(количеством
теплоты). Теплота
- часть энергии одной системы (например
термостата), переданная другой системе.
изменения вероятностей состояний при
E
- const. Изменение вероятности эквивалентно
изменению числа частиц в системе,
находящихся в состоянии с энергией Е;
такое изменение имеет место, если
меняется температура системы. Эту часть
изменения средней энергии системы
называют теплотой
(количеством
теплоты). Теплота
- часть энергии одной системы (например
термостата), переданная другой системе.
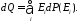
Таким образом, в соответствии с молекулярно-кинетической теорией, вместо равенства (39.2), имеем
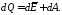
Это есть общий закон сохранения энергии (первое начало термодинамики): теплота, сообщаемая системе, тратится на изменение энергии (внутренней) системы и работу, совершаемую системой над окружающими телами.
Если рассматриваемая
система замкнута, то dQ =0, dA = 0, и,
следовательно,
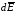 = 0, т.е. средняя энергия системы неизменна.
= 0, т.е. средняя энергия системы неизменна.
§ 40. Энтропия. Закон возрастания энтропии.
Как мы уже отмечали,
система находится большую часть времени
в микросостояниях с энергией, близкой
к наиболее вероятному значению Ев
. Очевидно, что отклонения энергии
системы от Ев
практически не выходят за интервал
 ,
соответствующий энергетической “ширине”
функции Р(Е) (см. рис . §39). Чем больше
,
соответствующий энергетической “ширине”
функции Р(Е) (см. рис . §39). Чем больше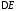 ,
тем большие отклонения может испытывать
энергия системы, а, следовательно, и
другие макровеличины, характеризующие
систему. Таким образом, величина
,
тем большие отклонения может испытывать
энергия системы, а, следовательно, и
другие макровеличины, характеризующие
систему. Таким образом, величина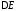 служит характеристикой состояния
системы.
служит характеристикой состояния
системы.
Вместо интервала
энергии ,
малого, как следует из изложенных ранее
соображений, состояние системы можно
характеризовать числом микросостоянийГ
,
малого, как следует из изложенных ранее
соображений, состояние системы можно
характеризовать числом микросостоянийГ

соответствующих “ширине” пика зависимости Р(Е). Величина Г - есть число микросостояний, которое соответствует одному и тому же макросостоянию с энергией Ев. Г - называется статистическим весом, а величина
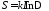
называется энтропией.
Чем больше Г, тем больше возможных микросостояний доступно системе, следовательно, тем больше неопределенность того, в каком микросостоянии находится система. Можно сказать, что энтропия есть мера неопределенности микросостояния системы. Если система состоит из двух подсистем (тел), статистические веса которых Г1 и Г2 , то вследствие мультипликативности статистический вес всей системы Г = Г1 + Г2, и тогда энтропия всей системы

Энтропия системы есть сумма энтропий входящих в нее подсистем; энтропия есть аддитивная величина. Понятие энтропии имеет смысл только для макроскопических систем, содержащих большое число частиц; бессмысленно, например, говорить об энтропии одного атома, молекулы.
Вернемся к понятию равновесного состояния. Равновесным является такое макросостояние системы, которое не имеет тенденции к изменению с течением времени.Ясно, что отсутствие такой тенденции будет сильнее всего выражено у наиболее вероятного из всех макросостояний. Вероятность состояния пропорциональна статистическому весу. Поэтому равновесное состояние изолированной системы можно определить как состояние, статистический вес которого максимален. Замкнутая система, выведенная из состояния равновесия и предоставленная сама себе, с течением времени возвращается в состояние полного равновесия. Этот переход сопровождается таким изменением макроскопического состояния, чтобы число соответствующих ему микросостояний увеличивалось.Итак, неравновесная замкнутая система непрерывно переходит из состояния с меньшей энтропией в состояние с большей энтропией, пока энтропия не достигнет максимального значения, соответствующего состоянию статистического равновесия. Это утверждение называется законом возрастания энтропии (вторым началом термодинамики).
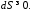
Закон возрастания энтропии можно интерпретировать и иначе: если в какой-то момент времени энтропия замкнутой системы имеет определенное значение, то в последующие моменты энтропия будет либо возрастать (переход от неравновесного состояния к равновесному состоянию), либо оставаться постоянной (равновесное состояние). Обратный ход событий, т.е. уменьшение энтропии в замкнутой системе, практически невероятен. Поэтому процессы, при которых энтропия замкнутой системы возрастает, называются необратимыми. Процессы, при которых энтропия сохраняется, могут идти и в обратном направлении и являются, следовательно, обратимыми. Отметим еще раз, что закон возрастания энтропии (точнее - не убывания) применим лишь к замкнутым системам. В незамкнутых системах энтропия может и убывать.
