
- •§ 33. Эргодическая гипотеза.
- •§ 34. Распределение Гиббса.
- •§ 35. Идеальный газ. Статистическое уравнение идеального газа.
- •§ 36. Распределение газовых молекул по энергии и скоростям (распределение Максвелла).
- •§ 37. Опытное определение скорости молекул.
- •§ 38. Распределение Больцмана. Барометрическая формула.
- •§ 39. Макроскопические системы в состоянии равновесия. Энергия системы.
- •§ 40. Энтропия. Закон возрастания энтропии.
- •§ 41. Теорема Нернста (третье начало термодинамики).
- •§ 42. Флуктуации. Распределение Гаусса. Влияние флуктуаций на предельную погрешность измерительных приборов.
- •Тема 7. Явления переноса.
- •§ 55. Диффузия.
- •§ 56. Теплопроводность.
- •§ 57. Внутреннее трение.
§ 35. Идеальный газ. Статистическое уравнение идеального газа.
Одним из объектов статистической физики является идеальный газ - совокупность частиц, слабо взаимодействующих между собой: средняя за большой отрезок времени энергия взаимодействия частицы с другими частицами много меньше средней собственной энергии частицы.
Не следует считать, что понятие идеального газа применимо лишь к газообразному состоянию вещества; это понятие гораздо шире. Так, колебания кристаллической решетки твердого тела под действием теплового возбуждения во многих случаях удовлетворяет модели идеального газа (газ фононов). Совокупность электронов проводимости в металлах или полупроводниках при некоторых условиях можно также рассматривать как идеальный (электронный) газ.
Чем слабее взаимодействие между частицами, тем ближе ансамбль частиц к идеальному газу. Наличие взаимодействия, однако, принципиально необходимо для установления статистического равновесия. Взаимодействие должно быть слабым лишь на столько, чтобы при расчетах, включающих собственные энергии частиц, энергией взаимодействия можно было бы пренебречь.
Основными макропараметрами идеального газа являются:
Объем V [м3] - часть пространства в которой двигаются газовые молекулы.
Давление Р =FnS н/м2 = Па - отношение силы Fn , перпендикулярной к площадке S, к размеру площадки.
Температура T K ] - параметр, физический смысл которого обсуждается далее.
Для характеристики масс атомов и молекул применяются величины, получившие название относительной атомной массы (атомная масса) и относительной молекулярной массы вещества (молекулярной массы).
Атомной массой химического элемента называется отношение массы атома этого элемента к 1 массы атома 12С углерода ( точнее изотопа углерода с массовым числом 12).
Молекулярной массой вещества называется отношение массы молекулы этого вещества к 1 массы атома углерода 12 С.
Количество вещества, в котором содержится число частиц ( атомов, молекул, ионов, электронов и т.д.), равное числу атомов в 0,012 кг изотопа углерода 12С, называется молем.
Число частиц, содержащихся в одном моле вещества, называется числом Авогадро. Опытным путем найдено, что
NA = 6,022 1023 моль .
Массу моля называют молярной массой .
Представим, что газ заключен в сосуд в форме прямоугольного параллелепипеда, стенки сосуда являются идеально отражающими (т.е. молекулы отскакивают от стенок под тем же углом, под которым они сталкиваются с ним; при этом абсолютные значения скоростей не меняются). Найдем давление газа на одну из граней, например АВСД.При отражении от грани АВСД любой, допустим, -й молекулы, имеющейсоставляющую скорости V x по оси х,грани передается импульс 2mV x ; m - масса молекулы. Между двумяпоследовательными столкновениямис гранью молекула двигается как свободная и возвращается к грани через время t=2L/V x.Следовательно, за 1 скаждая молекула сталкивается с рассматриваемой гранью V x 2Lраз и передает ей импульс 2mV x (V x2L) = mV x2L. Результирующая сила Fx , действующая на стенку, по второму закону Ньютона равна импульсу, полученному стенкой за 1 секунду от всех N молекул газа
 (35.1)
(35.1)
Все направления по отношению к газу равноценны, поэтому длябольшого N
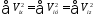 (35.2)
(35.2)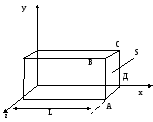
Также имеем
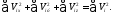
Откуда с учетом (37.2) получаем
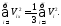 (35.3)
(35.3)
Определим среднюю
квадратичную (квадратическую)
скорость
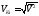 соотношением
соотношением
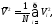
иначе
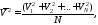
тогда, из (35.1) получаем

C учетом того, что LS = V, a Fx = p S, окончательно получаем
 (35.4)
(35.4)
где n0 = N/V - плотность (концентрация) молекул. Величина
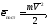 (35.5)
(35.5)
есть средняя кинетическая энергия поступательного движения молекул, поэтому
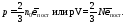 (35.6)
(35.6)
Уравнение (35.6) называется основным уравнением молекулярно-кинетической теории идеального газа: давление газа равно двум третьим плотности энергии поступательного движения молекул. Это уравнение носит универсальный характер - в него не входят величины, которые бы зависели от природы газа. Действительно, при обосновании уравнений газ был лишен каких-либо “индивидуальностей”.
С другой стороны, опытное уравнение состояния идеального газа - уравнение Менделеева-Клайперона.
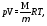 (35.7)
(35.7)
где М - масса газа, R = 8,31 джмоль К - газовая постоянная.
Представляя М =mN и = m NA, имеем
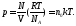 (35.8)
(35.8)
Сопоставляя уравнения (35.6) и (35.8), относящиеся к одному объекту - идеальному газу, находим
 (35.9)
(35.9)
Следовательно,
энергия
 определяется только температурой газа;
она не зависит от массы молекул, их
структуры и других факторов. Вместе с
тем, это соотношение дает одно из
статистических определений температуры
(здесь - молекулярно-кинетическое):
температура есть мера средней энергии
поступательного движения молекул (в
классической теории - не только
поступательного, но и других движений,
например, вращательного, колебательного).
определяется только температурой газа;
она не зависит от массы молекул, их
структуры и других факторов. Вместе с
тем, это соотношение дает одно из
статистических определений температуры
(здесь - молекулярно-кинетическое):
температура есть мера средней энергии
поступательного движения молекул (в
классической теории - не только
поступательного, но и других движений,
например, вращательного, колебательного).
Зная температуру газа из (35.5) и (35.9) , получаем для средней квадратичной скорости
 (35.10)
(35.10)
В действительности молекулы имеют различные скорости, как большие, так и меньшие квадратичной. Распределение молекул по скоростям впервые установлено Д.Максвеллом.
