
Биомедицина теория
.pdfвые повреждения). В долгосрочном плане стволовые клетки – это аппарат клеточного гомеостаза, основанного на постоянном самообновлении клеток, смены устаревших, отработанных клеток с целью защиты от болезней (накопления аномальных клеток) и преждевременного старения. На поверхности СК располагаются специфические рецепторы, чувствительные к различным веществам (цитокинам), выделяющимся в местах повреждений. Уникальность и универсальность механизма репарации заключается в том, что СК сами находят дорогу к местам повреждений в организме.
Поскольку с возрастом количество стволовых клеток становится все меньше, и, соответственно, восстановительные возможности организма снижаются, то замедляются процессы регенерации. В результате страдает способность ткани к физиологической регенерации и к восстановлению после болезни или травмы.
Дисбаланс количества/активности самообновления клонов стволовых клеток в паренхиме/мезенхиме органов является первопричиной многих патологий на клеточном уровне. Возрастные изменения органов, кожных покровов, костно-мышечной, эндокринной, иммунной, сосудистой систем связаны с исчерпанием пула или дисфункцией стволовых пространств.
Тем не менее, пока жив человек, живы его стволовые клетки, их можно выделить и вырастить и у очень пожилых людей. Конечно, у здоровых и молодых людей стволовых клеток, как правило, больше, но тенденция эта не абсолютна. Состояние СК зависит от состояния здоровья, образа жизни, а не только от возраста.
Исторически сложилось, что первые СК были обнаружены в костном мозге, поэтому долгое время и считалось, что именно костный мозг содержит едва ли не все СК организма. Позже их обнаружили в жире, коже, мышцах, печени, легких, сетчатке глаза, практически во всех органах и тканях организма.
В литературе последних лет появляется все больше сообщений о пластичности стволовых клеток, которую рассматривают не только как способность последних дифференцироваться в разные типы клеток на разных этапах развития, но и подвергаться дедифференцировке (трансдифференцировке, ретродифференцировке). То есть, допускается принципиальная возможность возвращения соматической дифференцированной клетки на этап эмбрионального развития с рекапитуляцией (возвратом) плюрипотентности и ее реализации в повторную дифференцировку с образованием клеток иного типа. Сообщается, в частности, что гемопоэтические стволовые клетки (ГСК) способны трансдифференцироваться с образованием гепатоцитов, кардиомиобластов и эндотелиоцитов.
Научные дебаты относительно разделения стволовых клеток по их пластичности продолжаются, то есть, терминология и глоссарий клеточной
61
трансплантации находятся в процессе становления, что имеет непосредственное практическое значение, поскольку именно на использовании пластических свойств и способности стволовых клеток к дифференцировке в различные клеточные линии основано большинство методов регенеративно-пластической медицины.
Основные группы стволовых клеток
В зависимости от источника получения стволовые клетки подразделяют на: эмбриональные, фетальные и постнатальные (стволовые клетки взрослого организма) (рис. 19). В свою очередь стволовые клетки взрослого организма можно подразделить на три основных группы: гемопоэтические (кроветворные), мультипотентные мезенхимальные (стромальные) и тканеспецифичные прогениторные клетки.
Иногда в отдельную группу выделяют клетки пуповинной крови, поскольку они являются наименее дифференцированными из всех клеток зрелого организма, то есть обладают наибольшей потентностью. Пуповинная кровь в основном содержит гемопоэтические стволовые клетки, а также мезенхимальные, но в ней присутствуют малые количества других разновидностей стволовых клеток, при определённых условиях способных дифференцироваться в клетки различных органов и тканей.
Отличие эмбриональных и мезенхимальных стволовых клеток заключается в том, что первые могут быть получены на ранней стадии развития эмбриона человека (из внутренней массы бластоцисты – оплодотворенной яйцеклетки – или из зачатков половых органов на самых ранних этапах развития, буквально в первые дни), а вторые встречаются в течение всей жизни человека во всех его органах и тканях. Эмбриональные стволовые клетки значительно активнее мезенхимальных, обладают более высокой способностью размножения, большим потенциалом дифференцировки. Гемопоэтические клетки – предшественники клеток крови. Они встречаются в кровеносном русле, в отличие от мезенхимальных, которые в крови циркулируют только при серьезных повреждениях организма. Фетальные стволовые клетки получают из абортивного материала. Во многих странах применение этих клеток запрещено по морально-этическим соображениям.
Стволовые клетки
Эмбриональные |
Фетальные |
Региональные |
|
|
стволовые клетки |
|
|
взрослого |
Рис. 19. Классификация стволовых клеток по источнику их получения
62
Потентность стволовых клеток
В основу современной классификации стволовых клеток положен принцип их разделения по способности (потентности) давать начало клеточным линиям, которая определяется как тоти-, плюри-, мульти-, поли-, би- и унипотентность. Тотипотентностью, то есть, способностью воссоздавать запрограммированный генетически организм в целом, обладают клетки зиготы, бластомеры и эмбриональные стволовые клетки (клетки внутренней массы бластоцисты). Еще одна группа тотипотентных клеток, которые образуются на более поздних сроках развития эмбриона, представлена первичными герменативными клетками эмбриональной половой зоны (половых бугорков). Плюрипотентность, под которой понимают способность дифференцироваться в клетки любого органа или ткани, присуща эмбриональным клеткам трех зародышевых листков – экто-, мезо- и энтодермы. Считается, что мультипотентность, то есть способность образовывать любые клетки в пределах одной специализированной линии, свойственна лишь двум типам клеток: так называемым мезенхимальным стволовым клеткам, которые образуются в нервном гребне и являются предшественниками всех клеток соединительнотканной основы организма, в том числе и клеток нейроглии, а также гемопоэтическим кроветворным стволовым клеткам, дающим начало всем линиям клеток крови. Кроме того, выделяют би- и унипотентные стволовые клетки, в частности, клеткипредшественники миелоидного, лимфоидного, моноцитарного и мегакариоцитарного кроветворных ростков. Существование унипотентных стволовых клеток четко доказано на примере клеток печени – утрата значительной части печеночной ткани компенсируется за счет интенсивного деления дифференцированных полиплоидных гепатоцитов.
Эмбриональные стволовые клетки
Выделение эмбриональных стволовых клеток и их свойства
Эмбриональные стволовые клетки образуют внутреннюю клеточную массу, или эмбриобласт, на ранней стадии развития эмбриона. Они являются плюрипотентными. Важный плюс ЭСК состоит в том, что они не экспрессируют HLA (human leucocyte antigens), то есть не вырабатывают антигены тканевой совместимости. Каждый человек обладает уникальным набором этих антигенов, и их несовпадение у донора и реципиента является важнейшей причиной несовместимости при трансплантации.
Первые работы по выделению ЭСК были выполнены Эвансом в 1981 году, показавшим, что бластоцисты, имплантированные в мозг мышей, дают начало тератокарциномам, клетки которых при клонировании формируют линии плюрипотентных эмбриональных стволовых клеток (первоначальное наименование этих клеток – embryonal carcinoma cells или в аббревиатуре ECC – в настоящее время не применяется). Эти данные были подтверждены в ряде других исследований, в которых ЭСК получали
63
при культивировании клеток бластоцист мышей и животных иных видов, а также человека.
В1998 г. Джон Герхарт (Университет Джона Гопкинса, Балтимор, США) впервые изолировал бессмертные линии половых прогениторных клеток из полового зачатка фетусов 4–5-й недели развития. В том же году Джеймс Томсон (Висконсинский университет, США) изолировал 5 линий ЭСК из замороженных бластоцист человека, оставшихся неиспользованными после суперовуляции и получения оплодотворенных яйцеклеток с целью беременности.
Следует отметить, что выделение линий ЭСК возможно лишь на определенных стадиях эмбриогенеза.
ВНациональном институте здоровья США на основании обобщения существующих сведений о методах выделения линий ЭСК человека из бластоцисты было сделано предварительное заключение о том, что успешное выделение ЭСК наиболее вероятно при культивировании бластоцист с хорошо сформированной внутренней клеточной массой (Stem cells: scientific progress and future research directions. Nat. Inst, of Health USA). С этой точки зрения, оптимальным источником ЭСК для создания линий являются бластоцисты человека 5-го дня развития, из которых при выделении внутренней клеточной массы следует тщательно удалять трофэктодерму. Изолированную внутреннюю клеточную массу, состоящую на этой стадии из 30–35 клеток, необходимо культивировать на подложке эмбриональных мышиных фибробластов, что является решающим условием для образования в культуре колоний ЭСК.
Доказано, что эмбрион в течение первых 6 дней растет и превращается
вшарик из одинаковых неспециализированных клеток, а затем превращается в бластоцисту. Сама же бластоциста состоит из сферического (наружного) слоя клеток. Этот слой окружает полость, наполненную жидкостью и CК (рис. 20). Разрушая бластоцисту из этой полости, собирают CK. Затем эти клетки размножают в лаборатории в целый ряд специализированных клеток. Таким образом, основным источником сырья для получения лабораторных соматических клеток являются клоны ЭCK, выделенные из бластоцист человека. Часть наиболее быстро растущих клонов переводят в линию ЭCK. Затем начинается многоэтапная дифференцировка клеток в нейроны, кардиомиоциты, клетки кроветворения, эпителий тонкой кишки или эпителий эндокринных желез (производные экто-, мезо- и эндодермы) и другие клеточные типы. Дифференцировка ЭСК в указанные соматические клетки идет в обход гаструляции и без образования 3 зародышевых листков.
Вторым источником ЭСК является половой зачаток плодов (фетусов) 4–5-й недели развития или половые клетки.
Сохранение плюрипотентности и стабильности генома линий ЭСК достигается только при соблюдении достаточно жестких условий их
64
культивирования. Так, например, обязательным является присутствие в среде культивирования LIF (лейкозингибирующего фактора), а для сохранения стабильности генома ЭСК и наиболее ранних прогениторных клеток, локализованных в ядре клона, в среду необходимо добавлять LIF, SCF (факторы стволовых клеток) и IL-6 (интерлейкин 6). Фактически все линии ЭСК из бластоцисты, длительно сохраняющие нормальный кариотип и высокую активность теломеразы, были получены из разных клонов.
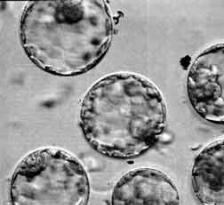
Рис. 20. Впервые во внутриутробном развитии человека эмбриональные стволовые клетки появляются на 5–7-й день после оплодотворения. Они образуют комочек внутри бластоциста – шарика, состоящего
из 140 клеток. На снимке показаны бластоцисты человека, полученные путем оплодотворения в пробирке (В. Репин, 2002 г.)
Открытие ЭСК не дало ответа на вопрос о том, что именно и как именно запускает программы эмбриогенеза, зашифрованные в ДНК зиготы. Остается неясным, как разворачивается программа генома в процессе жизни человека. Вместе с тем изучение ЭСК позволило разработать концепцию о механизмах сохранения тоти-, плюри- и мультипотентности стволовых клеток в процессе их деления. Главной отличительной чертой стволовой клетки является ее способность к самовоспроизводству. Это означает, что стволовая клетка, в отличие от дифференцированной, делится асим-метрично: одна из дочерних клеток дает начало специализированной клеточной линии, а вторая сохраняет тоти-, плюриили мультипотентность генома. Оставалось непонятным, почему и как этот процесс происходит на самых ранних стадиях эмбриогенеза, когда делящаяся внутренняя клеточная масса бластоцисты вся является тотипотентной, а геном ЭСК находится в дормантном (спящем, заторможенном) состоянии. Если при делении обычной клетки процессу дупликации обязательно предшествует активация и экспрессия целого комплекса генов, то при делении ЭСК этого не происходит. Ответ на вопрос «почему» был получен после открытия в ЭСК предсуществующих мРНК (премРНК), часть которых образуется еще в фолликулярных клетках и сохраняется в цитоплазме яйцеклетки и зиготы. Второе открытие ответило на вопрос «как»: в ЭСК были обнаружены особые ферменты, получившие
65

название «эдитазы». Эдитазы выполняют три важнейшие функции. Вопервых, они обеспечивают альтернативное эпигенетическое (без участия генома) считывание и дупликацию пре-мРНК. Во-вторых, реализуют процесс активации пре-мРНК (сплайсинг – вырезание интронов, то есть, неактивных участков РНК, тормозящих процесс синтеза белка на мРНК), после чего в клетке начинается сборка белковых молекул. В-третьих, эдитазы способствуют образованию вторичных мРНК, являющихся репрессорами механизмов генной экспрессии, что сохраняет плотную упаковку хроматина и неактивное состояние генов. Белковые продукты, синтезированные на таких вторичных мРНК и получившие название белков-сайленсеров или хранителей генома, присутствуют в яйцеклетках человека.
Эмбриональные стволовые клетки могут принять любую программу и превратиться в любой тип клетки (рис. 21). Удивительная способность эмбриональной стволовой клетки стать любой клеткой организма продиктована наличием в ней избытка РНК всех генов, отвечающих за рост зародыша на ранней стадии развития эмбриона. Это означает, что основной функцией стволовой клетки является перенос мРНК в следующее клеточное поколение.
Один из основных источников получения стволовых клеток в настоящее время – эмбриональные ткани. Подавляющее большинство публикаций последнего времени посвящено именно эмбриональным стволовым клеткам как наиболее многообещающим для развития клеточных технологий.
Рис. 21. Схема получения «запчастей» из эмбриональных стволовых клеток. После оплодотворения яйцеклетка начинает делиться и дает сначала 2, потом 4, а затем и 140 клеток, образующих шарик-бластоцист. Его наружную оболочку разрушают вручную (микроманипулятором) или ферментами, получая стволовые клетки. Обеспечивая их содержание в клеточной культуре, клетки можно размножать и вызывать превращение в специализированные клетки организма – нервные, мышечные, печеночные, кожные и т. д., которые затем пересаживают больному взамен таких же отмерших или заболевших его собственных клеток (В. Репин, 2002 г.)
66
Характеристики эмбриональных стволовых клеток
1) Плюрипотентность – способность образовывать любую из примерно
350типов клеток организма (у млекопитающих).
2)Хоуминг – способность стволовых клеток, при введении их в организм, находить зону повреждения и фиксироваться там, исполняя утраченную функцию.
3)Факторы, которые определяют уникальность стволовых клеток, находятся не в ядре, а в цитоплазме – это избыток мРНК всех 3 тысяч генов, которые отвечают за раннее развитие зародыша.
4)Теломеразная активность.
При каждой репликации часть теломер утрачивается (лимит Хейфлика). В стволовых, половых и опухолевых клетках есть теломеразная активность, концы их хромосом надстраиваются, то есть эти клетки способны проходить потенциально бесконечное количество клеточных делений, они бессмертны.
Изучение возможностей эмбриональных стволовых клеток для применения в медицинской практике
Практически безграничные регенеративные возможности ЭСК обусловлены тем, что их геном, в отличие от генетического аппарата дифференцированных соматических клеток, сохраняет плюрипотентность. Благодаря этому открываются широкие перспективы их практического использования в биологии и медицине, в первую очередь в трансплантологии, иммунологии и геронтологии.
Уникальный биологический потенциал ЭСК как единственных клеток, в которых программы развития развернуты в полном объеме последовательной реализации, находит применение в исследованиях по изучению функции генов. С помощью ЭСК проводится расшифровка первых комбинаций сигналов, активирующих экспрессию ранних и поздних генов, кодирующих развитие трех зародышевых листков. Сохранение плюрипотентности генома ЭСК in vitro делает их уникальным инструментом для репаративной регенерации, способным в автоматическом режиме восполнять клеточные потери при повреждении органов и тканей.
Вслед за разработкой приемов монодифференцировки ЭСК началось изучение in vivo функциональной активности клеток, полученных in vitro из одного специализированного клона. Пролиферирующий клон ЭСК генерирует популяции мигрирующих прогениторных клеток, действительно способных активно встраиваться в зоны повреждения тканей реципиента, что и используется в регенеративно-пластической медицине. Установлено, что трансплантация дофаминовых нейронов в substantia nigra (составная часть экстрапирамидной системы, находящейся в области четверохолмия среднего мозга) уменьшает клинические проявления при эксперимен-
67
тальном гемипаркинсонизме. Региональные пересадки донорских нейральных стволовых клеток снижают степень двигательных нарушений, вызванных травмой или контузией спинного и головного мозга. Получены
ипервые положительные результаты трансплантации стволовых клеток при демиелинизирующих заболеваниях. Казалось бы, что регенеративнопластические потенции ЭСК открывают неограниченные возможности для использования клеточной трансплантации в практической медицине. Однако при пересадке в эктопические зоны ЭСК неизбежно трансформируются в опухоли. При подкожном введении ЭСК у иммунодефицитных мышей образуются тератомы. При пересадке взвеси ЭСК под капсулу семенника у сингенных мышей также происходит формирование тератом, состоящих из разных тканей, клетки которых являются производными всех трех зародышевых листков. В таких тератомах крайне редко осуществляются процессы редуцированного органогенеза.
Клеточная нейротрансплантация с использованием производных ЭСК получает дальнейшее развитие в эксперименте и первых клинических испытаниях по коррекции функциональных нарушений при мозговой и спинальной травмах, лечению сирингомиелии и рассеянного склероза. С появлением техники нейроногенеза из ЭСК in vitro вместо использования ткани эмбрионального мозга разрабатываются методы трансплантации производных нейросфер, полученных из культур эмбриональной нервной ткани. Такие трансплантационные суспензии значительно более гомогенны
исодержат коммитированные предшественники нейронов и нейроглии.
Уживотных с экспериментальными моделями локальных дефектов ЦНС нейротрансплантация уменьшает клинические проявления такой патологии человека, как последствия черепно-мозговой травмы, инсульта, демиелинизирующих заболеваний, наследственных дефектов развития мозжечка, болезней отложения липидов и полисахаридов.
Для оптимизации процессов регенерации при дегенеративных заболеваниях ЦНС разрабатываются технологии получения из ЭСК миелинпродуцирующих олигодендроцитов.
Определенные перспективы открываются для использования производных ЭСК с целью разработки методов коррекции иммунодефицитов, вызванных генетическими дефектами созревания тимуса. Проводятся клинические испытания трансплантации преформированных in vitro ЭСК для лечения фатальных наследственных анемий у детей.
Таким образом, в литературе появляется все больше данных о позитивном терапевтическом эффекте трансплантации производных эмбриональных стволовых клеток человека. Однако многие из таких работ подвергаются пересмотру и критике. Некоторые исследователи полагают,
68
что результаты ранних клинических испытаний имеют характер предварительных и свидетельствуют лишь о том, что стволовые клетки способны оказывать благоприятное воздействие на клиническое течение того или иного заболевания. Поэтому необходимо получить данные об отдаленных результатах клеточной трансплантации. В качестве аргумента приводятся этапы развития клинической нейротрансплантологии. Действительно, в литературе поначалу преобладали публикации о высокой эффективности пересадки фрагментов мозга эмбрионов при болезни Паркинсона, но затем начали появляться сообщения, отрицающие лечебную эффективность эмбриональной или фетальной нервной ткани, пересаженной в мозг больных.
Национальный институт здоровья США провел независимое исследование клинической эффективности нейротрансплантации у больных паркинсонизмом. Пациентам первой группы пересаживали участки эмбриональной нервной ткани, вырабатывающие дофамин, тогда как второй группе больных делали ложную операцию. Результаты свидетельствуют о нулевой клинической эффективности такой нейротрансплантации, несмотря на то, что дофаминпродуцирующие эмбриональные нейроны выживали в мозге реципиентов. Более того, через 2 года после пересадки эмбриональной нервной ткани у 15 % пациентов развилась персистентная дискинезия, отсутствующая у больных группы плацебо (Stem cells: scientific progress and future research directions. Nat. Inst, of Health. USA).
Некоторые авторы связывают противоречивость литературных данных по оценке клинической эффективности нейротрансплантации с разным подходом к подбору групп больных, неадекватным выбором методов объективной оценки их состояния, а, главное, разными сроками развития эмбриональной нервной ткани и разными участками мозга, из которых эту ткань получали, разными размерами трансплантата и методическими особенностями операционного вмешательства.
Эксперты Национальной и Медицинской академий США, специалисты Национального института здоровья США считают, что клинический потенциал ЭСК заслуживает самого серьезного внимания, однако настаивают на необходимости детального изучения их свойств, вероятности осложнений и отдаленных последствий в опытах на адекватных биологических моделях заболеваний человека (Stem cells and the future regenerative medicine National Academy Press.; Stem cells and the future research directions. Nat. Inst, of Health USA).
Тем не менее, при решении всех перечисленных проблем, ЭСК остаются достаточно перспективным, многообещающим материалом, который в настоящее время требует дальнейшего, более глубокого исследования. Ре- генеративно-пластические технологии, основанные на клеточной транс-
69
плантации, являются точкой пересечения интересов представителей клеточной биологии, биологии развития, экспериментальной генетики, иммунологии, неврологии, кардиологии, гематологии и многих других отраслей экспериментальной и практической медицины. Наиболее важны результаты экспериментальных исследований, доказывающие возможность перепрограммирования стволовых клеток с направленным изменением их свойств, что открывает перспективы для управления процессами цитодифференцировки с помощью факторов роста – для регенерации миокарда, восстановления поражений ЦНС и нормализации функции островкового аппарата поджелудочной железы. Однако для широкого внедрения трансплантации производных ЭСК в практическую медицину необходимо более детально исследовать свойства стволовых клеток человека и продолжить опыты с ЭСК на экспериментальных моделях заболеваний.
Источником получения ЭСК для применения в медицинских целях остается эмбрион человека, что предопределяет неизбежность нового пересечения моральных, этических, нравственных, юридических и религиозных проблем в точке зарождения человеческой жизни. Открытие ЭСК дало мощный толчок к возобновлению жестких дискуссий о том, где проходит грань между живыми клетками и веществом, существом и личностью. Клинические исследования с использованием ЭСК подвергаются особой этической экспертизе. Во многих странах исследования ЭСК ограничены законодательством.
Также одним из главных недостатков ЭСК является невозможность использования аутогенного, то есть собственного материала, при трансплантации, поскольку выделение ЭСК из эмбриона несовместимо с его дальнейшим развитием.
Фетальные стволовые клетки
Фетальные стволовые клетки (ФСК) получают из плодного материала после аборта (обычно срок гестации, то есть внутриутробного развития плода, составляет 9–12 недель). ФСК гораздо быстрее делятся и более пластичны, чем другие клетки организма. Если по каким-то причинам невозможно использовать собственные клетки пациента, то в качестве донорских гораздо больше подходят ФСК, чем чужие взрослые CK, потому что антигены гистосовместимости у них выражены очень слабо и реакция отторжения маловероятна.
Однако, изучение и использование такого биоматериала также порождает этические проблемы. Работы с фетальными стволовыми клетками в России сегодня ограничены научными исследованиями, их клиническое применение не имеет юридической базы. Более широко и официально сегодня эти клетки применяются в Китае и некоторых странах Азии. На Украине и в Великобритании также продолжаются работы по их изучению и кли-
70
