
Биомедицина теория
.pdf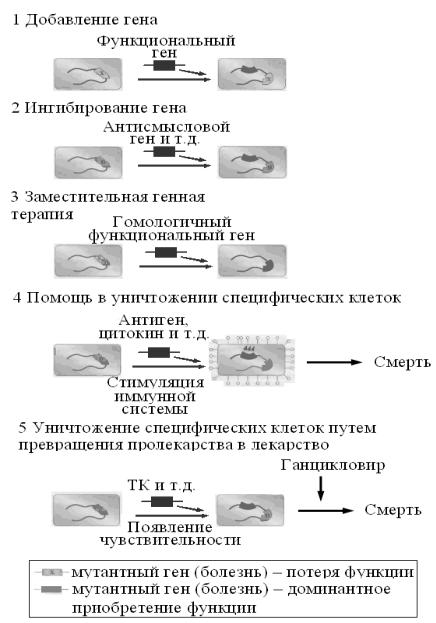
однако он основан на гомологичной рекомбинации, которая в большинстве клеток протекает с крайне низкой эффективностью.
– Уничтожение специфических клеток. Этот метод терапии пригоден для лечения болезней (таких, как рак), которые можно лечить путем устранения определенных популяций клеток. Основная задача этой терапии – экспрессировать внутри таких клеток ген-самоубийцу, продукт которого токсичен. Один из подходов – экспрессия белка – делает клетки уязвимыми для атаки иммунной системы. Другой подход включает экспрессию фермента, который превращает безвредное вещество (пролекарство) в более токсичное соединение. Из-за летального эффекта, вызываемого генамисамоубийцами, их действие должно быть с особой тщательностью направлено на целевые клетки, чтобы избежать побочных эффектов.
Рис. 1. Обзор методов генной терапии
11
3) по тактике введения генотерапевтического агента (по пути доставки генов):
•ex vivo ( клетки крови)
•in situ (локально)
•in vivo (системное введение)
•in utero (введение конструкций в эмбрион)
Наиболее распространены из них генная терапия ex vivo и in vivo. Генетические болезни обычно проявляются в специфических популя-
циях клеток. Иногда, как в случае рака, это происходит из-за того, что вызывающая болезнь мутация присутствует во всех клетках, но эффект ограничен лишь теми клетками, где этот ген экспрессируется (или где нормальная экспрессия гена утрачена). Выбор метода доставки ДНК при генной терапии, следовательно, зависит в значительной степени от доступности соответствующих клеток.
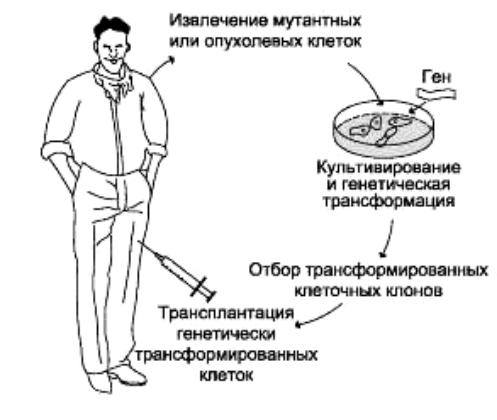
Рис. 2. Схематическое представление генной терапии ex vivo. Процедура включает: 1) получение от пациента клеток с генным дефектом;
2) культивирование изолированных клеток; 3) трансфекцию «терапевтической» генной конструкции в изолированные клетки; 4) отбор, выращивание и тестирование трансфицированных клеток;
5) трансплантацию или трансфузию трансфицированных клеток пациенту
12
Если есть возможность извлечь и культивировать клетки, не нанося вред пациенту, то их можно генетически модифицировать в культуре, а затем снова ввести в организм пациента (рис. 2). Такой подход, называемый генная терапия ex vivo, применим для лечения заболеваний крови и иммунной системы, поскольку гемопоэтические стволовые клетки относительно легко можно извлекать, культивировать и видоизменять. Более того, будучи введенными обратно в организм пациента, они сохраняются в течение длительного времени и, следовательно, могут дать неограничеснное число (генетически модифицированных) дочерних клеток. Генная терапия ex vivo позволяет тщательно контролировать целевые клетки в культуре, так что можно отобрать клетки с нужным типом генетической модификации. Данный метод использовался при проведении успешных клинических испытаний по генотерапии SCID, X-SCID и других наследственных заболеваний иммунной системы.
В случае недоступных клеток или клеток, которые невозможно эффективно культивировать, генная терапия включает прямое введение ДНК в клетки, находящиеся в организме (рис. 3). Такой подход называется генной терапией in vivo. При этом система доставки гена должна быть эффективной и селективной для конкретного типа клеток-мишеней. Это особенно важно, если задачей является уничтожение данных клеток. Этот метод лечения был апробирован для лечения муковисцидоза, к развитию которого приводят нарушения в гене трансмембранного регуляторного белка (CFTR, от англ. cystic fibrosis transmembrane regulator). Особенно перспективным для лече-
ния генных болезней in vivo представляется введение генов с помощью аэрозольных или инъецируемых вакцин. Аэрозольная генотерапия разрабатывается, как правило, для лечения пульмонологических заболеваний, таких как муковисцидоз, энфизема, рак легких, при которых объектами генетической модификации являются специфические типы легочных клеток.
К настоящему времени разработаны разнообразные вирусные и невирусные векторные системы доставки «терапевтических» генов, учитывающие большое число потенциальных тканей-мишеней (кожа, мышцы, легкие, мозг, толстая кишка, селезенка, печень, клетки крови) и расположение их в организме человека. «Идеальная» система доставки должна обеспечивать высокую эффективность поглощения «терапевтического» гена клеткамимишенями, минимальность его внутриклеточного разрушения при транспорте в ядро и поддержание уровня экспрессии, достаточного для облегчения состояния больного.
13
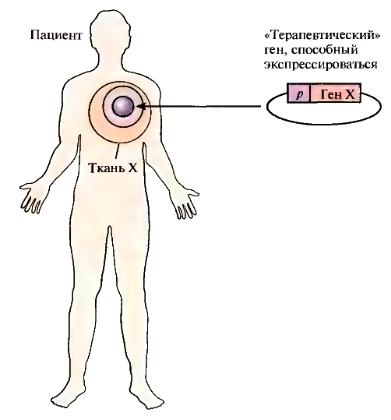
Рис. 3. Схематическое представление генной терапии in vivo. Клонированный «терапевтический» ген (ген X) кодирует белок, корректирующий генетический дефект. Этот ген доставляется к клеткам определенной ткани пациента с наследственным заболеванием и экспрессируется в них. Промотор р,
под контролем которого осуществляется транскрипция, тканеспецифичен
4) по типу векторной системы (по механизму доставки генов):
•вирусные системы доставки
•невирусные системы доставки
•трансфекция
•микроинъекция
•«gene gun» (генный пистолет)
•липосомы и др.
Проблема эффективной доставки генов в ткани организма с целью получения правильной дозы необходимого белкового продукта, обладающего терапевтическим эффектом, продолжает оставаться одной из центральной проблем генной терапии. Главным условием успешной генотерапии является обеспечение эффективной доставки, т.е. трансфекции (в широком смысле) или трансдукции (при использовании вирусных векторов) чужеродного гена в клетки-мишени, обеспечение длительной персистенции его в этих клетках и создание условий для полноценной работы, т.е. экспрессии. Таким образом, кроме общей стратегии доставки генов, необходимо рассмот-
14
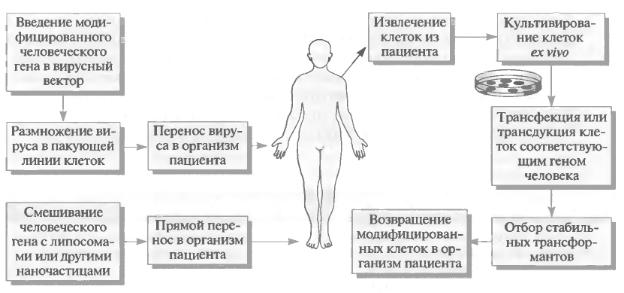
реть механизм введения нуклеиновых кислот в клетку. В настоящее время для этого используют самые разные методы – физические, химические, биологические. Механизмы переноса генов, используемые в генной терапии, могут быть вирусные и невирусные (рис. 4).
Рис. 4. Подходы генной терапии. Слева – принцип генной терапии in vivo с использованием вирусного и невирусного векторов. Справа – принцип генной
терапии ex vivo с использованием вирусного и невирусного векторов
Вирусная доставка, известная также как трансдукция, включает упаковку ДНК (или в некоторых случаях РНК) в вирусную частицу. Перенос генов осуществляется путем нормальной вирусной инфекции, и потому эффективен и селективен по отношению к клеткам. По этой причине доставка с помощью вирусов наиболее предпочтительна при генной терапии in vivo. Сравнение различных вирусов, используемых или разрабатываемых в качестве векторов для генной терапии, приводится ниже.
Важно помнить, что по своей природе вирусы патогенны. Все негативные последствия генной терапии были вызваны по существу высокой дозой вируса, который или сам по себе вызывал отрицательную реакцию или, интегрируя в геном человека, активировал онкогены. Два случая развития лейкемии были зарегистрированы у детей, которые были больны сцепленным с Х-хромосомой иммунодефицитом. Тем не менее, дальнейшие испытания остановлены не были по требованию родителей детей, получающих лечение. Генная терапия в данном случае была единственным видом терапии, дающим надежду на жизнь, а вероятность интеграции достаточно мала, тем более что лейкемия у детей поддается лечению. В то же время не следует забывать мудрую фразу Гиппократа, который утверждал, что яд – это всего лишь вопрос дозы.
15
Поэтому необходимо принять меры, чтобы при использовании их в качестве векторов они не могли вызвать заболевания. Обычный способ достижения этой цели – удаление генов и получение вирусов с нарушенной репликацией – подход, который, ко всему прочему, увеличивает способность вирусов удерживать чужеродную ДНК. Для получения больших количеств таких дефектных вирусов недостающие функции должны быть получены из другого источника. Это подразумевает использование вируса-помощника, компенсирующего отсутствие генов, но чаще всего используется пакующая линия клеток, т.е. клеточная линия, которая стабильно трансформирована необходимыми вирусными генами. Как только ДНК упакована, дефектный вирус может быть выделен из пакующей линии. Он способен инфицировать клетку-мишень и вводить в
нее чужеродную ДНК или РНК, но не может реплицироваться и вызывать симптомы болезни. При создании пакующих линий должны быть приняты меры предосторожности, чтобы избежать рекомбинации между дефектными вирусами и генами, обеспечивающими вспомогательные функции, в противном случае могут возникать способные к репликации вирусы.
Таким образом, вирусные системы имеют целый ряд положительных и негативных свойств.
Достоинства:
•трансфекция большого количества клеток
•тропизм
•неспособность реплицироваться в клетке-хозяине
•устойчивость к деградации лизосомами
Недостатки:
•иммуногенность (аденовирусы, герпесвирусы)
•потенциальная туморогенность (ретровирусы)
Невирусные методы доставки генов считаются более безопасными,
чем вирусные. Они включают трансфекцию (клетки заставляют поглощать ДНК из окружающей среды, например, способом электропорации) и прямой перенос (ДНК вводится в клетки физическим путем, например, инъекцией). ДНК не упаковывается в вирусный вектор, а часто присутствует в составе плазмиды. В некоторых случаях плазмида сконструирована таким образом, что не способна реплицироваться в человеческих клетках, и тогда единственный путь достижения долгосрочной экспрессии – стабильная интеграция ДНК в геном. Это очень редкое событие (стабильно трансформируется менее одной клетки на миллион), так что редкие клетки должны быть отобраны путем введения маркерного гена в трансформирующую ДНК, что дает возможность клеткам расти в присутствии такого вещества как антибиотик, токсичный для нетрансформированных клеток.
16
Очевидно, что этот подход может быть применен только к клеточной культуре.
Прямой перенос некомпактизованной («голой») плазмидной ДНКконструкции в клетки животных in vivo явился одним из первых подходов в генной терапии.
В 1992 году Вольфом с соавторами была впервые осуществлена успешная доставка плазмидной конструкции с маркерным геном бетагалактозидазы в мышцы. Было показано, что инъецированная в мышцы незащищенная ДНК способна сохраняться и экспрессироваться в клетке до нескольких месяцев. В дальнейшем было обнаружено, что мышцы являются фактически единственной тканью, где незащищенная ДНК способна сохраняться так долго. Механизмы проникновения «голой» ДНК в клетку изучены недостаточно, однако существуют предположения, что важную роль в этом процессе играет рецептор-опосредованный эндоцитоз.
Недостатками этого вида трансфекции являются низкая эффективность проникновения в клетки in vivo, краткосрочность экспрессии введенных конструкций в большинстве органов и тканей, за исключением мышц и кожи, а также отсутствие специфичности доставки. Преимуществом «голой» ДНК является дешевизна ее выделения и очистки, возможность наработки большого количества образцов. Плазмидная ДНК способна вызывать иммунный ответ, благодаря наличию последовательностей CpG, которые неметилированы у бактерий. Это является преимуществом в случае генной вакцинации, но недостатком при генотерапии хронических заболеваний. Метод генной вакцинации позволяет вызывать иммунный ответ с помощью введения плазмиды, кодирующей антиген. Одним из примеров является внутримышечное введение плазмиды, содержащей один из генов Plasmodium falciparum (возбудитель малярии), которое привело к появлению иммунного ответа на эпитопы данного паразита.
Одним из путей увеличения эффективности трансфекции может быть использование метода гидродинамического шока, принцип которого заключается во внутривенном либо внутриартериальном введении плазмидного вектора в растворе большого объема (до 10 % от массы животного в течение короткого промежутка времени). При введении генных конструкций данным методом в хвостовую вену мышей происходит трансфекция до 20 % клеток печени. При проведении аналогичных исследований на макаках удалось добиться трансфекции 40 % мышечных волокон. Основным недостатком данного подхода является сравнительно высокая смертность лабораторных животных (более 1 %).
Для невирусной генной терапии in vivo необходимо встроить сайт начала репликации вируса в плазмидный вектор, чтобы вектор мог существовать в трансформированной клетке как эписомальный репликон. Удерживание эписомы продолжается не бесконечно, и экспрессия
17
введенного гена поэтому может быть кратковременной. Чтобы обеспечить перенос in vivo, ДНК обычно заключают в какой-нибудь комплекс, который может быть введен в клетки-мишени, или стимулируют ее захват клетками путем эндоцитоза. Например, ДНК может быть заключена в искусственные липидные везикулы – липосомы, которые способны сливаться с плазматической мембраной и доставлять свое содержимое в цитозоль. Липосомы находятся на втором месте после вирусных векторов по использованию. Они не так эффективно доставляют материал внутри клетки, но являются относительно дешевыми в производстве и безопасными. Эффективность липосом-опосредуемого переноса может быть повышена путем получения липосом на основе вирусных оболочек, которые часто содержат белки, способствующие слиянию с мембраной. Такие частицы называют виросомами. В отличие от липосомопосредуемого переноса, липофекция включает образование ДНКлипидного комплекса (липоплекса), который захватывается в процессе эндоцитоза. Популярны переносчики генов, основанные на использовании катионных полимеров (полиплексы), поскольку использование специфических сополимеров дает возможность менять физические свойства вектора-переносчика. Как оказалось, в некоторых случаях можно сформировать комплексы, имеющие различные свойства при различных температурах, что позволяет контролировать высвобождение ДНК. Это особенно полезно при переносе генов in vivo к определенным участкам тела, которые можно соответствующим образом нагревать или охлаждать. В целом, доставка инкапсулированной ДНК гораздо менее эффективна, чем использование вирусных векторов, отчасти из-за того, что часть ДНК деградирует еще до достижения клеток-мишеней, но в основном из-за того, что большое количество введенной ДНК деградирует внутри клетки прежде, чем достигнет ядра. Кроме того, гораздо труднее направить невирусные переносчики на специфические клетки-мишени, хотя можно присоединить ДНК к другой молекуле, которая специфически связывается с рецепторами клеток определенных типов и стимулирует таким образом захват путем рецептор-опосредуемого эндоцитоза.
Как оказалось, можно вводить ДНК непосредственно в некоторые ткани in vivо. Например, инъекция растворов ДНК в мышечную ткань приводит к трансформации некоторых клеток, у которых экспрессия генов может происходить в течение многих месяцев. Однако применение этого подхода ограничивается тем, что не все ткани доступны для инъекций, а кроме того, нужны большие количества ДНК. Наиболее известными методами физической доставки ДНК в клетки организма являются метод баллистической трансфекции («генное ружье»), безигольное введение (needle-free injection), электропорация и метод микроинъекций плазмидной ДНК. Безигольное введение предполагает использование в качестве доставки способа доставки плазмидной ДНК, осаж-
18
денной на золотых частицах, потока физиологического раствора под высоким давлением. Указанные методы широко применяются для трансфекции клеток кожи и мышц для проведения «генной вакцинации».
Для переноса ДНК к поверхности тканей существует альтернативный метод – бомбардировка частицами («генный пистолет»), при котором не-
большие частицы металла покрывают ДНК и направляют с ускорением на ткань-мишень под действием высокого давления воздушного потока или электрического разряда при выстреле из специального устройства («генного ружья»). При этом микрочастицы, пробивая клеточную мембрану, доставляют экзогенную ДНК в цитоплазму.
Метод электропорации in vivo основан на локальном изменении электрического потенциала клеточной мембраны и возникновении пор после кратковременного воздействия серии разрядов электрического тока. Благодаря этому повышается уровень проникновения плазмидной ДНК в клетку и, соответственно, уровень экспрессии трансгена. Данный метод успешно применяется для лечения опухолей и трансфекции мышечных клеток. Привлекает своей простотой, доступностью, возможностями точной дозировки энергии электрического импульса.
Принцип метода микроинъекций заключается во введении чужеродной ДНК в оплодотворенную яйцеклетку и является одним из наиболее часто используемых методов получения трансгенных животных. Однако применение микроинъекций для генетической трансфекции многоклеточного организма не представляется возможным.
Недостатками существующих физических методов трансфекции являются невысокая эффективность и локальность эффекта доставки ДНК.
Для доставки в клетки крупных генетических конструкций (>10 т. п. н.) с помощью эндосомного клеточного транспорта, позволяющего избежать лизосомного разрушения ДНК, образуют конъюгат ДНК с другими молекулами. Для этого поли-L-лизин ковалентно сшивают с молекулой, связывающейся со специфическим клеточным рецептором, а затем добавляют ДНК. В результате получается компактная, плотно скрученная структура (тор), на внешней поверхности которой располагаются сайты связывания с клеточным рецептором. К сожалению, подобный конъюгат, несмотря на свою специфичность, обладает низкой эффективностью трансфекции.
Возможно, подходящим терапевтическим вектором станет искусственная хромосома человека. Это связано с: 1) возможностью включения в нее протяженных сегментов чужеродной ДНК вместе с полным набором регуляторных элементов для одного или нескольких «терапевтических» генов; 2) возможностью использования геномного варианта «терапевтического» гена, обеспечивающего высокую эффективность его экспрессии; 3) стабильностью «терапевтического» гена и его длительной экспрессией как в пролиферирующей, так и в неделящейся клетке-мишени. Искусственная
19
хромосома содержит три основных элемента: концевые участки (теломеры), центромеру и точки инициации репликации. Свойства теломерных областей хромосом человека хорошо изучены, чего нельзя сказать о центромерах и точках инициации репликации, и существовали опасения, что искусственную хромосому человека не удастся сконструировать, пока не будут досконально изучены все ее элементы. Однако уже получены и поддерживаются в трансфицированной культуре клеток стабильные линейные искусственные хромосомы человека (микрохромосомы), состоящие из множества ДНК-повторов (длиной около 1 м. п. н.) центромерной области Y- хромосомы, высокомолекулярных фрагментов геномной ДНК и теломерных участков. В их центромерную область был встроен ген устойчивости к неомицину, что позволило использовать среду G4I8 в качестве селективной, В нескольких G418-устойчивых клетках были обнаружены микрохромосомы длиной от 6 до 10 м. п. н. Две из трех микрохромосом были получены «усечением» существующей хромосомы. В одном случае исходная центромера была сохранена, а в другом заменена трансфицированной центромерной областью. Третью, полностью искусственную микрохромосому получили лигированием in vitro трех трансфицированных ДНК-элементов. Ясно, что создание искусственной, хромосомы человека, содержащей «терапевтический(е)» ген(ы), вполне реально, но основной проблемой станет доставка этой огромной молекулы ДНК в ядро клетки-мишени. Кроме того, экспрессия генов, входящих в состав ДНК-блоков, из которых построена искусственная хромосома, может оказывать вредные воздействия на клеткимишени. Для начала в ткани пациента можно попытаться имплантировать инкапсулированные клетки с искусственными хромосомами.
Таким образом, к преимуществам невирусных систем относятся отсутствие ограничений на размер генной конструкции, значительно меньшая по сравнению с вирусами иммуногенность. Помимо этого невирусные, особенно синтетические носители являются легко модифицируемыми системами, что облегчает процесс внесения изменений в структуру комплексов и таким образом упрощает процесс их совершенствования. Все созданные к настоящему времени невирусные системы доставки имеют два основных недостатка: 1) низкая частота трансфекции, не позволяющая достичь нужного терапевтического эффекта; 2) непродолжительное время экспрессии «терапевтического» гена, не обеспечивающее эффективного лечения.
Применение плазмидных векторов
достоинства:
−отсутствие токсичности и мутагенности
−практически неограниченная емкость вектора
−дешевизна производства
20
