
Биомедицина теория
.pdf
ограничено, а длинные молекулы дцРНК вызывают неспецифический интерфероноподобный ответ на вирусы. Однако киРНК могут быть синтезированы химически и введены в клетки (или экспрессироваться внутри них в виде «шпилечных» генов), что должно способствовать образованию RISC и очень специфическому эффекту подавления. Эффект «сайленсинга» (подавления экспрессии) чрезвычайно мощный и долговременный. Хотя в настоящее время нет лекарств на основе RNAi, метод нашел применение для инактивации генов и функционального тестирования в клетках человека и он обязательно будет востребован в терапии.
Рис. 13. Механизм РНК-интерференции. Двухцепочечная РНК узнается белковым комплексом, который взаимодействует с эндонуклеазой DICER. Если дцРНК (dsRNA) несовершенна и содержит петли и неспаренные участки, она расщепляется нуклеазой DICER на короткие одноцепочечные молекулы, способные связываться с мРНК и стехиометрически препятствовать трансляции. В то же время совершенные дуплексы расщепляются с образованием коротких двухцепочечных молекул с короткими выступающими одноцепочечными концами. Их называют короткими интерферирующими РНК (киРНК, siRNAs). Они взаимодействуют
с белками с образованием РНК-индуцированного «сайленсингового» комплекса (RISC). RISC каталитически расщепляет мРНК, содержащую комплементарную последовательность
Аптамеры
Рассмотренные выше лекарства на основе нуклеиновых кислот взаимодействуют с транскриптом гена-мишени, в результате чего
51
функциональный белок отсутствует. Однако нуклеиновые кислоты могут также с большой специфичностью взаимодействовать с белками, что обеспечивает другую возможность для терапевтического вмешательства. Олигонуклеотиды, взаимодействующие с белками, называются аптамерами и могут быть введены в клетку обычными методами трансфекции. Пример терапевтического использования аптамеров – прерывание циклов размножения вирусов аптамерами, которые прочно связываются с субъединицами белка вирусной оболочки, что предотвращает их сборку.
Генная терапия инфекционных заболеваний: ВИЧ
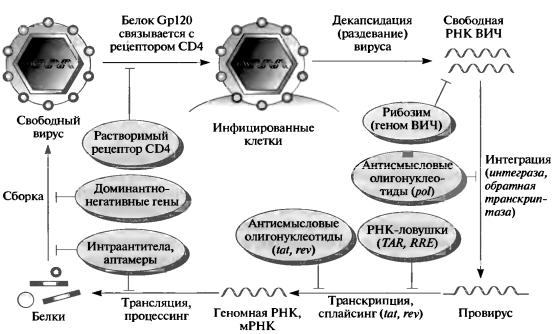
В методах генной терапии и использовании лекарств на основе нуклеиновых кислот много общего, поскольку олигонуклеотиды, которые вводятся непосредственно в клетку, можно также получать в результате экспрессии трансгенов. Терапевтические подходы, базирующиеся на экспрессии антисмысловых РНК, рибозимных конструкций, коротких интерферирующих РНК, интрамеров (РНК-аптамеры, экспрессирующиеся внутри клеток для белковой интерференции) и интраантител (антитела, экспрессируемые внутри клеток для белковой интерференции), были использованы в борьбе с ВИЧ-инфекцией и СПИДом (рис. 14).
Рис. 14. СтадииинфицированияВИЧипримерывозможныхпутей вмешательства сиспользованиемгенной терапииилидругихметодовгенной
медицины
Вирус иммунодефицита человека (ВИЧ) – наиболее опасный для человека вирусный патоген, и поэтому огромные денежные средства из различных фондов направляются на исследования, связанные с разработкой новых терапевтических подходов к предотвращению и лечению этого заболевания.
52
Поскольку ВИЧ является ретровирусом, то в качестве мишени при проведении терапии можно использовать геномную РНК или вирусные белки. ВИЧ специфически инфицирует Т-лимфоциты, что делает генную терапию ex vivo наиболее эффективным подходом. Тем не менее разрабатываются также лекарства на основе нуклеиновых кислот, которые действуют на Т- лимфоциты in vivо. Были получены антисмысловые олигонуклеотиды, которые узнают гены pol и env, кодирующие вирусную обратную транскриптазу (необходимую для репликации) и белки оболочки (важные для взаимодействия с рецепторами Т-клеток). Т-клетки были также трансформированы конструкциями, экспрессирующими антисмысловую РНК, направленную на подавление экспрессии этих генов, а также генов регуляторных белков Tat и Rev. Были созданы рибозимы, расщепляющие геном ВИЧ, которые были введены в
Т-клетки в составе ретровирусных конструкций. В процессе нормального инфекционного цикла белки Tat и Rev связываются с регуляторными последовательностями в геноме, известными как TAR и RRE. Новый подход к ингибированию ВИЧ-инфекции предполагает высокоэффективную экспрессию РНКловушек, несущих множество копий этих последовательностей. Основная идея заключается в том, что такие РНК свяжут все белки Tat и Rev и таким образом ограничат их доступность для вируса. Для блокирования сборки вирионов ВИЧ были получены как аптамеры, так и антитела; кроме того, интраантитела были экспрессированы в Т-клетках для ингибирования белков Tat и Rev и блокирования сборки субъединиц белка оболочки gpl60. Альтернативный подход к блокированию сборки вириона – суперэкспрессия мутантной формы вирусного белка, которая препятствует функции других белков (доминантнонегативный подход). Например, модифицированный белок Rev, который не может образовывать комплексы, предотвращает экспорт РНК ВИЧ из ядра инфицированных Т-клеток. Как и в случае генной терапии рака, были разработаны новые подходы, имеющие целью сделать Т-клетки более мощными убийцами ВИЧ-инфицированных клеток.
ДНК-вакцины
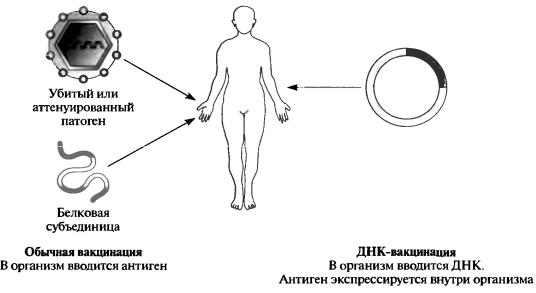
Обычная вакцинация включает предоставление антигенов иммунной системе путем введения всего организма (убитого или аттенуированного патогена) или его компонентов, полученных методами рекомбинантных ДНК. ДНК-вакцинация – другой метод генной медицины, где вакцинируемым вводится ДНК. Это не приводит к иммунному ответу на молекулы ДНК, но если ДНК экспрессируется, то образуется белок, который может стимулировать выработку иммунной системой соответствующих антител (рис. 15). Таким образом, ДНК-вакцинация очень напоминает генную терапию (тем, что введенная ДНК экспрессируется), но вместо прямого воздействия на болезнь лечение или предупреждение осуществляется путем активации иммунной системы. Преимущества такого метода заключаются в его простоте (используются стандартные методы клонирования), а также в том, что практически одинаковые приемы могут
53
быть использованы для вакцинации против любой болезни. Кроме того, с учетом ведущихся в настоящее время работ по секвенированию геномов большого количества микробных патогенов ДНК-вакцинация обеспечивает быстрый путь выявления новых мишеней вакцин путем высокопроизводительного тестирования на мышах. ДНК может вводиться путем инъекций с использованием липосом или бомбардировкой частицами. Первая демонстрация метода – долгосрочная защита от гриппа, а в настоящее время проходят испытания более 40 ДНК-вакцин против таких болезней, как корь, ВИЧ, лихорадка Эбола и туберкулез. ДНК-вакцинация также изучается в качестве средства защиты от прионных болезней.
Рис. 15. Сравнение обычной вакцинации и ДНК-вакцинации
Современное состояние генной терапии
Значимость
Сегодня, технологии генной терапии могут лечь в основу терапии большинства моногенных и полигенных заболеваний, частота которых составляет 6 % от общего количества новорожденных детей, т.е. абсолютное количество больных данной группы сопоставимо с суммированным показателем больных сердечно-сосудистыми и онкологическими заболеваниями. Следует отметить, что практически все больные моногенными и полигенными болезнями являются инвалидами на протяжении всей жизни и находятся на государственном обеспечении, которое включает помимо пенсий необходимость снабжения лекарственными препаратами, поддерживающими жизненные показатели на определенном уровне.
Отдельную группу представляют орфанные (редкие) болезни, частота которых не превышает 1 на 100 тыс. человек населения, в связи с чем для большинства таких болезней не разработано лекарственной терапии, что делает необходимым применение доступных терапевтических технологий, в особенности технологий генной терапии, для их лечения.
54
Для группы так называемых социально значимых заболеваний, под которыми принято понимать сердечно-сосудистые, онкологические и ряд других нозологических классов, применение технологий генной терапии, по данным экспериментальных исследований, также является оправданным, а порой и единственно возможным способом лечения.
Согласно технологическим прогнозам Манчестерского института инновационных исследований, применение технологий генной терапии позволит снизить показатель инвалидизации населения США на 57 %, Европы на 21 % к 2025 году. Разница в показателях обусловлена различной интенсивностью развития данной области. Согласно программе развития национального института здоровья США, к 2030 году должны быть внедрены методы генно-терапевтического воздействия на все генетические заболевания, частота которых равна или более чем 1 больной на 1000 новорожденных.
Ситуация в мире
Технологии генной терапии представляют собой новый подход в лечении болезней. Впервые обоснованная возможность применения технологий генной инженерии для терапевтических целей была упомянута в 1989 году, однако основные работы начались лишь десять лет спустя. Однако темпы развития данной отрасли в США превзошли все прогнозы, сделанные в конце 90-х годов прошлого века.
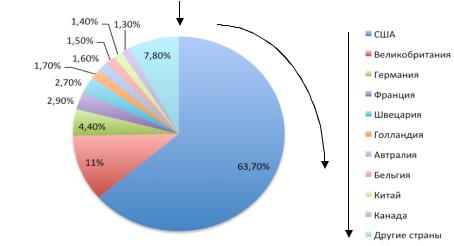
По данным Gene Therapy Net, в США и Европе работают более 700 частных компаний, около 200 специализированных институтов и более 2000 лабораторий, специализирующихся на разработке и/или использовании технологий генной терапии. Распределение по странам показано на рис. 16.
Рис. 16. Доли стран-участников рынка в общем объеме продуктов технологий генной терапии. Учтены продукты, в отношении которых проходит процедура легализации. Источник: The Journal of Gene Medicine, 2013
Первые терапевтические продукты технологий генной терапии начали проходить легализацию в качестве лекарственных средств (средств терапии) в 2004 году. На 2012 год, по данным журнала The Journal of Gene
55
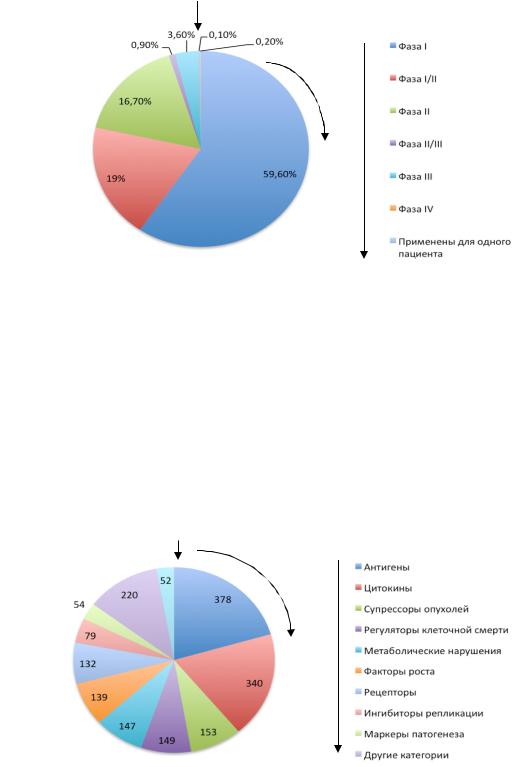
Medicine, в стадии доклинической разработки находится порядка 8000 ген- но-терапевтических препаратов, а на различных этапах легализации – более 1500 (рис. 17), что значительно превышает аналогичные показатели для “классических” лекарственных средств.
Рис. 17. Распределение генно-терапевтических препаратов по различным стадиям легализации (клинических испытаний).
Источник: The Journal of Gene Medicine, 2013
Как видно из рис. 17, подавляющее большинство генно-терапевти- ческих препаратов находится в первой фазе клинических испытаний, что обусловлено новизной технологий. Следует ожидать, что 80 % из препаратов, находящихся на первой фазе выйдут на широкий рынок через 7–10 лет.
Следует отметить, что большинство разработок, находящихся на стадии легализации, представлены частными компаниями, интерес которых лежит в массовом внедрении технологий генной терапии. В связи с этим, анализ распределения по функциям «корректируемых» генов показывает, что большинство разработок направлены на лечение различных форм рака и метаболических нарушений (рис. 18).
Рис. 18. Функции генов, корректируемых ТГТ, находящимися в различных стадиях легализации. Цифрами показано количество регистрируемых препаратов для данного класса генов. Источник: The Journal of Gene Medicine, 2013
56
Ситуация в России
Россия находится в двойственном положении в области технологий генной терапии. С одной стороны, мы входим в число формальных лидеров, вместе с ЕС и Китаем. Здесь следует отметить, что на сегодняшний день для массового применения одобрено всего 3 генно-терапевтических препарата (Глибера – ЕС; Гендицин – Китай; Неоваскулген – Россия). В тоже время, как было сказано выше, наибольшее число разработок в этой области сосредоточены в США. Отставание США происходит на уровне легализации. Компании вынуждены проходить двойную легализацию: стандартную для всех типов лекарственных препаратов в FDA и дополнительную, для препаратов на основе рекомбинантных ДНК в Агентстве по рекомбинантным ДНК (RAC). Однако, по мнению представителей Американского общества генных и клеточных терапевтов, легализация препарата в RAC в скором времени будет отменена. В связи с этим, Россия, обладая широким окном возможностей в данной сфере, может утратить «лидирующие» позиции по причине крайней низкой исследовательской активности и отсутствия направленных мер по стимулированию развития данной области. Для примера, за время функционирования федеральной целевой программы «Фарма2020», не было профинансировано ни одной разработки геннотерапевтических препаратов. ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы», была профинансирована только одна заявка, направленная на разработку технологий генной терапии, что связано, по нашему мнению, со слабой конвергенцией между исследовательскими учреждениями биологического профиля, обладающими компетенциями в области генетической инженерии, и медицинскими учреждениями. При этом в РФ функционирует только одна компания, работающая в области технологий генной терапии – ОАО «Институт стволовых клеток человека». Другая проблема заключается в отсутствии целевого финансирования данной области, а мероприятия существующих инструментов финансирования исследований, в большинстве случаев, не отражают адекватных потребностей разработчиков технологий генной терапии. В то же время, Россия обладает достаточным интеллектуальным потенциалом для занятия лидирующих позиций.
Как следует из изложенного, генная терапия базируется на передовых технологиях генной и клеточной биологии. В нашей стране события последнего десятилетия не способствовали развитию подобных технологий. Тем не менее, ряду ученых удалось начать клинические испытания по генной терапии опухолей и инфаркта миокарда.
С учетом реализации предложенного плана мероприятий и стабильном экономическом росте РФ не менее 3 % в год существуют ожидания, что к 2025 году РФ выведет на открытый рынок не менее 30 генно-терапевти-
57
ческих препаратов. В зависимости от специфики препаратов и выбора приоритетных классов заболеваний, для которых будут разрабатываться технологии генной терапии, объем рынка российских препаратов составит от 22 до 40 млрд долларов к 2030 году. При этом ожидается достижение социального эффекта, выражающегося в уменьшении инвалидизации по моногенным и полигенным патологиям на 27 %, по мультифакториальным патологиям (рак, сердечно-сосудистые заболевания) на 18 %, что приведет к значительному снижению бюджетных расходов.
В заключение следует отметить, что в настоящий момент генная терапия уже вышла из состояния эйфорических обещаний, идет планомерная работа по разработке векторных систем, в том числе направленных, оптимизируются дозы и применяемые гены и, вероятно, через несколько лет ожидания прошлого десятилетия оправдаются. Успешное использование генной терапии началось в 1990 году, и к настоящему времени есть уже тысячи прецедентов полного излечения от наследственных заболеваний. Считается, что это – одно из самых перспективных направлений в лечении тяжелых болезней.
58
СТВОЛОВЫЕ КЛЕТКИ
Стволовые клетки и их характеристика
Исследования со стволовыми клетками являются одним из современных направлений биомедицины. Стволовыми клетками называют клеткипредшественники, из которых образуются при необходимости все другие типы клеток, составляющие различные органы и ткани человека. Термин «стволовая клетка» был введён русским гистологом Александром Максимовым в 1909 году. Он постулировал существование стволовой кроветворной клетки. Выступая на заседании Общества гематологов в Берлине 1 июня 1909 года он ввёл понятие «Stammzelle», подразумевая под этим определением лимфоцит способный быть стволовой клеткой в современном понимании этого слова.
Значительный объем исследований стволовых клеток проведен биологами А. Фриденштейном и И. Чертковым в России в 60-х годах прошлого века. Именно они открыли мезенхимальные стволовые клетки (МСК) в костном мозге, обладающие уникальной регенерационной способностью. Открытие это осталось практически незамеченным еще почти полвека. Бум в исследованиях в этой области начался с 1998 года, когда американскими учеными Д. Томпсоном и Д. Герхартом были открыты эмбриональные стволовые клетки (ЭСК) человека и показана их способность дифференцироваться практически в любые типы клеток человеческого организма.
В 1999 году журнал Science признал открытие эмбриональных стволовых клеток третьим по значимости событием в биологии после расшифровки двойной спирали ДНК и программы «Геном человека».
Один из первооткрывателей структуры ДНК, Джеймс Уотсон, комментируя открытие стволовых клеток, отметил, что устройство стволовой клетки уникально, поскольку под влиянием внешних инструкций она может превратиться в зародыш либо в линию специализированных соматических клеток.
Стволовые клетки – недифференцированные (незрелые) клетки, имеющиеся во всех многоклеточных организмах. Стволовые клетки способны самообновляться, образуя новые стволовые клетки, делиться посредством митоза и дифференцироваться в специализированные клетки, то есть превращаться в клетки различных органов и тканей.
Стволовая клетка может стать практически любой клеткой в человеческом организме. На самых ранних стадиях своего развития зародыш полностью состоит из стволовых недифференцированных клеток, затем начинаются этапы дифференцировки и из них образуются органы и ткани организма. Во взрослом организме стволовые клетки содержатся в небольших количествах в крови и костном мозге и в еще меньших количествах во всех органах и тканях.
59
Стволовые клетки имеют следующие основные характеристики. Вопервых, это неспециализированные клетки (в отличие от клеток, из которых состоят мышцы, мозг и т.д.). Во-вторых, стволовые клетки способны делиться в течение долгого времени, причем в результате каждого деления образуются две идентичные клетки. Третье важное свойство стволовых клеток – то, что они способны к дифференциации в специфические типы клеток, такие как клетки мышц, мозга, крови. Стволовые клетки можно найти в любой животной ткани, а, поскольку эмбрионы состоят из стволовых клеток, которые при делении и дифференциации превращаются в специализированные клетки и ткани, все мы, в конечном счете, состоим из стволовых клеток. Доказано, что ДНК во всех клетках одного организма (кроме половых), в том числе и стволовых, одинакова. Клетки различных органов и тканей, например, клетки кости и нервные клетки, различаются только тем, какие гены у них включены, а какие выключены, то есть регулированием экспрессии генов, например, при помощи метилирования ДНК. Фактически, с осознанием существования зрелых и незрелых клеток был обнаружен новый уровень управления клетками. То есть, геном у всех клеток идентичен, но режим работы, в котором он находится, различен.
Вразличных органах и тканях взрослого организма существуют частично созревшие стволовые клетки, готовые быстро дозреть и превратиться
вклетки нужного типа. Они называются бластными клетками. Например, частично созревшие клетки мозга – это нейробласты, кости – остеобласты и так далее. Дифференцировку могут запускать как внутренние причины, так и внешние. Любая клетка реагирует на внешние раздражители, в том числе и на специальные сигналы цитокины. Например, есть сигнал (вещество), служащий признаком перенаселённости. Если клеток становится очень много, то этот сигнал сдерживает деление. В ответ на сигналы клетка может регулировать экспрессию генов.
Всформировавшемся организме человека имеется примерно 200 различных типов клеток. Они требуют постоянного замещения по мере их старения и отмирания. Эту восстановительную функцию выполняют стволовые клетки, заполняющие определенные ниши во всех тканях и органах. Чем моложе организм, тем больше запас стволовых клеток, и, соответственно, восстановительный потенциал. В процессе взросления человека наблюдается постоянное снижение количества стволовых клеток: при рождении – 1 стволовая клетка встречается на 10 тысяч, к 20–25 годам – 1 на 100 тысяч, к 30 – 1 на 300 тысяч (приведены средние показатели). К 50-летнему возрасту в организме в среднем остается всего 1 стволовая клетка на 500 тысяч, причем именно в этом возрасте, как правило, уже появляются такие болезни, как атеросклероз, стенокардия, гипертония и т.п.
Стволовые клетки – это орган экстренной репарации в случае аварийных, массивных повреждений ткани (травмы, вирусы, химические, тепло-
60
