
Биомедицина теория
.pdf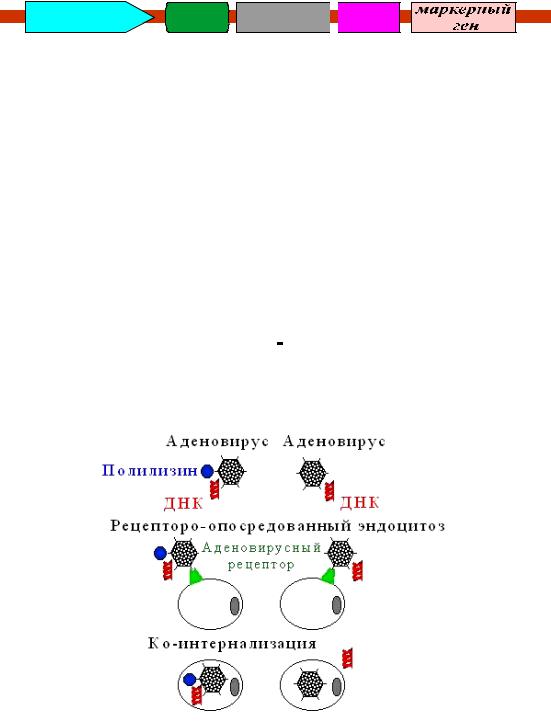
недостатки:
−трансфекция ограниченной популяции клеток
−деградация ДНК лизосомами
−отсутствие тропизма (в настоящее время есть перспективные разра-
ботки)
Обобщенная схема плазмидного вектора для генной терапии:
промотор ген poly(A) 
 ori
ori
Промоторы:
−ранний промотор цитомегаловируса человека (HCMV)
−тетрациклин-зависимый промотор CMV
−промотор вируса саркомы Рауса (RSV)
−главный поздний промотор аденовируса человека 5 типа (MLP)
Маркерные гены:
−SEAP (secreted alkaline phosphatase; секретируемой щелочной фос-
фатазы)
−β-galactosidase (β-галактозидазы)
−G418 (geneticin) или neomycin (G418 – аналог неомицина)
−GFP (green fluorescent protein; зелёный флуоресцентный белок)
К смешанным системам доставки относят:
−Рецепторо-опосредованный эндоцитоз (рис. 5)
−Вирус-липосомы
−Бактериофаги
Рис. 5. Рецепторо-опосредованный эндоцитоз
21
Свойства вирусных векторов для доставки генов
Вирусные векторы для генной терапии оцениваются по их эффективности, способности выдерживать чужеродную ДНК, безопасности, механизму трансформации (эписомальный или интеграционный), персистентности и тропизму. Ни один из вирусов не является универсальным вектором (не отвечает всем требованиям), хотя интерес к созданию гибридных вирусов, сочетающих наилучшие свойства различных типов векторов, возрастает.
Аденовирусы
Это вирусы, которые вызывают легкие формы инфекций верхних дыхательных путей, т. е. обычные простуды. Трансформация происходит эписомальным путем, и вирус может инфицировать широкий диапазон делящихся и неделящихся клеток. Среди недостатков – небезопасность (как было показано, аденовирусные векторы вызывают воспалительные реакции у некоторых пациентов). Такая воспалительная реакция привела к смерти 18-летнего Джесси Гельзингера во время фазы I испытаний генной терапии для лечения наследственного заболевания печени – дефицита орнитинтранскарбамилазы (OTС). Все испытания методов генной терапии с участием аденовируса были приостановлены для изучения вопросов безопасности. После проведения испытаний выяснилось, что других данных о тяжелых реакциях на вирус не поступало.
Аденоассоциированные вирусы
Аденоассоциированные вирусы (ААВ) содержат одноцепочечную ДНК и вызывают асимптоматические инфекции. Трансформация происходит путем устойчивой интеграции, и вирус может инфицировать широкий диапазон делящихся и неделящихся клеток. Вирус дикого типа обладает интересным свойством, обеспечивающим безопасность работы с ним: он может интегрировать в строго определенное место человеческого генома, расположенное в хромосоме 19, уменьшая тем самым риск инсерционного мутагенеза (см. ниже ретровирусы). К сожалению, это свойство обеспечивается вирусным белком Rep, но ген rер должен быть делетирован, чтобы обеспечить место чужеродной ДНК.
Бакуловирусы
Это ДНК-содержащие вирусы, которые обычно инфицируют насекомых, но могут инфицировать и человеческие клетки. Трансформация эписомальная, и хотя в первоначальных сообщениях говорилось о том, что преимущественно инфицируются клетки печени, сейчас выясняется, что вирус способен инфицировать гораздо более широкий диапазон клеток.
22
Вирусы герпеса
Вирус простого герпеса (ВПГ) – ДНК-содержащий вирус, который проявляет повышенный (ярко выраженный) нейротропизм, что делает его особенно привлекательным для генной терапии заболеваний нервной системы. Он инфицирует нейроны и персистирует в них. Существует множество заболеваний, поражающих центральную и периферическую нервную систему: опухоли, метаболические и иммунные нарушения, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона). Вследствие тропности ВПГ к нервным клеткам он является подходящим вектором для генной терапии таких заболеваний. Доклинические испытания на экспериментальных животных показали, что гены, доставленные с помощью ВПГ-векторов в клетки мозга и периферической нервной системы, экспрессируются и поддерживаются длительное время. Однако до начала I фазы клинических испытаний ВПГвекторов необходимо провести дополнительные исследования. Трансформация эписомальная, и вирус может распространяться через синаптическую сеть.
Ретровирусы
Ретровирусы – РНК-содержащие вирусы, имеющие обратную транскриптазу, дающую возможность синтезировать кДНК-копию их генома. Эта копия интегрируется в геном хозяина, приводя к стабильной трансформации и длительной экспрессии перенесенных генов. Большинство существующих ретровирусных векторов созданы на основе вируса лейкемии Молони мышей (MoMLV). Типичные ретровирусы инфицируют только делящиеся клетки, поэтому они особенно пригодны для генной терапии рака. Однако векторы, основанные на лентивирусах (таких как ВИЧ), могут инфицировать неделящиеся клетки. Поскольку интеграция происходит случайным образом, то ее механизм может приводить к активации прилегающих генов, включая онкогены, что именно и произошло во время проводимых недавно испытаний генной терапии SCID (синдрома тяжелого комплесного иммунодефицита) (см. ниже). Другая проблема безопасности связана с использованием ВИЧ для конструкции векторов; это единственный вирус, используемый для генной терапии, который, как известно, вызывает смертельные болезни. Следовательно, необходимо принимать чрезвычайные меры безопасности, чтобы избежать возникновения путем рекомбинации способных к репликации вирусов.
Преимущества и недостатки основных систем доставки генных конструкций указаны в таблице 2.
23
Таблица 2
Преимущества и недостатки систем доставки генных конструкций
Средство доставки |
Преимущества |
|
Недостатки |
|
|||||
Некомпактизованная |
Производство, |
хранение и |
Очень |
малая |
длительность |
||||
(«голая») ДНК |
контроль |
качества очень |
экспрессии in vivo в боль- |
||||||
|
просты и дешевы. Низкая |
шинстве |
тканей. |
Низкая |
|||||
|
иммуногенность |
эффективность трансфекции |
|||||||
|
|
|
|
ex vivo и in vivo. Направлен- |
|||||
|
|
|
|
ный перенос затруднен |
|||||
Аденовирусы |
Высокая |
эффективность |
Персистенция (обычно на- |
||||||
|
трансфекции in vivo и ex |
блюдается кратковремен- |
|||||||
|
vivo (могут быть получены |
ная экспрессия, хотя не- |
|||||||
|
высокие титры). Высокая |
давно полученные векторы |
|||||||
|
емкость (до 35 тыс. п. н. |
имеют |
большую |
продол- |
|||||
|
чужеродной ДНК). Транс- |
жительность жизни и очень |
|||||||
|
фецирует |
пролиферирую- |
полезны |
для |
длительной |
||||
|
щие и непролиферирующие |
экспрессии генов в нейро- |
|||||||
|
клетки. Накоплен значи- |
нах). Повторное введение |
|||||||
|
тельный опыт в клиниче- |
вызывает сильный иммун- |
|||||||
|
ском применении. Возмо- |
ный ответ. Производство, |
|||||||
|
жен направленный перенос |
хранение и контроль срав- |
|||||||
|
|
|
|
нительно сложны |
|
|
|||
Ретровирусы |
Обеспечивает длительную |
Низкая |
эффективность |
||||||
|
экспрессию in vivo – пер- |
трансфекции in vivo. Раз- |
|||||||
|
систенция (стабильная ин- |
мер вставки – не более 8 |
|||||||
|
теграция |
делает возмож- |
т.п.н. Трансфецирует толь- |
||||||
|
ной долговременную экс- |
ко |
|
пролиферирующие |
|||||
|
прессию генов). Высокая |
клетки. |
Небезопасность |
||||||
|
эффективность |
трансфек- |
(интеграция |
происходит |
|||||
|
ции ex vivo (может быть |
случайным образом, и воз- |
|||||||
|
получен высокий титр ви- |
никает опасность инсерци- |
|||||||
|
руса, и очень высока эф- |
онного мутагенеза). Произ- |
|||||||
|
фективность |
инфекции). |
водство, хранение и кон- |
||||||
|
Накоплен опыт в клиниче- |
троль очень сложны |
|
||||||
|
ском применении ex vivo. |
|
|
|
|
|
|
||
|
Сравнительно |
низкая им- |
|
|
|
|
|
|
|
|
муногенность |
|
|
|
|
|
|
|
|
Лентивирусы |
Трансфецирует |
пролифе- |
Малая |
емкость |
|
(может |
|||
|
рирующие |
и |
непролифе- |
удерживать |
чужеродную |
||||
|
рирующие клетки. |
ДНК |
размером |
не |
более |
||||
|
Трансфецирует |
гематопо- |
8 тыс. п. н.). Производство, |
||||||
|
этическиестволовыеклетки |
хранение и контроль каче- |
|||||||
|
|
|
|
ство |
крайне |
затруднены. |
|||
|
|
|
|
Нет |
опыта |
клинических |
|||
|
|
|
|
испытаний |
|
|
|
||
24
Продолжение таблицы 2
Бакуловирусы |
Безопасность (вирус инфициру- |
Эффективность |
(вирус |
|||||||
|
ет человеческие клетки, но не |
чувствителен |
к |
компле- |
||||||
|
может в них реплицироваться). |
мент-опосредованной |
||||||||
|
Большая емкость (вирус имеет |
инактивации, |
хотя |
были |
||||||
|
палочковидный капсид, поэто- |
разработаны |
подходы к |
|||||||
|
му нет верхнего предела для |
преодолению |
этого |
не- |
||||||
|
размеров удерживаемой чуже- |
достатка). Нет опыта кли- |
||||||||
|
родной ДНК) |
|
|
нических испытаний |
|
|||||
Вирусы герпеса |
Большая емкость (точный верх- |
Нет |
опыта |
клинических |
||||||
|
ний |
предел |
для встраивания |
испытаний |
|
|
|
|||
|
чужеродной ДНК не установ- |
|
|
|
|
|
|
|||
|
лен). Персистенция (могут ус- |
|
|
|
|
|
|
|||
|
тановиться |
пожизненные ла- |
|
|
|
|
|
|
||
|
тентные инфекции в нейронах) |
|
|
|
|
|
|
|||
Адено-ассоцииро- |
Эффективно |
|
трансфецирует |
Малая |
емкость |
(может |
||||
ванные вирусы |
различные типы клеток in vivo. |
удерживать ДНК-вставку |
||||||||
|
Обеспечивает длительную экс- |
размером менее 5 тыс. п. |
||||||||
|
прессию in vivo – персистенция |
н.). Риск инсерционного |
||||||||
|
(устойчивая интеграция спо- |
мутагенеза. |
Производст- |
|||||||
|
собствует длительной экспрес- |
во, хранение и контроль |
||||||||
|
сии). Сравнительно низкая им- |
качества |
очень |
сложны. |
||||||
|
муногенность, высокая безо- |
Небольшой опыт |
клини- |
|||||||
|
пасность (вирус требует при- |
ческий испытаний. По- |
||||||||
|
сутствия аденовируса или виру- |
вторное введение вызыва- |
||||||||
|
са герпеса для репликации, так |
ет иммунный ответ и ней- |
||||||||
|
как от природы не обладает |
трализацию вектора |
|
|||||||
|
способностью к репликации) |
|
|
|
|
|
|
|||
Электропорация, |
Производство, хранение и кон- |
Малая длительность |
экс- |
|||||||
баллистическая |
троль |
качества |
сравнительно |
прессии in vivo. Неболь- |
||||||
трансфекция (ген- |
просты. Низкая иммуноген- |
шой |
опыт |
клинических |
||||||
ный пистолет) |
ность |
|
|
|
испытаний. |
Локальный |
||||
|
|
|
|
|
эффект трансфекции |
|
||||
Катионные липиды |
Производство, хранение и кон- |
Низкая |
эффективность |
|||||||
|
троль |
качества |
сравнительно |
трансфекции in vivo. Ма- |
||||||
|
просты. Высокая эффектив- |
лая |
длительность |
экс- |
||||||
|
ность трансфекции ex vivo. |
прессии in vivo. Неболь- |
||||||||
|
Низкая иммуногенность |
шой |
опыт |
клинических |
||||||
|
|
|
|
|
испытаний. |
Направлен- |
||||
|
|
|
|
|
ный перенос затруднен |
|||||
Катионные поли- |
Производство, хранение и кон- |
Низкая |
эффективность |
|||||||
меры, пептиды |
троль |
качества |
сравнительно |
трансфекции in vivo. Ма- |
||||||
|
просты. Высокая эффектив- |
лая |
длительность |
экс- |
||||||
|
ность трансфекции ex vivo. |
прессии in vivo. Нет опыта |
||||||||
|
Низкая иммуногенность. Воз- |
клинических испытаний |
||||||||
|
можен направленные перенос |
|
|
|
|
|
|
|||
25
На самом деле все системы показали свою достаточно высокую эффективность, об этом свидетельствуют данные, приведенные в табл. 3, где сведены клинические испытания, для которых вторая фаза уже завершается. Разнообразие успешных подходов свидетельствует в пользу перспективности каждого из методов.
В последние годы было несколько сообщений об успешном использовании генной терапии в клинике. В этих исследованиях нативная ДНК, кодирующая ангиогенный фактор – васкулярный фактор роста эндотелия (VEGF), была инъецирована в скелетные мышцы пациентов с периферической ишемией, которая приводила к плохому кровоснабжению конечностей. После этого у части больных наблюдался продолжительный и выраженный лечебный эффект, включая тех, кому грозила ампутация. В настоящее время проводятся клинические испытания у больных с ишемической болезнью сердца.
Таблица 3
Возможность применения различных методов доставки генетического материала в клетку
Заболевание |
Вектор |
Метод |
Ген |
Направленность |
|
доставки |
терапии |
||||
|
|
|
|||
|
|
|
|
|
|
Рак |
Липосомы |
|
HLA B7 |
Увеличение иммуно- |
|
|
|
|
|
генности |
|
Рак |
Липосомы |
|
|
Увеличение иммуно- |
|
|
|
генности |
|||
|
|
|
|
||
Рак |
Аденовирус |
Опухолевые |
p53 |
Индукция апоптоза |
|
клетки in vivo |
|||||
Рак |
Ретровирус |
Опухолевые |
TK |
Уничтожение |
|
клетки in vivo |
ферментом |
||||
Рак |
Ретровирус |
Фибробласты |
IL-12 |
Увеличение |
|
ex vivo |
иммуногенности |
||||
Ишемия |
Чистая |
Клетки мышцы |
VEGF |
Стимуляция ангиогенеза |
|
|
ДНК |
in vivo |
|
|
|
СПИД |
Ретровирус |
Т-клетки |
Химер- |
Переориентация цито- |
|
ex vivo |
ный TCR |
токсических Т-клеток |
5) по применяемым генотерапевтическим агентам:
−нуклеиновые кислоты
−белки
−иммунотерапия
26
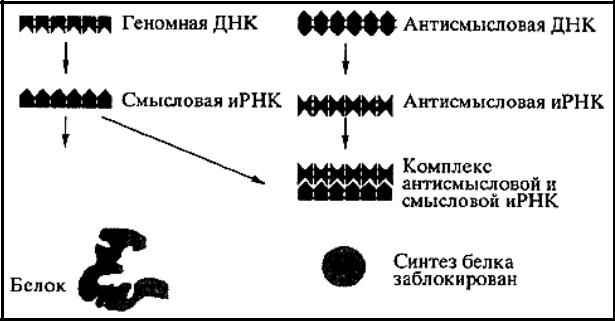
Нуклеиновые кислоты-генотерапевтические агенты
−Антисенс (антисмысловые) ДНК и РНК
−Рибозимы
−Пептидо-нуклеиновые кислоты (PNA, от англ. peptide-nucleic acids)
−РНК-ловушки
Антисенс (антисмысловые) ДНК и РНК способны блокировать синтез определенного белка (рис. 6)
Преимущества:
−относительная специфичность дуплекса
−возможность экспрессии в составе любого вектора
−отсутствие иммуногенности
Недостатки:
− быстрая деградация (РНКазы, ДНКазы) в клетке
Рис. 6. Механизм действия антисмысловых нуклеиновых кислот
Рибозимы – это природные РНК, обладающие каталитической активностью (РНК-ферменты); их субстратсвязывающий домен присоединяется к комплементарной РНК-мишени с помощью водородных и, возможно, других связей, а каталитический расщепляет ее в специфическом сайте. Модифицируя субстратсвязывающую последовательность, можно получить рибозим, специфичный в отношении определенной мРНК (рис. 7).
27
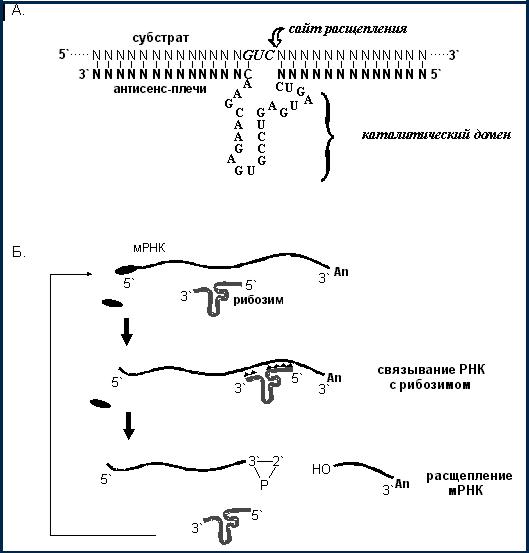
Рис. 7. Механизм действия рибозимов.
Сайт расщепления NUY, где N – любой нуклеотид, Y – любой нуклеотид, кроме G
Типы:
1)Головка молотка
2)Шпилька
3)Интроны группы I, II Преимущества:
−каталитические свойства (расщепление мишени)
−в процессе взаимодействия с мишенью молекулы не расходуются (ингибирование экспрессии гена – мишени при низких концентрациях)
−отсутствие иммуногенности
−индукция интерферона
−Недостатки:
−быстрая деградация (РНКазы, ДНКазы) в клетке
−Возможно создание модифицированных рибозимов.
28
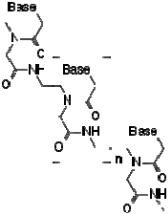
Пептидо-нуклеиновые кислоты (PNA) имеют следующую структуру:
(Base – азотистое основание)
PNA – синтетический аналог ДНК, в котором рибозофосфатный остов замещен на полиамидную цепь.
–Дуплексы DNA/PNA более стабильны, чем дуплексы DNA/RNA.
–Дуплексы DNA/PNA не подвержены действию РНКазы Н (RNase H), протеаз, пептидаз.
РНК-ловушки
Гиперэкспрессия коротких РНК (РНК-ловушки), направленных на cis- активаторные регуляторные элементы, могут использоваться как ловушки для trans-активаторных белков.
Механизм действия – блокирование связывания trans-активаторных белков вируса с регуляторными элементами, что влечет за собой блокирование транскрипции.
Белки-генотерапевтические агенты
•Трансдоминантные негативные белки
•Одноцепочечные антитела (intrabodies)
•Суицидные гены
Трансдоминантные негативные белки
Трансдоминантные негативные белки – мутантная версия регуляторных или структурных белков.
Механизм действия:
1)Конкуренция за субстраты и кофакторы
2)Образование нефункциональных мультимерных комплексов Преимущества:
• возможность использования в составе невирусных векторов Недостатки:
• иммуногенность
29
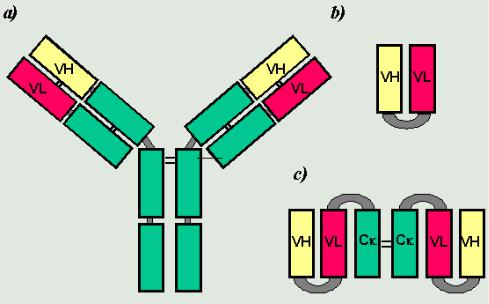
Одноцепочечные антитела
Новый класс генотерапевтических агентов.
Представляют собой одноцепочечные вариабельные фрагменты антител (рис. 8) с сохраненными свойствами антиген-специфичности, получаемые клонированием и экспрессией генов легких и тяжелых цепей антител.
Преимущества:
•возможность экспрессии в гетерологичных системах
•сохранение всех свойств классических антител Недостатки:
•отсутствие возможности к секреции (связаны с эндоплазматической сетью)
•использование сигнальных последовательностей позволяет одноцепочечным антителам секретироваться
Рис. 8. Двухцепочечные и одноцепочечные антитела:
а – вариабельные домены тяжелой (VH) и легкой (VL) цепей (около 110 а.а.); b – домены соединены гибким линкером (глицин(4)-серин(3));
c – использование домена Ck легкой цепи разрешает димеризацию – увеличение активности и стабильности
Суицидные гены
Вместо ингибирования (или компенсации) функции дефектного гена возможно использование суицидных генов, экспрессия которых вызывает гибель клетки-мишени (рис. 9).
Примеры:
•А-цепь дифтерийного токсина
•ген цитозиндеаминазы
•ген тимидинкиназы вируса простого герпеса (HSV tk)
30
