
- •Карбоксильная группа
- •Реакции подлинности
- •Количественное определение
- •Сложноэфирная и амидная группы
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Азометиновая группа
- •Первичная алифатическая аминогруппа
- •Количественное определение
- •Ароматическая нитрогруппа Химические свойства
- •Количественное определение
- •Вторичная аминогруппа Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Вторичная аминогруппа в составе имидной, сульфамидной, гидразидной функциональных групп и в некоторых гетероциклических соединениях
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Третичный и четвертичный атом азота
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Ковалентно связанный галоген
- •Подлинность
- •Количественное определение
- •Ковалентно связанная сера
- •Подлинность
- •Ковалентно связанный азот
Количественное определение
1. Метод кислотно-основного титрования в среде протофильного растворителя (диметилформамида). Растворитель усиливает слабые кислотные свойства вторичной аминогруппы. Титранты: раствор натрия метилата или натрия гидроксида в смеси метилового спирта и бензола (толуола). Индикатор – раствор тимолового синего в диметилформамиде.
П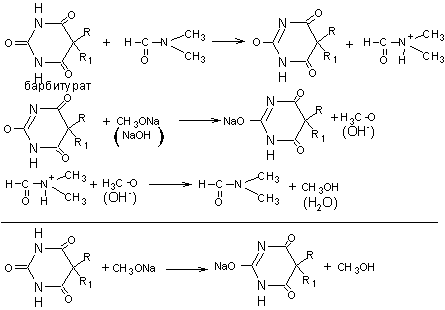 ример
1:
ример
1:
fэкв (барбитурата)=1
П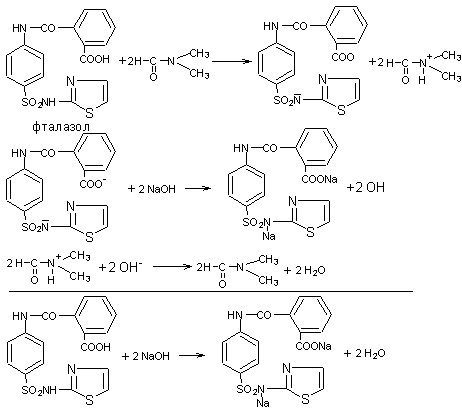 ример
2:
ример
2:
fэкв (фталазола)=1/2
2. Косвенный алкалиметрический метод нейтрализации (способ заместительного титрования). Основан на свойстве вторичной аминогруппы кислотного характера образовывать труднорастворимые соединения с серебра нитратом и выделением эквивалентного количества азотной кислоты. Титрант: раствор натрия гидроксида. Индикатор – феноловый красный (теофиллин, теобромин), бромтимоловый синий (рибофлавин).
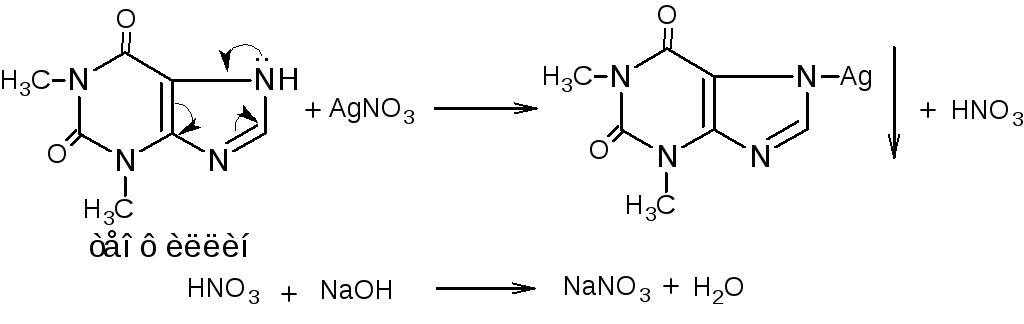
fэкв (теофиллина)=1
3. Ацидиметрический метод нейтрализации (вытеснения). Используется для натриевых солей. Основан на сильных основных свойствах натриевых солей барбитуратов и сульфаниламидов. Титрант – раствор кислоты хлороводородной. Индикатор – метиловый оранжевый.
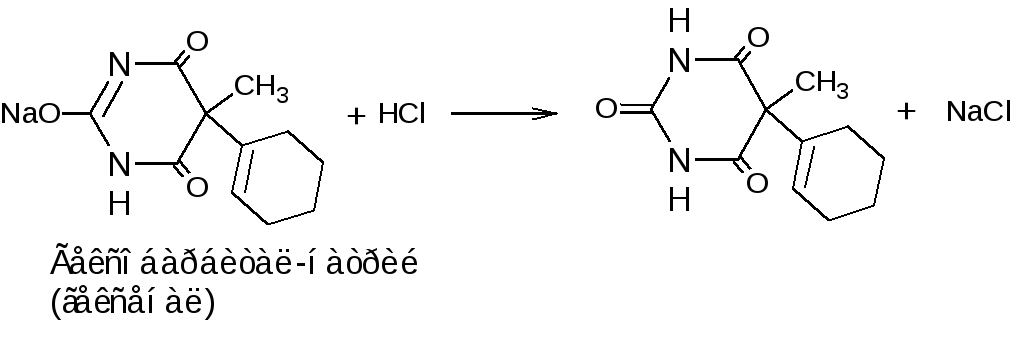
fэкв (гексенала)=1
Третичный и четвертичный атом азота

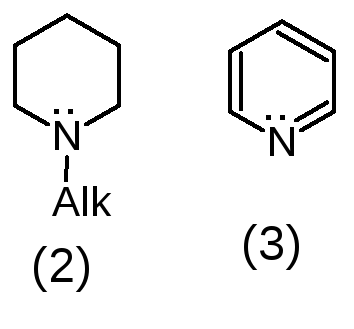
Третичный алифатический атом азота
(третичная аминогруппа).
Третичный атом азота в гетероцикле.
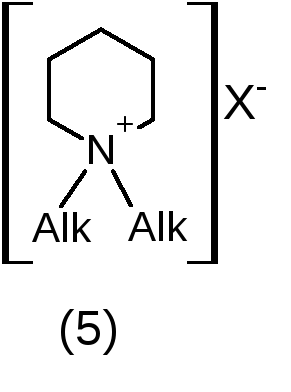
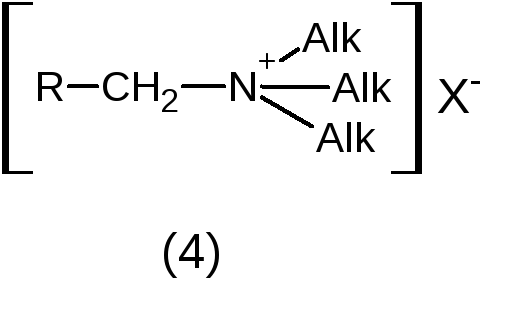 Четвертичный
атом азота или
Четвертичный
атом азота или
четвертичное аммониевое основание
(ЧАО) в виде соли.
Химические свойства
1. Кислотно – основные: проявляют основные свойства за счет неподеленной электронной пары третичного атома азота или положительного заряда на четвертичном атоме азота. Сила основных свойств зависит от характера атома азота, строения гетероцикла и природы радикалов, связанных с атомом азота. ЧАО (примеры 4 и 5) проявляют очень сильные основные свойства, полностью ионизированы в водных растворах. Их соли с неорганическими кислотами имеют нейтральную реакцию среды. Третичные алифатические амины (1) и соединения, содержащие полностью гидрированный гетероцикл с алкильным радикалом у атома азота (2), являются сильными основаниями (рКа 9-11). Гетероциклические соединения с ароматическим кольцом (3) проявляют слабые основные свойства (рКа от 0 до 5,5 в зависимости от характера гетероцикла). Сильные основания (с рКа 9-11) образуют устойчивые соли с кислотами (минеральными и органическими), слабые основания – только с минеральными кислотами, соли неустойчивы.
Реакции подлинности
Реакции соле- и комплексообразования: протекают по типу ионного обмена. В реакцию вступают соли органических оснований. Введение дополнительного количества минеральной кислоты способствует количественному протеканию реакции. Реагенты: соли неорганических кислот – аммония тиоцианат, калия дихромат, калия иодид; органические кислоты – пикриновая, щавелевая, танин; соли комплексных кислот – калия тетрайодо (III) висмутат K[BiI4], аммония тетратиоцианато (II) цинкат (NH4)2[Zn(SCN)4], аммония тетратиоцианато (II) кобальтат аммония (NH4)2[Co(SCN)4], тетратиоцианатодиаммин (III) хромат (аммония рейнекат) NH4[Cr (NH3)2 (SCN)4]; раствор йода в калия йодиде K[I3] или I2 + KI и другие. Эффект реакции – образование труднорастворимых в воде соединений. Окраска определяется цветом лекарственного вещества и реагента. Осадки могут иметь характерную температуру плавления или форму кристаллов.
П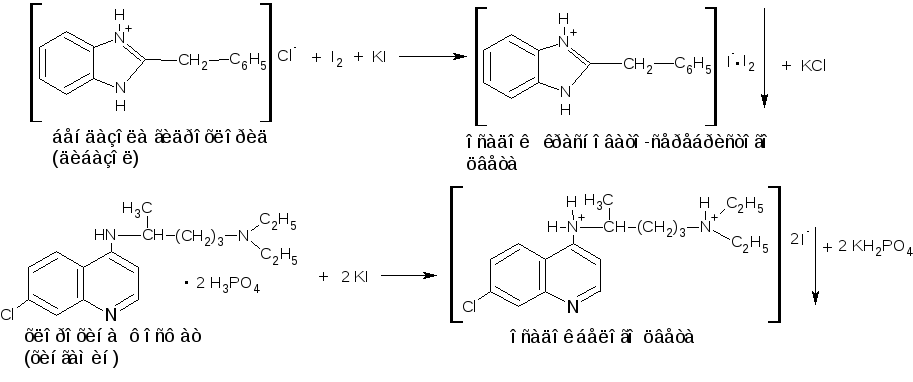 римеры:
римеры:
Реакция протекает по вторичной и третичной аминогруппе, проявляющих более сильные основные свойства, чем атом азота гетероцикла.
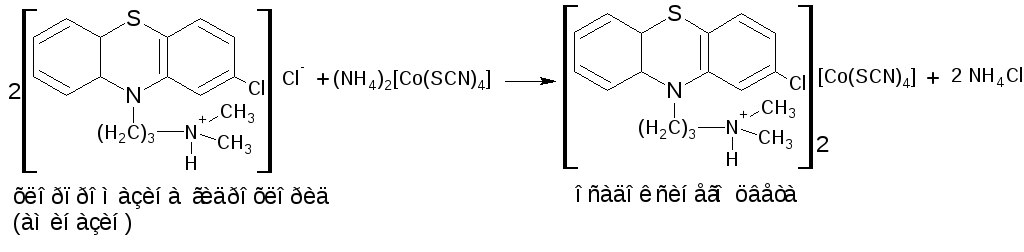
Методика. К 1 капле 1% раствора вещества (бендазола гидрохлорида (дибазола), кофеина, прокаина гидрохлорида (новокаина), папаверина гидрохлорида) прибавляют 4-5 капель кислоты хлороводородной, 2-3 капли раствора одного из реактивов (I2 в KI, KBiI4, K2Cr2O7, (NH4)2[Co(SCN)4], пикриновая кислота), наблюдают эффект реакции. Результаты заносят в таблицу.
