
- •Карбоксильная группа
- •Реакции подлинности
- •Количественное определение
- •Сложноэфирная и амидная группы
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Азометиновая группа
- •Первичная алифатическая аминогруппа
- •Количественное определение
- •Ароматическая нитрогруппа Химические свойства
- •Количественное определение
- •Вторичная аминогруппа Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Вторичная аминогруппа в составе имидной, сульфамидной, гидразидной функциональных групп и в некоторых гетероциклических соединениях
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Третичный и четвертичный атом азота
- •Химические свойства
- •Реакции подлинности
- •Количественное определение
- •Ковалентно связанный галоген
- •Подлинность
- •Количественное определение
- •Ковалентно связанная сера
- •Подлинность
- •Ковалентно связанный азот
 -Кетольная
группа
-Кетольная
группа
Содержит расположенные рядом первичную спиртовую и кетонную группы.
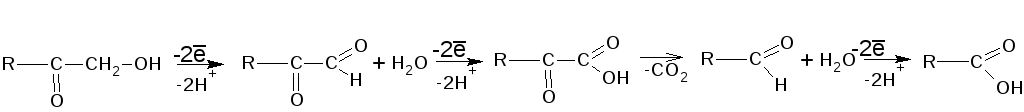 Вследствие
возникающей системы сопряжения
электронов, -кетольная
группа обладает сильными восстановительными
свойствами (более сильными, чем у обычных
первичных спиртов и кетонов). Окисляется
теми же реагентами, что и альдегиды (см.
«Альдегиды», п. 1.) Окисление протекает
по схеме:
Вследствие
возникающей системы сопряжения
электронов, -кетольная
группа обладает сильными восстановительными
свойствами (более сильными, чем у обычных
первичных спиртов и кетонов). Окисляется
теми же реагентами, что и альдегиды (см.
«Альдегиды», п. 1.) Окисление протекает
по схеме:
Примеры ЛВ, содержащих -кетольную группу: кортизон, гидрокортизон, дезоксикортикостерон, преднизолон и др.
Карбоксильная группа
Химические свойства
 1. Кислотно-основные.
Карбоксильная группа проявляет достаточно
сильные кислотные свойства. рКа кислот
около 4,7 – 4,8. Длина радикала практически
не влияет на силу кислотных свойств.
Введение в углеводородный радикал или
цикл электроноакцепторных заместителей
(галогены, гидроксильная группа,
нитрогруппа, дополнительная карбоксильная
группа) заметно повышает (на 1 – 2 – 3
единицы рКа) кислотность карбоксильной
группы.
1. Кислотно-основные.
Карбоксильная группа проявляет достаточно
сильные кислотные свойства. рКа кислот
около 4,7 – 4,8. Длина радикала практически
не влияет на силу кислотных свойств.
Введение в углеводородный радикал или
цикл электроноакцепторных заместителей
(галогены, гидроксильная группа,
нитрогруппа, дополнительная карбоксильная
группа) заметно повышает (на 1 – 2 – 3
единицы рКа) кислотность карбоксильной
группы.
В растворе карбоксильная группа подвергается ионизации, образуется карбоксилат-ион (анион соответствующей кислоты) и протон. Карбоксилат-ион проявляет основные свойства (является слабым основанием). Карбоновые кислоты образуют соли при взаимодействии с гидроксидами, карбонатами и гидрокарбонатами щелочных металлов (калия и натрия) и аммония. Эти соли, как правило, легко растворимы в воде, бесцветны. Карбоксильная группа в анионной форме (т.е. в виде соли) реагирует с солями тяжелых металлов (меди, железа, кобальта). Эффект реакции - образование трудно растворимых в воде солей. Окраска определяется цветом лекарственного вещества и реагента. Соли меди окрашены в сине-зеленый цвет, железа – желто-розовый, кобальта – в розовый.

2.Этерификация со спиртами (см. "Спиртовый гидроксил", п.1).
Реакции подлинности
1. Реакция образования сложных эфиров (этерификации).
Методика. Около 0,02 г лекарственного вещества (калия ацетата, кислоты бензойной, кислоты ацетилсалициловой, кислоты никотиновой) помещают в сухую пробирку, прибавляют 2 капли 95% спирта, 5 капель концентрированной серной кислоты и смесь осторожно нагревают; ощущается запах сложных эфиров.
2. Реакции с солями тяжёлых металлов.
Особенности проведения реакций:
Лекарственное вещество вступает в реакцию только в ионизированной форме, поэтому его сначала переводят в натриевую (или аммониевую) соль. Реакция среды должна быть близкой к нейтральной, поэтому щелочь берется в эквивалентном количестве (без избытка). В щелочной среде реагенты осаждаются в виде гидроксидов, с лекарственным веществом не реагируют.
Реакции этой группы малочувствительны, поэтому необходимо приготовить концентрированный раствор лекарственного вещества (как правило, 2-5%).
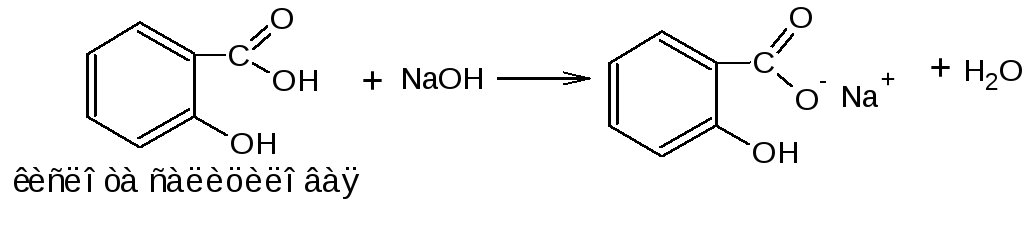
Методика. 2.1. Около 0,15 г лекарственного вещества (кислоты бензойной, кислоты никотиновой) взбалтывают с 3 мл раствора натрия гидроксида (0,1 моль\л), фильтруют (к фильтрату можно прибавить 1-2 мл воды). Фильтрат делят на две части. К первой части прибавляют 2 капли раствора железа (III) хлорида, ко второй – 2 капли раствора меди (II) сульфата; наблюдают эффект реакции.
2.2. Около 0,05 г лекарственного вещества (калия ацетата, кальция глюконата) растворяют в 2 мл воды, раствор делят на две части. Проводят реакции с указанными выше реагентами, наблюдают эффект реакции.
Количественное определение
1.Алкалиметрический метод нейтрализации. Основан на сильных кислотных свойствах карбоксильной группы. Титрант – раствор натрия гидроксида. Индикатор – фенолфталеин (интервал рН перехода цвета 8,2- 10,0, поэтому идеально подходит для титрования карбоновых кислот). Нерастворимые в воде лекарственные вещества предварительно растворяют в органическом растворителе (спирт этиловый, реже – ацетон).
fэкв (кислоты салициловой)=1
2. Определение натриевых и калиевых солей карбоновых кислот.
Карбоксилат-ион проявляет слабые основные свойства, поэтому применяется ацидиметрический метод. В водных растворах титруется трудно.
2.1. Метод кислотно-основного титрования в среде протогенного раство-
рителя, усиливающего слабые основные свойства карбоксилат-иона. Растворитель ледяная уксусная кислота, титрант – раствор кислоты хлорной в ледяной уксусной кислоте, индикатор – раствор кристаллического фиолетового в ледяной уксусной кислоте.
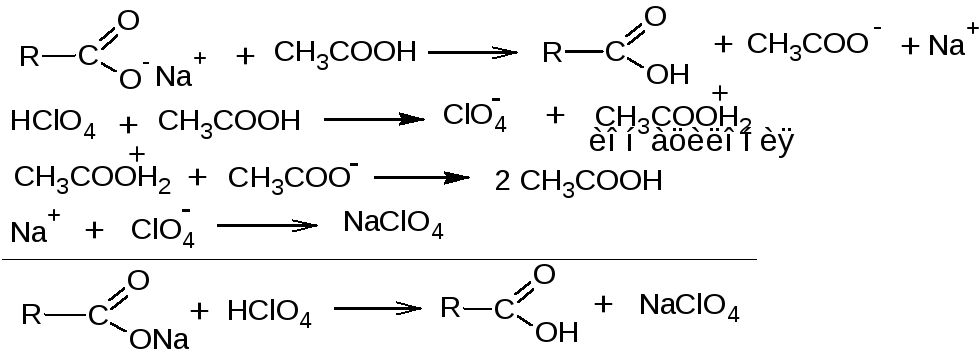
fэкв (вещества)=1/n, где n - количество карбоксилат-ионов в веществе.
2.2. Ацидиметрический метод нейтрализации (вытеснения). Используется для определения солей карбоновых кислот в экстемпорально изготовленных препаратах. Титрант – кислота хлороводородная. Индикаторы с интервалом рН перехода цвета около 2 (тимоловый синий, диметиловый желтый). При титровании в присутствии метилового оранжевого (рН 3,0 – 4,4) необходимо добавление эфира, который извлекает образующуюся карбоновую кислоту и тем самым сдвигает равновесие реакции вправо.
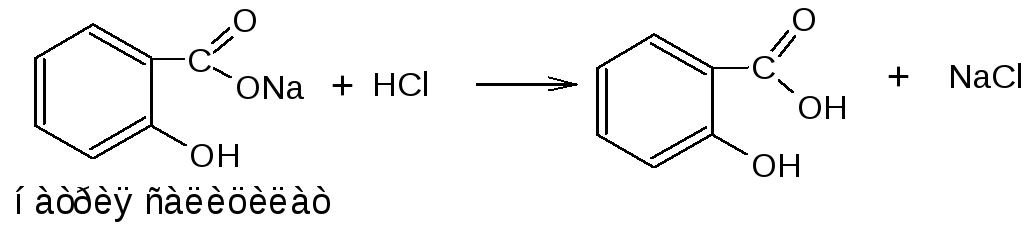
fэкв (натрия салицилата)=1
(рКа 2,89; при рН 3 будет оттитровано только 50% соединения; эфир извлекает кислоту салициловую, тем самым достигается практически 100% переведение соли в кислоту).
