
ИТОГ-КСЕ-ДО в PDF раздача 2015.pdf
.pdf
М3. УЕ 3.1. |
Естественнонаучная картина мира: основные концепции |
Свойства молекулы определяются:
1.Структурой молекулы. Наиболее простыми являются неорганические соединения. Органические соединения могут иметь сложную пространственную структуру и огромную массу. Например, атомы углерода могут соединяться в цепи по нескольку сот, и даже тысяч. Например, молекула полиэтилена со-
стоит из 20 000 звеньев СН2, а белковая молекула вируса табачной мозаики имеет молекулярную массу 40 млн.
2.Структурой атомов, из которых состоит молекула. Например, большой реакционной способность обладает кислород, в нем горит даже железо. Эта способность объясняется электронной конфигурацией атома. У кислорода внешняя электронная оболочка недозаполнена двумя электронами и поэтому кислород стремится захватить недостающие электроны у других атомов, отсюда большая реакционная способность. Свойства молекул определяют свойства и характеристики более высоких уровней организации материи.
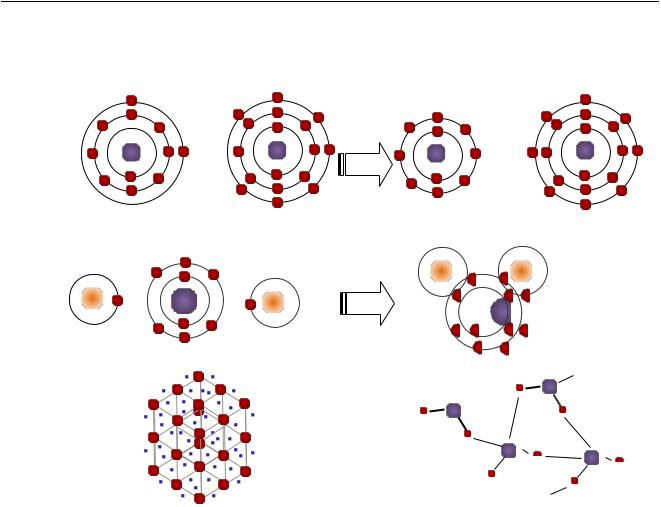
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, радикалы, кристаллы.
В общем случае химическая связь образуется, если полная энергия системы, состоящей из взаимодействующих атомов, при сближении атомов понижается. Природа химической связи, согласно современным представлениям, объясняется взаимодействием электрических полей, образуемых электронами и ядрами атомов, которые участвуют в образовании химического соединения. Поэтому более точно химическую связь можно определить, как взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
Различают три основных типа химической связи: ковалентную, ионную и металлическую13.
Ковалентная связь–тип химической связи между двумя атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Простейший пример ковалентной связи – образование молекулы водорода
Н2. Атом водорода имеет на внешнем энергетическом уровне один неспаренный электрон. При сближении двух атомов водорода происходит взаимодействие (обобществление) электронов с формированием общей электронной пары.
Ионная связь - химическая связь, образованная за счет электростатического взаимодействия ионов.
Металлическая связь обусловлена образованием электронами всех атомов вещества единого подвижного электронного облака.
Основными характеристиками химической связи являются ее длина, прочность и валентные углы, характеризующие строение веществ, которые образованы из отдельных атомов.
13 Рисунок http://elementy.ru/trefil/57
97
Гавриков Д.Е. |
М3. УЕ 3.1. |
Проблема химического соединения, так же, как и проблема химического элемента, решена в современной химии на основе представлений квантовой физики.
Ионная
связь
|
|
+ |
|
+ |
+ |
- |
Атом Na |
|
Атом Cl |
|
Ион Na+ |
|
Ион Cl- |
Ковалентная |
|
Атом O |
|
H |
H |
|
связь |
|
|
|
|||
|
|
|
|
|||
H + |
O |
+ H |
|
O |
Молекула воды |
|
|
|
|
|
(Н2О) |
||
|
|
Атом Н |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
Атом O |
|
|
|
|
|
|
|
Металлическая |
|
|
Водородная + |
|
+ |
|
|
|
|
|
|||
связь |
|
|
связь |
+ |
+ |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
+ |
|
+ |
|
|
|
|
|
Атом Н |
+ |
В. Проблема вовлечения и применения новых химических элементов в производство материалов
В настоящее время человечество выдвигает ряд требований к промышленной химии:
1.Приведение в соответствие практики использования химических элементов в производстве с их ресурсами в природе.
2.Последовательная замена металлов различными видами керамики.
3.Расширение производства так называемых элементоорганических соединений на базе органического синтеза.
Элементоорганические соединения обладают целым рядом ценных технических свойств. Например, кремнийорганические соединения обладают огнезащитными, водоотталкивающими, кислотоупорными, электроизоляционными
идр. свойствами. Фторорганические соединения обладают исключительной устойчивостью к очень агрессивным средам. Поэтому элементоорганические соединения широко используются в практике в качестве материала для протезов внутренних органов человека.
98

М3. УЕ 3.2. |
Естественнонаучная картина мира: основные концепции |
ВВЕДЕНИЕ В УЕ 3.2. Структурная и эволюционная химия
Цель изучения
1. Получить представления о сути структурной химии, учении о химическом процессе и об эволюционной химии.
Что Вы должны знать и уметь перед началом изучения
▪ знать химию в объеме школьной программы.
В результате изучения Вы будете знать
▪суть структурной химии, учения о химическом процессе и об эволюционной химии;
▪принципы управления химическим процессом;
▪суть теории саморазвития элементарных открытых каталитических систем.
Ход изучения
1.Прочитайте теоретическую часть УЕ 3.2.
2.Рассмотрите приведенные примеры (где приведены).
3.По ходу изучения отвечайте на вопросы (самоконтроль):
а) Что такое валентность?
б) Как протекают химические реакции, суть процесса?
в) Объясните основные принципы управления химическим процессом?
г) Что такое катализаторы и их роль в появлении эволюционной концепции химии?
д) Суть теории саморазвития каталитических систем?
ОСНОВНЫЕ ТЕРМИНЫ УЕ 3.2. Структурная и эволюционная химия
▪ Валентность (от лат. valens – имеющий силу) – способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
99

Гавриков Д.Е. |
М3. УЕ 3.2. |
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ УЕ 3.2. Структурная и эволюционная химия
II. Структурная химия
Речь идет об уровне развития химических знаний, при котором основную роль играет понятие структура.
В основе структурной химии лежит химическая атомистика Д. Дальтона, согласно которой любой химический индивид состоит из молекул, обладающих строго количественным и качественным составом. Более конкретные представления о структуре молекул содержатся в теории Берцелиуса, согласно которой структура молекулы возникает благодаря взаимодействию разноименно заряженных атомов или атомных групп. Дополняя это представление, Ш. Жерар отмечал, что при образовании структур различные атомы не просто взаимодействуют, но известным образом преобразуют друг друга, так что в результате возникает определенная целостность (система). Ф. Кекуле предпринял попытку раскрыть структуры молекул и синтезировать новые вещества. Он связал структуру с понятием валентности элемента.
Валентность (от лат. valens – имеющий силу) – способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. В соединениях, образованных при помощи ионных связей, валентность атомов определяется числом присоединённых или отданных электронов. В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся обобществленных электронных пар.
Особое значение для одного из направлений химии − органической химии − оказало предположение Кекуле о том, что в молекулах органических веществ атомы углерода способны соединяться друг с другом с помощью одной или нескольких своих связей, образуя длинные и разветвлении цепи.
Представления Кекуле были использованы Александром Михайловичем Бутлеровым в разработанной им теории строения органических соединений. Теория Бутлерова представляет собой дальнейший шаг эволюции в понятии химического строения органических соединений. Бутлеров, так же, как и Кекуле, признавал, что образование молекул из атомов происходит за счет «замыкания свободных единиц сродства», но он придавал особое значение пространственному расположению атомов в молекуле.
Теория валентности Кекуле и теория химического строения Бутлерова оказались мощным толчком и для развития органического синтеза. Осознанные и подкрепленные теорией исследования химиков привели к успешному получению новых органических веществ, таких как анилиновые красители, индиго, взрывчатые и лекарственные вещества, в том числе, аспирин, уротропин и другие. Этот период в истории химии называют триумфальным шествием органического синтеза: за вторую половину XIX в. число органических соединений возросло от полумиллиона до двух миллионов. Понятием структура теперь оказалось возможным объяснить огромное разнообразие синтезированных и выде-
100

М3. УЕ 3.2. |
Естественнонаучная картина мира: основные концепции |
ленных органических веществ растительного и животного происхождения, которые стал использовать человек.
Так было положено начало второму уровню развития химических знаний, который получил название структурная химия. На этой основе и возникли структурные формулы органической химии. Комбинируя атомы различных химических элементов по их валентности, можно прогнозировать получение различных химических соединений в зависимости от исходных реагентов, т.е. управлять процессом синтеза различных веществ с заданными свойствами.
Эволюция понятия химической структуры в истории химии осуществлялась в двух направлениях: анализа ее составных частей (элементов) и установления характера физико-химического взаимодействия между ними. Идеи об энергетической неэквивалентности химических связей, обусловленных взаимным влиянием атомов в структуре молекулы, являются главным содержанием понятия «структура» в теории Бутлерова. Теория химического строения A.M. Бутлерова нашла физические обоснования в квантовой механике.
По современным представлениям, структура молекул − это пространственная и энергетическая упорядоченность квантово-механической системы, состоящей из атомных ядер и электронов, обладающих единой молекулярной орбиталью. Вообще понятию «структура» в химии можно дать единое определение. Структура − это устойчивая упорядоченность качественно неизменной системы, каковой является молекула.
III. Основы учения о химических процессах
Понимание сущности химического процесса стало возможным лишь в конце XIX в., а современное представление о том, что такое химический процесс, сложилось в 1950-х гг.
В условиях Земли молекулы постоянно разрушаются и снова образуются. Если бы температура Земли была значительно выше, то многие молекулы никогда бы не образовались (атомы не могли бы оставаться друг возле друга), а если бы температура Земли была гораздо ниже, молекулы, соединяясь, образовали бы твердые тела и кристаллы и никакие изменения не происходили. Температура на Земле такова, что энергии достаточно для разрушения некоторых молекул, однако количество энергии не слишком велико, благодаря чему большинство соединений может существовать в течение какого-то времени.
Образование молекул может потребовать энергии извне (эндотермические реакции), но часто при их образовании энергия высвобождается (экзотермические реакции). Примером последних является горение угля или других веществ. Горение связано с образованием новых молекул и, следовательно, с выделением тепловой энергии. Как это происходит?
Углерод угля и кислород воздуха образуют углекислый газ – СО2. Уголь - это совокупность атомов углерода, расположенных в правильном порядке, т.е. кристалл углерода. Кислород воздуха состоит из молекул кислорода (О2). Поэтому химическая реакция горения угля имеет вид
С + О2 = СО2
101

Гавриков Д.Е. |
М3. УЕ 3.2. |
Эта реакция происходит в два этапа:
1.Сначала разрывается связь в молекуле О2. Этот этап требует затрат энергии. При обычных температурах тепловой энергии недостаточно для расщепления молекулы кислорода на два атома, как в тех случаях, когда уголь соприкасается с воздухом без горения. Но если подвести теплоту от зажженной спички или горящей щепки, то реакция начнется.
2.Затем два атома кислорода присоединяются к углероду. При образовании СО2 выделяется больше энергии, чем требуется для расщепления О2.
С + О2 ! С +О +О ! СО2
Поэтому энергия, необходимая для дальнейшего расщепления О2, поставляется самим процессом горения. Таким образом, при горении угля большая часть энергии выделяется в виде теплоты, а часть энергии, высвобождаемой на втором этапе, идет на инициирование дальнейших реакций. Полезная теплота равна избытку энергии, выделяющейся на втором этапе, над энергией, потребной для первого этапа.
Начавшись, образование диоксида углерода продолжается до тех пор, пока не израсходуется весь углерод. При этом выделяется большое количество теплоты. Нагревание столь сильно, что атомы и молекулы начинают испускать свет. Пламя, которое мы видим при горении угля, состоит из молекул СО2 и атомов углерода, выброшенных в результате сильного нагрева и испускающих излучение. Таким образом, пламя – это накаленная материя, полученная в химической реакции, в которой выделяется очень много энергии.
Горение угля - простейшая форма выделения химической энергии.
Для разрыва химической связи требуется некоторое количество энергии и такое же ее количество высвобождается при образовании связи. Таким образом, нужно затратить энергию, чтобы разделить молекулу на атомы, и энергия выделяется, когда атомы образуют молекулу. Эта энергия проявляется в различных формах, например, в виде колебаний. Когда атомы соединяются, образующаяся молекула начинает колебаться в результате сильного столкновения атомов. Вообще, когда атомы образуют молекулу, энергия высвобождается и обычно проявляется в форме движения, что эквивалентно теплоте. В некоторых особых случаях энергия связи не превращается в теплоту: химические реакции присоединения происходят таким образом, что энергия, выигранная при образовании молекул, передается молекулам другого рода, т.е. энергия образования молекулы запасается в другой молекуле, а не растрачивается в виде теплоты. Этот случай важен для поддержания жизни.
Химические реакции, производящие энергию, всегда начинаются с превращения молекул со слабыми связями в молекулы с прочными связями; при этом высвобождается разница в энергиях сильной и слабой связи. Молекулы СО2 и воды имеют прочные связи; то же можно сказать о большинстве молекул, в которых атомы связаны с кислородом. Молекулы, содержащие углерод и водород, связаны слабо, они легко разрушаются и рекомбинируют, могут образовывать длинные цепи и способны объединяться в сложные структуры. Если их
102

М3. УЕ 3.2. |
Естественнонаучная картина мира: основные концепции |
слабые связи превращаются в сильные связи с кислородом в результате какоголибо сложного процесса, то выделяется энергия. Благодаря этим свойствам они играют важную роль в живой материи.
Принципы управления химическим процессом
Основная проблема в учении о химических процессах связана с тем, что многие химические реакции были и остаются трудноуправляемыми. Одни из них пока не удается осуществить, хотя в принципе они выполнимы. Другие сложно остановить, например, реакцию горения и взрывы. Трудности управления третьими обусловлены тем, что в их процессе самопроизвольно создается множество непредвиденных ответвлений с образованием побочных продуктов.
Суть проблемы заключается в следующем. Каждая химическая реакция обратима и представляет собой перераспределение химических связей. Обратимость служит основанием равновесия между прямой и обратной реакциями. Однако на практике равновесие смещается в ту или иную сторону в зависимости от природы реагентов и условий процесса. Реакции, в которых равновесие смещено вправо, то есть в сторону образования целевых продуктов, обычно не требуют особых средств управления. Таковы реакции кислотно-основного взаимодействия, или нейтрализации, а также реакции, сопровождающиеся удалением готовых продуктов в виде газов или осадков.
Однако немало реакций происходит со смещением равновесия влево. Для их осуществления требуется особое термодинамическое управление. Такова, в частности, реакция синтеза аммиака:
N2 + 3H2 " NH3
Эта реакция очень проста с точки зрения состава и структуры исходных веществ. Но на протяжении XIX в. попытки ее осуществления приводили к неудачам. В настоящее время решение проблемы управления химическими процессами продвинулось далеко вперед. Среди основных методов управления ими выделяют термодинамические и кинетические (в первую очередь каталитические).
Основы теории термодинамических методов управления химическими процессами были заложены в конце XIX в. в рамках химической термодинамики, которая изучает химические превращения на основе представления о термодинамическом равновесии в макроскопических системах. Химическая термодинамика включает учения о химическом равновесии, растворах, фазовых переходах и процессах на границе раздела фаз. В их основу положены идеи нидерландского ученого Я.Х. Вант-Гоффа, установившего зависимость направления химической реакции от изменения температуры и теплового эффекта реакции, а также принцип подвижного равновесия французского исследователя А.Л. Ле Шателье, согласно которому каждая реакция обратима, но равновесие смещается в зависимости от природы реагентов и условий процесса. Таким образом, основными рычагами управления реакцией служат температура, давление и концентрации реагирующих веществ.
103

Гавриков Д.Е. |
М3. УЕ 3.2. |
В настоящее время термодинамические соотношения широко применяют для определения максимально возможного (при данных температуре, давлении и т.п.) выхода продуктов химических реакций и прочих параметров технологических процессов в химической, металлургической и других отраслях промышленности. Использование понятий и методов термодинамики неравновесных процессов позволяет оценивать потоки теплоты и вещества для открытых систем с учетом скоростей химических превращений, но влиять только на направленность.
Кинетические (в первую очередь каталитические) методы дают возмож-
ность влиять и на скорость химических процессов. Эти методы активно развиваются в рамках химической кинетики - учения о скоростях и механизмах химических реакций, надежной основы создания новых и совершенствования существующих процессов химической технологии: горения, гетерогенного катализа, электрохимических процессов и др. Методы химической кинетики используются в биологии и других областях естествознания. С их помощью удается добиться изменения хода процессов при изменении структурнокинетических факторов: строения исходных реагентов, их концентрации, наличия в реакторе катализаторов (веществ, ускоряющих химические реакции), ингибиторов (веществ, замедляющих реакции) и других добавок, способов смешения реагентов, материала и конструкции реакторов и т.д.
К наиболее важным кинетическим методам относится ускорение химической реакции в присутствии катализаторов - катализ. Катализаторы взаимодействуют с реагентами, но в реакции не расходуются и не входят в состав продуктов. Катализ был открыт в 1812 г. российским ученым К.Г.С. Кирхгофом, который получил сахар с помощью катализатора (серной кислоты) из крахмала. Различают гомогенный катализ, когда исходные реагенты и катализатор находятся в одной фазе (газовой или жидкой), и гетерогенный, когда газообразные или жидкие реагенты взаимодействуют на поверхности твердого катализатора. Катализ обусловливает высокие скорости реакций при небольших температурах. Каталитические реакции являются основой многих химикотехнологических процессов (например, производства серной кислоты, некоторых полимеров, аммиака). Большинство процессов, происходящих в живых организмах, также являются каталитическими (или ферментативными, так как биологические катализаторы называются ферментами)14.
IV. Эволюционная концепция в химии. «Предбиология»
Эволюционная химия зародилась в 1950-1960 гг. Природа в процессе эволюции живых организмов создала своеобразные химические технологии необычайной эффективности. При изучении химизма живой природы биохимией и молекулярной биологией было установлено, что состав и структура биополимерных молекул представляют собой единый набор для всех живых существ, вполне доступный для исследования физическими и химическими методами. С
14 Бондарев В.П. Концепции современного естествознания: Учебное пособие для студентов вузов. - М.: Альфа, 2003. - 464 с.
104

М3. УЕ 3.2. |
Естественнонаучная картина мира: основные концепции |
другой стороны, было установлено, что в живых системах осуществляются такие типы химических превращений, какие никогда не обнаруживались в неживом мире.
Важнейшее значение в современной химии придается проблеме поиска эффективных катализаторов для множества процессов химической технологии. Между тем, давно уже было установлено, что основой химии живого являются каталитические химические реакции, т.е. биокатализ. Химизм живой природы являлся идеалом для исследователей: «Подражание живой природе есть химизм будущего!» Этот девиз, который был провозглашен академиком А.Е. Арбузовым в 1930 г., является целеполагающей идеей развития эволюционной концепции в химии.
Интенсивные исследования последнего времени направлены на выяснение механизмов химических превращений, присущих живой материи. Химиковоргаников интересуют перспективы синтеза сложных веществ, аналогов органических соединений, образующихся в живых организмах; биологов − вещественная и функциональная основы жизнедеятельности; исследователи-медики пытаются выяснить биохимические границы между нормой и патологией в организме. Объединяет все эти работы концептуальное представление о ведущей роли ферментов, биорегуляторов в процессе жизнедеятельности. Эта идея, предложенная великим французским естествоиспытателем Луи Пастером в XIX в., остается основополагающей и сегодня.
Изучив принципы, заложенные эволюцией в химизм живой природы, можно использовать их для развития химической науки и технологии. Чрезвычайно плодотворным с этой точки зрения является исследование ферментов и раскрытие тонких механизмов их действия. Ферменты − это белковые молекулы, синтезируемые живыми клетками. В каждой клетке имеются сотни различных ферментов. С их помощью осуществляются многочисленные химические реакции, которые благодаря каталитическому действию могут идти с большой скоростью при температурах, подходящих для данного организма, то есть в пределах, примерно, от 5 до 40°С. Чтобы эти реакции протекали вне организма, потребовалась бы их активация за счет высокой температуры или иных факторов активации. Для живой клетки такие условия означали бы гибель. Следовательно, ферменты можно определить как биологические катализаторы. Биокатализаторы обладают высокой селективностью (избирательностью) − один фермент катализирует обычно только одну реакцию. По принципу биокатализаторов будут созданы искусственные катализаторы. Биокатализ нельзя отделить от проблемы биогенеза (происхождения жизни), какой бы трудной она ни являлась. Задача изучения и освоения всего многообразия каталитических процессов в живой природе − это пролог эволюционной химии. Уже обозначены основные подходы к освоению каталитического опыта живой природы.
Проблемы моделирования биокатализаторов показали необходимость детального изучения химической эволюции, то есть установления закономерностей самопроизвольного (без участия человека) синтеза новых химических соединений, являющихся к тому же более высокоорганизованными продуктами
105

Гавриков Д.Е. |
М3. УЕ 3.2. |
по сравнению с исходными веществами. В 1960-х гг. было обнаружено явление самосовершенствования катализаторов в ходе реакции (тогда как обычно, катализаторы в процессе их работы дезактивировались, ухудшались и выбрасывались). Речь идет о проявлении самоорганизации в химическом процессе. Здесь понятие «самоорганизация» означает такое изменяющееся состояние химической системы, которому присущи более высокие уровни сложности и упорядоченности. Проблема биологической самоорганизации (и биологической эволюции) самым непосредственным образом связана с проблемой химической самоорганизации (и химической эволюции). Одна из задач эволюционной химии – понять, как из неорганической материи возникает жизнь.
Под эволюционными проблемами в химии понимают процессы самопроизвольного синтеза новых химических соединений, являющихся более сложными и высокоорганизованными продуктами по сравнению с исходными веществами. Поэтому эволюционную химию − науку о самоорганизации и саморазвитии химических систем − считают предтечей биологии.
Все процессы, происходящие в живом организме, можно изложить на языке химии в виде конкретных химических процессов.
Основой исключительной эффективности биологических процессов является биокатализ. Поэтому новая химия должна основываться на каталитическом опыте живой природы.
Для освоения каталитического опыта живой природы перспективным направлением являются исследования, ориентированные на применение принципов биокатализа в химии и химической технологии, что предполагает изучение закономерностей живой природы, в том числе и опыта формирования фермента, клетки, организма. Здесь и заложены основы эволюционной химии, предполагающей пути новых химических технологий, способных стать аналогами живых систем.
Эволюционная химия − это новое управление химическими процессами, предполагающее применение принципов синтеза себе подобных молекул. По принципу ферментов создадутся катализаторы с таким разнообразием качеств, которые далеко превзойдут катализаторы, существующие в химической промышленности.
Возникновению эволюционной химии способствовали исследования в области моделирования биокатализаторов и реально ощутимые успехи «нестационарной кинетики» или динамики химических систем.
Ведущее положение в развитии нестационарной кинетики занимает теория саморазвития открытых каталитических систем, способствующая существенному улучшению свойств катализаторов.
Теория саморазвития элементарных открытых каталитических систем
Теория саморазвития элементарных открытых каталитических систем была разработана в 1964 г. А.Л. Руденко.
106
