
- •Виконуючи наступні лабораторні роботи, студенти повинні набути такі практичні навички:
- •"Гідроліз солей"
- •Хід роботи
- •Хід роботи
- •"Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції"
- •Хід роботи
- •Експериментальні дані
- •Обробка експериментальних даних
- •Експериментальні дані
- •Обробка експериментальних даних
- •"Адсорбція ацетатної кислоти на активованому вугіллі"
- •Експериментальні дані
- •"Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції"
- •За допомогою методу тонкошарової хроматографії"
- •"Одержання, очищення та властивості колоїдних розчинів"
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмова робота
"Одержання, очищення та властивості колоїдних розчинів"
Особливі властивості колоїдних розчинів зумовлені перш за все тим, що вони за розміром частинок дисперсної фази займають проміжне становище між істинними розчинами та грубо дисперсними системами.
Один із методів приготування колоїдних розчинів –метод хімічної конденсації. Золі очищують від домішок низькомолекулярних речовин в діалізаторі. Знак заряду колоїдних частинок визначають за допомогою електрофорезу.
ДОСЛІД 1. Одержання золю гідроксиду заліза
Наповнити бюретку розчином хлориду заліза (ІІІ) з масовою часткою 0,02.
Внести до колбочки за допомогою мірного циліндра 20мл дистильованої води та за допомогою бюретки – 2мл розчину ферум(ІІІ) хлориду.
Кип’ятити розчин на електричній плитці із закритою спіраллю до появи червоно-бурого забарвлення. Золь охолодити під струменем водопровідної води.
Рівняння реакції: _________________________________________________________
________________________________________________________________________
________________________________________________________________________
Формула міцели із зазначенням її складових частин (потенціал визначальними іонами є іони FeO+):
ДОСЛІД 2. Очищення золю методом діалізу
Склянку ємністю 50мл заповнити за допомогою мірного циліндра дистильованою водою на 1/3 її об’єму.
Налити в діалізатор золь ферум(III)гідроксиду та занурити його в склянку з водою.
Через 30хвилин за допомогою піпетки відібрати із склянки та перенести до пробірки 1-2мл рідини.
Додати до рідини за допомогою крапельниці 5-6 крапель розчину аргентум нітрату.
Спостереження_________________________________________________________
Рівняння реакції_________________________________________________________
Висновки ______________________________________________________________.
ДОСЛІД 3. Одержання аргентум йодиду
Заповнити одну бюретку розчином калій йодиду з молярною концентрацією 0,02моль/л,а другу - розчином аргентум нітрату з молярною концентрацією 0,01моль/л.
Перенести з бюретки до пробірки 10мл розчину калій йодиду.
Додати з бюретки до пробірки 1мл розчину аргентум нітрату.
Спостереження:
а) забарвлення розчину в світлі, що проходить крізь нього (розмістити пробірку з золем між джерелом світла (вікном) і спостерігачем на рівні очей):__________________________________________________________________
б) забарвлення золю у відбитому світлі (спостерігати забарвлення золю збоку)__________________________________________________________________
Рівняння реакції: _________________________________________________________
Формула міцели із зазначенням її складових частин:
ДОСЛІД 4. Отримання золей берлінської лазурі з різним зарядом частинок
Заповнити одну чисту бюретку розчином калій ексаціаноферату (ІІ) з масовою часткою 0,001, другу - розчином ферум(ІІІ) хлориду з масовою часткою 0,001.
У склянку з бюретки налити 10мл розчину ферум(ІІІ) хлориду та додати 3 краплі розчину калій гексаціаноферату(ІІ). Утворений золь не виливати!
Спостереження:_________________________________________________________
Рівняння реакції: _________________________________________________________
Формула міцели із зазначенням її складових частин:
У склянку з бюретки налити 10мл розчину калій гексаціаноферату(ІІ) і додати 3 краплі розчину ферум(ІІІ) хлориду.Утворений золь не виливати!
Спостереження:_________________________________________________________
Рівняння реакції: _________________________________________________________
Формула міцели із зазначенням її складових частин:
ДОСЛІД 5. Визначення знаку заряду колоїдних частинок методом електрофорезу
Заповнити за допомогою піпетки U-подібну трубку на три чверті її вмісту приготовленим в досліді 4 (п.2) колоїдним розчином.
Опустити електроди, з’єднані з блоком живлення, в обидва коліна трубки.
Підключити до мережі блок живлення.
Спостерігати на протязі однієї-двох хвилин за зміною забарвлення золю в обох колінах: біля аноду ________________, біля катоду____________________.
Визначити знак заряду колоїдних частинок за зміною забарвлення золю: __________________________________________________________________________________________________________________________________________
ЛАБОРАТОРНА РОБОТА №18
" ВИЗНАЧЕННЯ ПОРОГУ КОАГУЛЯЦІЇ"
Згідно з емпіричним правилом Шульце-Гарді поріг коагуляції зменшується зі збільшенням заряду іонів, що викликають коагуляцію. За ознакою помутніння розчину в пробірках при додаванні розчину коагулюючого електроліту визначають його найменшу молярну концентрацію еквівалента, здатну викликати коагуляцію золю.
Хід роботи
Заповнити одну бюретку розчином калій дихромату (с(
 К2Cr2O7)=2ммоль/л),
К2Cr2O7)=2ммоль/л),
а другу - розчином
калій гексаціаноферату(ІІІ) (с(![]() K3[Fe(CN)6])
=2ммоль/л).
K3[Fe(CN)6])
=2ммоль/л).
Перенести у дві пробірки за допомогою піпетки по 5мл золю ферум(ІІІ) гідроксиду.
Додати в одну з пробірок повільно, по краплях , добре перемішуючи, розчин калій дихромату, а в другу - розчин калій гексаціаноферату(ІІІ) до помутніння розчину (коагуляція золю).
Результати занести до таблиці.
Експериментальні дані
Таблиця
|
Електроліт |
с( ммоль/л |
V(Х), л |
Коагулюючий іон |
|
VК(Х), л/моль |
|
К2Cr2O7 |
|
|
|
|
|
|
K3[Fe(CN)6] |
|
|
|
|
|
Обробка експериментальних даних
Поріг коагуляції (в ммоль/л) обчислюють за формулою:
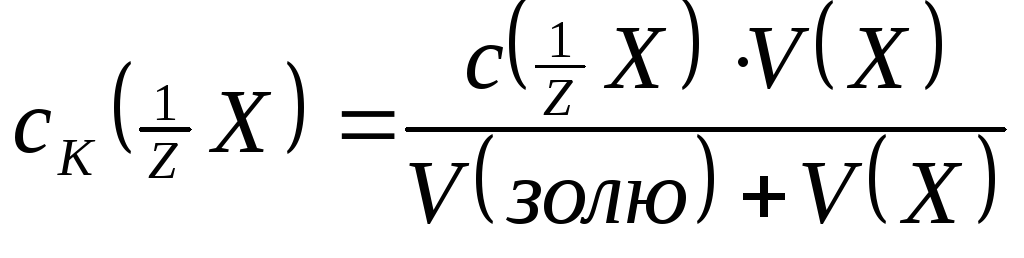 .
.
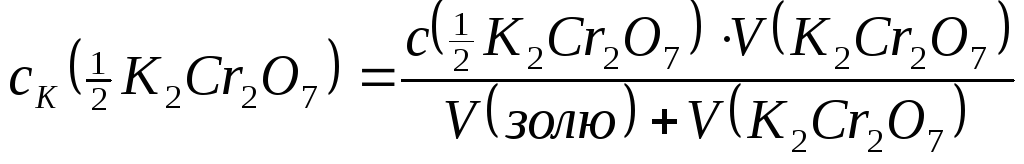 =
------------------------------------=
=
------------------------------------=
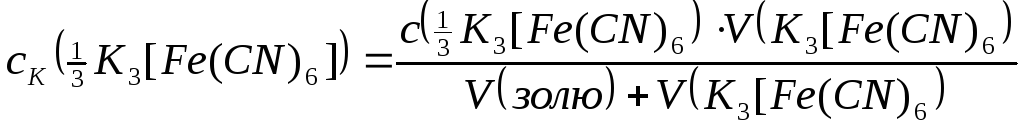 =
----------------------------------=
=
----------------------------------=
Коагулюючу здатність електролітів (в л/моль) знаходять за формулою:
![]() .
.
![]() =
-----------------------------------=
=
-----------------------------------=
![]() =
---------------------------=
=
---------------------------=
3. Обчислюють відносну коагулюючу здатність електролітів.
Висновок: коагулююча здатність K3[Fe(CN)6] в ________ разів ______________, ніж коагулююча здатність К2Cr2O7.
ЛАБОРАТОРНА РОБОТА № 19
"ВИЗНАЧЕННЯ "ЗАЛІЗНОГО ЧИСЛА" ЖЕЛАТИНУ"
Захисне число характеризує властивість високомолекулярної сполуки підвищувати стійкість гідрофобного золю. "Залізне число" желатину дорівнює мінімальній масі желатину, вираженій в міліграмах, здатній захистити 10мл золю ферум(ІІІ) гідроксиду від коагуляції при додаванні до нього 1мл розчину NaCl з масовою часткою 0,1.
"Залізне число" желатину визначають шляхом додавання до розчинів, що містять однакові об’єми ферум(ІІІ) гідроксиду і різні маси захищаючої речовини (желатину), рівних об’ємів розчину електроліту (NaCl). Для обчислення "залізного числа" береться середнє значення з розрахованих мас желатину в двох сусідніх пробірках, в одній з яких коагуляція виявлена, в попередній - відсутня.
Хід роботи
Заповнити три бюретки: одну – дистильованою водою, другу – розчином желатину з масовою часткою 0,01, третю – розчином натрій хлориду з масовою часткою 0,1.
У сім пробірок внести: в першу – 2мл розчину желатину, в останні шість – по 1мл дистильованої води
Перенести за допомогою піпетки з першої пробірки в другу 1мл розчину желатину (пробірку струсити), а потім 1мл розчину з другої пробірки перенести в третю, з третьої - в четверту і т.д., а з останньої пробірки 1мл розчину вилити в раковину.
У кожну з пробірок влити за допомогою мірного циліндра 10мл золю ферум(ІІІ) гідроксиду.
У кожну з пробірок внести з бюретки по 1мл розчину NaCl. Перемішати вміст пробірок.
Поставити пробірки у штатив і через 15хв відзначити, в якій з пробірок спостерігається помутніння (коагуляція).
Результати спостережень занести до таблиці, поставивши при цьому знак "+" там, де відбулася коагуляція, і знак "-" там, де вона відсутня.
Експериментальні дані
Таблиця
|
№ пробірки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Маса желатину, мг |
|
|
|
|
|
|
|
|
Помутніння |
|
|
|
|
|
|
|
Обробка експериментальних даних
Обчислюють масу желатину у першій пробірці (припускають, що густина розчину дорівнює 1г/см3):
m1(х)=
а потім у наступних пробірках:
![]()
"Залізне число" желатину обчислюють за формулою:
![]() ,
,
де m1(x) -маса желатину в попередній пробірці,
m2(x) - маса желатину у пробірці, де відбулася коагуляція.
S=----------------------------=
Висновок:"залізне число" желатину дорівнює____________________________
ЛАБОРАТОРНА РОБОТА №20
"ВИЗНАЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ ТОЧКИ (ІЕТ) АЛЬБУМІНУ СИРОВАТКИ КРОВІ"
Важливою характеристикою білка є його ізоелектрична точка - значення рН розчину, при якому максимальна кількість макромолекули білка знаходиться в ізоелектричному стані, в такому стані, при якому сумарний заряд макромолекул білка дорівнює нулю. ІЕТ можна визначити за найбільшим помутнінням розчинів білка з різними значеннями рН при додаванні до них водовіднімаючої речовини.
Хід роботи
В одну бюретку налити розчин водовіднімаючої речовини, а в другу - розчин альбуміну сироватки крові.
Наступні сім бюреток заповнити буферними розчинами, приготовленими з ацетатної кислоти і ацетату натрію (c0(CH3COOH)=с0(CH3COONa)=0,1 моль/л), взятих у співвідношеннях, що вказані в таблиці.
В сім пробірок налити із бюреток по 1мл наведених в таблиці ацетатних буферів.
В кожну пробірку налити з бюреток по 1мл розчину альбуміну сироватки крові і по 0,5мл розчину водовіднімаючої речовини. Пробірки енергійно струсити.
Через 5хв відзначити, в яких пробірках відбулося помутніння. Відзначити його знаком "+" у таблиці, знаком "-" відсутність помутніння.
Експериментальні дані
Таблиця
|
№ пробірки |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
V(CH3COONa), мл |
8 |
4 |
2 |
1 |
1 |
1 |
1 |
|
V(CH3COOН), мл |
1 |
1 |
1 |
1 |
2 |
4 |
8 |
|
Помутніння |
|
|
|
|
|
|
|
|
рН розчину |
|
|
|
|
|
|
|
|
Знак заряду макромолекули білка |
|
|
|
|
|
|
|
Обробка експериментальних даних
Обчислюють рН буферних розчинів за формулою:
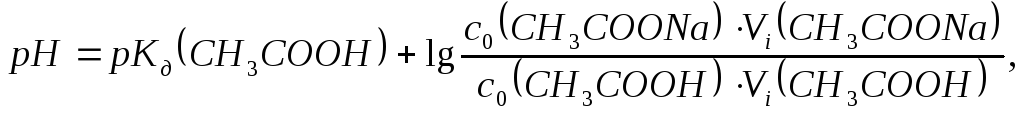
де Кд(СН3СООН)=1,75∙10-5моль/л.
![]() =
=
рН1= +lg-----------------------------= +lg =
рН2= +lg-----------------------------= +lg =
рН3= +lg-----------------------------= +lg =
рН4= +lg-----------------------------= +lg =
рН5= +lg-----------------------------= +lg =
рН6= +lg-----------------------------= +lg =
рН7= +lg-----------------------------= +lg =
Визначають ІЕТ альбуміну сироватки крові за найбільшим помутнінням розчину _________________________________________________.
Визначають знак заряду макромолекули альбуміну сироватки крові при кожному значенні рН _____________________________________.
Висновок: ІЕТ альбуміну сироватки крові дорівнює _______________.
Перелік практичних робіт та завдань для підсумкового контролю модуля 1:
Визначати наявність в розчині іонів СО32-, SО42-, NО2-. Написати рівняння відповідних реакцій.
Визначати наявність в розчині іонів МnO4–, Ag+. Написати рівняння відповідних реакцій.
Оцінювати комплексоутворюючу здатність іонів Ag+, Al3+, Cu2+. Написати рівняння відповідних реакцій.
Готувати розчини із заданою концентрацією шляхом розведення більш концентрованих розчинів.
На якому законі базуються розрахунки в титриметричному аналізі? Написати формули для розрахунку молярної концентрації еквівалента аналіту
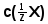 і маси аналіту m(X).
і маси аналіту m(X).Як і чому змінюється колір водного розчину фенолфталеїну при додаванні СН3СООН, NaOH?
Оцінити різницю в застосуванні фенолфталеїну та метилового червоного в методі кислотно-основного титрування. Аргументувати висновок.
Які робочі розчини необхідно використовувати для титрування наступних аналітів: H2SO4, NaOH, CH3COOH, NH3, HCl? Написати відповідні іонні та молекулярні рівняння реакцій; формули, за допомогою яких обчислюють молярну концентрацію еквівалента аналіту
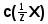 і масу аналіту m(X) згідно з даними
титрування. Як встановлюють точку
еквівалентності в кожному випадку?
і масу аналіту m(X) згідно з даними
титрування. Як встановлюють точку
еквівалентності в кожному випадку?Оцінювати водневий показник середовища в розчинах солей різного типу. Експериментально підтверджувати висновки щодо рН розчинів за допомогою рН–метра.
Обґрунтувати механізм дії фосфатного, гідрокарбонатного та амонійного буферних розчинів.
Обґрунтувати техніку приготування буферних розчинів із заданим рН. Яку формулу необхідно використати для розрахунку. Яким посудом потрібно користуватися. Як його підготувати до роботи?
Визначати ємність буферу за кислотою та лугом. Пояснити принцип потенціометричного методу визначення буферної ємності.
Оцінювати придатність розчинів фармацевтичних препаратів для їх введення в кров з позиції їх осмотичного тиску.
Перелік практичних робіт та завдань для підсумкового контролю модуля 2.
Визначати теплові ефекти реакції нейтралізації сильних та слабких кислот. Проводити порівняльний аналіз.
Оцінювати можливість самодовільного перебігу процесу.
Пояснювати механізм дії каталізаторів, в тому числі біологічних.
Оцінювати вплив зовнішніх факторів на хімічну рівновагу.
Оцінювати на основі розрахунків можливість утворення осаду.
Пояснювати принцип методу потенціометрії.
Які конкретні комбінації електродів треба взяти для визначення рН розчину потенціометричним методом?
Пояснювати принципову відмінність окисно-відновних електродів від електродів першого та другого родів.
Вимірювати окисно-відновний потенціал потенціометричним методом.
Оцінювати окисно-відновну здатність систем за величинами нормальних окисно-відновних потенціалів.
Прогнозувати напрямок окисно-відновних реакцій за величинами нормальних окисно-відновних потенціалів.
Оцінювати можливість застосування адсорбентів для конкретних цілей на основі ізотерм адсорбції.
Пояснювати принцип методу демінералізації води за допомогою іонообмінників.
Визначати кількісний вміст іонів в розчині фармацевтичного препарату за допомогою іонного обміну.
Розділяти суміш речовин за допомогою тонкошарової хроматографії. Пояснювати принцип методу.
Ідентифікувати амінокислоти за допомогою розподільчої хроматографії на папері. Пояснювати принцип методу.
Розділяти суміш катіонів за допомогою колонкової хроматографії. Пояснювати принцип методу.
Деякі лікарські препарати, наприклад коларгол, застосовуються в медицині у колоїдній формі. Золь ZnS одержали при зливанні однакових об’ємів розчинів (NH4)2S з молярною концентрацією 0,02 моль/л та ZnCl2 з молярною концентрацією 0,005 моль/л. Які іони утворюють дифузний шар?
Одержувати золі методом хімічної конденсації (реакції подвійного обміну, гідролізу).
Визначати знак заряду колоїдних часточок методом електрофорезу.
Очищати золі методом діалізу. Як цей метод використовується в медичній практиці?
Визначати вплив електролітів на процес коагуляції золей. Як розраховується поріг коагуляції та коагулююча здатність електролітів?
Пороги коагуляції золю електролітами NaCl та CaCl2 однакові. Який висновок можна зробити щодо заряду колоїдних частинок?
Розв’язання багатьох проблем у медицині пов’язане із застосуванням ліків, які будучи антикоагулянтами або коагулянтами, впливають на процеси згортання крові. Золь ферум(ІІІ) гідроксиду, частинки якого заряджені позитивно, коагулюють електролітами. Які з наведених електролітів мають найбільшу коагулюючу здатність?
А. калій хлорид;
В. натрій фосфат;
С. ферум (ІІ) сульфат;
Д. алюміній нітрат;
Е. алюміній карбонат.
Визначати "залізне число" желатину. Пояснювати принцип колоїдного захисту.
Визначати ізоелектричну точку альбуміну сироватки крові за помутнінням його розчину при додаванні водовіднімаючої речовини
