
- •Виконуючи наступні лабораторні роботи, студенти повинні набути такі практичні навички:
- •"Гідроліз солей"
- •Хід роботи
- •Хід роботи
- •"Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції"
- •Хід роботи
- •Експериментальні дані
- •Обробка експериментальних даних
- •Експериментальні дані
- •Обробка експериментальних даних
- •"Адсорбція ацетатної кислоти на активованому вугіллі"
- •Експериментальні дані
- •"Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції"
- •За допомогою методу тонкошарової хроматографії"
- •"Одержання, очищення та властивості колоїдних розчинів"
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмова робота
ЗМІСТ
|
№ роботи |
Назва лабораторної роботи |
Стор. |
|
1 |
ХАРАКТЕРНІ РЕАКЦІЇ ІОНІВ ДЕЯКИХ МАКРОЕЛЕМЕНТІВ ТА МІКРОЕЛЕМЕНТІВ |
2 |
|
2 |
Комплексні сполуки |
3 |
|
3 |
ПРИГОТУВАННЯ РОЗЧИНУ КОБАЛЬТ (ІІ) НІТРАТУ РОЗБАВЛЕННЯМ БІЛЬШ КОНЦЕНТРОВАНОГО РОЗЧИНУ |
4 |
|
4 |
ГІДРОЛІЗ СОЛЕЙ |
5 |
|
5 |
ВИЗНАЧЕННЯ МОЛЯРНОЇ КОНЦЕНТРАЦІЇ ЕКВІВАЛЕНТА НАТРІЙ ГІДРОКСИДУ ЗА ТИТРОВАНИМ РОЗЧИНОМ СУЛЬФАТНОЇ КИСЛОТИ |
7 |
|
6 |
ПРИГОТУВАННЯ БУФЕРНИХ РОЗЧИНІВ І ВИВЧЕННЯ ЇХ ВЛАСТИВОСТЕЙ |
8 |
|
7 |
ВИЗНАЧЕННЯ БУФЕРНОЇ ЄМНОСТІ АЦЕТАТНОГО БУФЕРНОГО РОЗЧИНУ |
11 |
|
8 |
ВИЗНАЧЕННЯ ТЕПЛОТ НЕЙТРАЛІЗАЦІЇ |
12 |
|
9 |
ДОСЛІДЖЕННЯ ЗАЛЕЖНОСТІ ШВИДКОСТІ РОЗКЛАДУ ТІОСУЛЬФАТНОЇ КИСЛОТИ ВІД ЇЇ МОЛЯРНОЇ КОНЦЕНТРЦІЇ |
14 |
|
10 |
ДОБУТОК РОЗЧИННОСТІ, УМОВИ УТВОРЕННЯ ОСАДУ |
16 |
|
11 |
ВИЗНАЧЕННЯ НОРМАЛЬНОГО ОКИСНО-ВІДНОВНОГО ПОТЕНЦІАЛУ |
18 |
|
12 |
АДСОРБЦІЯ АЦЕТАТНОЇ КИСЛОТИ НА АКТИВОВАНОМУ ВУГІЛЛІ |
20 |
|
13 |
КІЛЬКІСНЕ ВИЗНАЧЕННЯ ІОНІВ КАЛЬЦІЮ У РОЗЧИНІ МЕТОДОМ ІОНООБМІННОЇ АДСОРБЦІЇ |
22 |
|
14 |
РОЗДІЛЕННЯ СУМІШІ АМІНОКИСЛОТ ЗА ДОПОМОГОЮ РОЗПОДІЛЬЧОЇ ХРОМАТОГРАФІЇ НА ПАПЕРІ |
23 |
|
15 |
РОЗДІЛЕННЯ СУМІШІ БАРВНИКІВ ЗА ДОПОМОГОЮ МЕТОДУ ТОНКОШАРОВОЇ ХРОМАТОГРАФІЇ |
25 |
|
16 |
РОЗДІЛЕННЯ СУМІШІ КАТІОНІВ ЗАЛІЗА(ІІІ) І КУПРУМУ(ІІ) ЗА ДОПОМОГОЮ АДСОРБЦІЙНОЇ КОЛОНКОВОЇ ХРОМАТОГРАФІЇ |
26 |
|
17 |
ОДЕРЖАННЯ, ОЧИЩЕННЯ ТА ВЛАСТИВОСТІ КОЛОЇДНИХ РОЗЧИНІВ |
26 |
|
18 |
ВИЗНАЧЕННЯ ПОРОГУ КОАГУЛЯЦІЇ |
29 |
|
19 |
ВИЗНАЧЕННЯ "ЗАЛІЗНОГО ЧИСЛА" ЖЕЛАТИНУ |
30 |
|
20 |
ВИЗНАЧЕННЯ ІЗОЕЛЕКТРИЧНОЇ ТОЧКИ (ІЕТ) АЛЬБУМІНУ СИРОВАТКИ КРОВІ |
31 |
|
|
Перелік практичних робіт та завдань для підсумкового контролю модуля 1 |
33 |
|
|
Перелік практичних робіт та завдань для підсумкового контролю модуля 2 |
34 |
Виконуючи наступні лабораторні роботи, студенти повинні набути такі практичні навички:
Ідентифікувати наявність деяких мікро- та макроелементів у розчинах.
Готувати розчини із заданою концентрацією.
Оцінювати рН середовища розчинів солей
Кількісно визначати вміст речовин (кислот, основ, солей) у розчині методом кислотно-основного титрування.
Готувати буферні розчини із заданим рН.
Вимірювати рН розчинів за допомогою рН-метрів.
Визначати буферну ємність буферних розчинів.
Визначати теплові ефекти реакції нейтралізації.
Вимірювати окисно-відновний потенціал потенціометричним методом.
Визначати кількісний вміст іонів в розчині за допомогою іонного обміну.
Ідентифікувати амінокислоти за допомогою розподільчої хроматографії на папері
Розділяти суміш катіонів за допомогою колонкової хроматографії
Одержувати золі методом хімічної конденсації
Визначати знак заряду колоїдних часточок методом електрофорезу
Визначати "залізне число" желатину.
Лабораторна робота №1
“ХАРАКТЕРНІ РЕАКЦІЇ ІОНІВ ДЕЯКИХ МАКРО – ТА МІКРОЕЛЕМЕНТІВ”
Техніка виконання реакцій.
Для проведення реакції в пробірку вносять за допомогою піпеток вказаний в інструкції об’єм розчинів, стежачи за тим, щоб кінчик піпетки не торкався стінки пробірки. Піпетку слід повертати у ту склянку, з якої відбирали розчин для досліду.
Дослід 1. Реакція карбонат-іонів
У пробірку внести 5-7 крапель розчину Nа2СО3, додати 5-7 крапель розчину соляної кислоти.
Спостереження: ________________________________________________________
Написати рівняння реакції, враховуючи, що сильна кислота витісняє із солі слабку нестійку карбонатну кислоту:
________________________________________________________________________
_______________________________________________________________________
Дослід 2.Реакція сульфат-іонів
У пробірку внести 5-7 крапель розчину натрій сульфату додати 2-3 краплі розчину барій хлориду.
Спостереження: ________________________________________________________.
Написати рівняння реакції (барій хлорид утворює з сульфат-іонами осад барій сульфату):
________________________________________________________________________
Дослід 3.Реакція нітрит-іонів
У пробірку внести 5-7 крапель розчину калій нітриту, додати 5-7 крапель концентрованого розчину сульфатної кислоти. Нагріти.
Яке забарвлення мають гази, що утворюються? ______________________________
Написати рівняння реакції, враховуючи, що нітритна кислота розкладається з утворенням NО та NО2.
________________________________________________________________________
________________________________________________________________________
Дослід 4.Реакція іонів аргентуму
У пробірку внести по 2-3 краплі розчину аргентум нітрату та хлоридної кислоти.
Спостереження: ________________________________________________________
Написати рівняння реакції:
______________________________________________________________________
Дослід 5.Реакція перманганат-іонів
У пробірку внести 5-7 крапель розчину калій перманганату, додати 5-7 крапель розчину сульфатної кислоти та 2-3 краплі розчину гідроген пероксиду.
Спостереження: ________________________________________________________.
Написати рівняння реакції, враховуючи, що в результаті реакції виділяється О2:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Лабораторна робота №2
“Комплексні сполуки”
Дослід 1.Одержання катіонного комплексу
У пробірку внести 4-5 крапель розчину купрум (ІІ) сульфату, додати декілька крапель водного розчину аміаку.
Спостереження:
а) утворюється осад купрум (ІІ) гідроксосульфат ____________________ кольору
б) осад розчиняється в надлишку аміаку з утворенням _________________________
Написати рівняння реакції:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
Дослід 2.Одержання аніонного комплексу
У пробірку внести 2-3 краплі розчину ферум (ІІІ) хлориду, додати 1-2 краплі розчину калій тіоціанату.
Спостереження: утворюється комплексна сіль K[Fe(NCS)4(H2O)2] _____________________ кольору
Написати рівняння реакції:
________________________________________________________________________
________________________________________________________________________
Дослід 3.Одержання внутрішньокомплексної сполуки
У пробірку внести 4-5 крапель розчину кальцій хлориду, додати 2-3 каплі розчину амоній оксалату.
Спостереження: утворюється ________________(вказати колір осаду) кристалічний осад кальцій оксалату.
Написати рівняння реакції:
________________________________________________________________________
________________________________________________________________________
Додати до осаду розчин динатрієвої солі етилендіамінотетраацетатної кислоти Nа2Н2Y·2Н2О (трилону Б) до розчинення осаду.
Написати рівняння реакції.
________________________________________________________________________
________________________________________________________________________
ЛАБОРАТОРНА РОБОТА №3
“ПРИГОТУВАННЯ РОЗЧИНУ КОБАЛЬТ (ІІ) НІТРАТУ РОЗБАВЛЕННЯМ БІЛЬШ КОНЦЕНТРОВАНОГО РОЗЧИНУ”
Одним із методів приготування розчинів є метод розбавлення більш концентрованого. Для приготування розчинів використовують хімічний посуд: мірні колби та піпетки. Щоб підготувати посуд для приготування розбавленого розчину необхідно:
а) піпетку спочатку промити дистильованою водою, втягуючи її за допомогою гумової груші, а потім розчином, що буде нею відмірюватися;
б) мірну колбу промити дистильованою водою.
Техніка роботи з піпеткою
Затягнути у піпетку відповідного об’єму стільки розчину, щоб рівень рідини піднявся вище позначки, після чого зняти грушу, швидко закрити вказівним пальцем верхній отвір піпетки; тримаючи піпетку вертикально і послаблюючи натиск пальця, встановити нижній край меніска рідини на позначці.
Розрахунки проводять за формулою:
с1(![]() Х)·V1(X)=
с2(
Х)·V1(X)=
с2(![]() Х)·V2(X),
Х)·V2(X),
де
с1(![]() Х)
– вихідна молярна концентрація
еквівалента речовини Х у розчині;
Х)
– вихідна молярна концентрація
еквівалента речовини Х у розчині;
V1(X)
– об’єм розчину речовини
Х з
концентрацією с1(![]() Х),
який потрібно взяти для приготування
розчину з концентрацією с2(
Х),
який потрібно взяти для приготування
розчину з концентрацією с2(![]() Х)
об’ємомV2(X);
Х)
об’ємомV2(X);
с2(![]() Х)
–
молярна
концентрація еквіваленту речовини Х у
розчині, яку необхідно отримати;
Х)
–
молярна
концентрація еквіваленту речовини Х у
розчині, яку необхідно отримати;
V2(X)
– об’єм розчину з
концентрацією с2(![]() Х),
який потрібно приготувати.
Х),
який потрібно приготувати.
Завдання
Приготувати 100 мл розчину кобальт
(ІІ) нітрату з
с2[
![]() Со(NO3)2
]
= 0,02 моль/л з більш концентрованого
розчину (с1[
Со(NO3)2
]
= 0,02 моль/л з більш концентрованого
розчину (с1[
![]() Со(NO3)2
])
= 0,4моль/л).
Со(NO3)2
])
= 0,4моль/л).
Обчислення
Об’єм
розчину кобальт
(ІІ) нітрату з
с1[
![]() Со(NO3)2
] =
0,4моль/л, який треба взяти для приготування
100 мл розчину кобальт
(ІІ) нітрату
з с2[
Со(NO3)2
] =
0,4моль/л, який треба взяти для приготування
100 мл розчину кобальт
(ІІ) нітрату
з с2[
![]() Со(NO3)2
]
= 0,02 моль/л обчислюють, виходячи з формули:
Со(NO3)2
]
= 0,02 моль/л обчислюють, виходячи з формули:
с1[
![]() Со(NO3)2
]V1[Со(NO3)2
]
= с2[
Со(NO3)2
]V1[Со(NO3)2
]
= с2[
![]() Со(NO3)2
]V2[Со(NO3)2
]:
Со(NO3)2
]V2[Со(NO3)2
]:
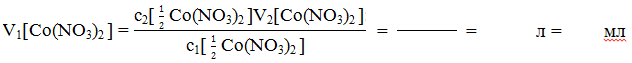
Приготування розчину:
а) піпеткою відібрати розрахований об’єм більш концентрованого розчину;
б) перенести вміст піпетки в підготовлену мірну колбу ємністю 100мл;
в) заповнити колбу дистильованою водою на 1-2 см нижче позначки;
г) за допомогою піпетки довести рівень рідини ( по краплях ) до позначки;
д) добре перемішати вміст колби.
ЛАБОРАТОРНА РОБОТА №4
