
- •Виконуючи наступні лабораторні роботи, студенти повинні набути такі практичні навички:
- •"Гідроліз солей"
- •Хід роботи
- •Хід роботи
- •"Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції"
- •Хід роботи
- •Експериментальні дані
- •Обробка експериментальних даних
- •Експериментальні дані
- •Обробка експериментальних даних
- •"Адсорбція ацетатної кислоти на активованому вугіллі"
- •Експериментальні дані
- •"Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції"
- •За допомогою методу тонкошарової хроматографії"
- •"Одержання, очищення та властивості колоїдних розчинів"
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмова робота
Експериментальні дані
Таблиця
|
Електроліт |
c0(X), моль/л |
V0(X), мл |
Спостереження |
ДР, моль3/л3 |
ДК, моль3/л3 |
|
Рb(NO3)2 |
1,0 10-3 |
0.4 |
|
|
|
|
KCl |
5,0 10-2 |
0.4 |
|
|
|
|
KI |
5,0 10-2 |
0.4 |
|
|
|
|
PbCl2 |
|
|
|
1,7 10-5 |
|
|
PbI2 |
|
|
|
8,7 10-9 |
|
Обробка експериментальних даних
1.Скласти молекулярні та іонні рівняння реакцій утворення PbCl2 i PbI2:
_______________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2.Обчислити молярні концентрації іонів Pb2+, Cl‾ i I‾ при змішуванні рівних об’ємів вихідних розчинів електролітів (враховуючи, що при змішуванні рівних об’ємів розчинів електролітів Pb(NO3)2 і KCl; Pb(NO3)2 i KI їх концентрації зменшуються вдвічі): с(Х)·V(X) = с0(Х)·V0(X),
де с0(Х) – молярна концентрація речовини Х у розчині до змішування,
V0(X)- об’єм розчину з молярною концентрацією с0(Х),
с(Х)·- молярна концентрація речовини Х у розчині після змішування,
V(X) – об’єм розчину з молярною концентрацією с (Х).
V(X)=
с(Pb2+)= -------------------------------- = --------------------------- = моль/л
с(Cl‾)= -------------------------------- = --------------------------- = моль/л
с(I‾)= -------------------------------- = --------------------------- = моль/л
3.Обчислити добутки молярних концентрацій іонів електролітів PbCl 2 i PbI2:
ДK(PbCl2)= [Pb2+] [Cl-]2 =
ДK(PbI2)= [Pb2+] [I-]2 =
4. Порівняти розраховані значення ДК з довідковими значеннями ДР і зробити висновок про причину утворення осаду.
Висновок: PbCl2___________________________________________________
в осад, тому що для нього ДК_____________ДР; PbI2_____________ в осад, тому що для нього ДК_____________________ДР.
ЛАБОРАТОРНА РОБОТА №11
"ВИЗНАЧЕННЯ НОРМАЛЬНОГО ОКИСНО-ВІДНОВНОГО ПОТЕНЦІАЛУ"
Визначення ґрунтується на залежності окисно-відновного потенціалу системи від співвідношення активностей окисленої та відновленої форм речовин у розчині. Нормальний окисно-відновний потенціал дорівнює потенціалу системи, в якому співвідношення активностей окисленої та відновленої форм речовин в розчині дорівнює 1.
Хід роботи
Заповнити чисті бюретки розчинами солей K3[Fe(CN)6] і K4[Fe(CN)6] (с(Х)=0,01 моль/л).
Підготувати універсальний іономір (або рН-метр) для роботи. Як електрод визначення використати платиновий електрод, а електрод порівняння - хлорсрібний.
Склянку почергово наповнити за допомогою бюреток розчинами солей K3[Fe(CN)6] і K4[Fe(CN)6] згідно з заданим у таблиці співвідношенням об’ємів.
Виміряти ЕРС системи в кожному з приготовлених розчинів, переводячи при цьому значення ЕРС із мілівольтів у вольти.
Дані записати у таблицю.
Експериментальні дані
Таблиця
|
|
EPC, B |
|
|
|
2/18 |
|
|
|
|
10/10 |
|
|
|
|
18/2 |
|
|
|
Обробка експериментальних даних
Окисно-відновний потенціал системи (у вольтах) обчислюють за формулою:
![]() де
ЕХС=0,222
B.
де
ЕХС=0,222
B.
![]()
![]()
![]()
Нормальний окисно-відновний потенціал знайти за рівнянням Петерса:
 ,
,
де c([Fe(CN)6]3-)=с(K3[Fe(CN)6])∙V(K3[Fe(CN)6] )/V(р-ну);
с([Fe(CN)6]4-)=с(K4[Fe(CN)6])∙V(K4[Fe(CN)6])/V(р-ну);
n- число електронів, що беруть участь у окисно-відновному акті.
n=_____
c1([Fe(CN)6]3-)=
c2([Fe(CN)6]3-)=
c3([Fe(CN)6]3-)=
с1([Fe(CN)6]4-)=
с2([Fe(CN)6]4-)=
с3([Fe(CN)6]4-)=
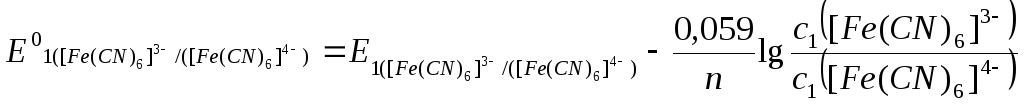 =
=
=
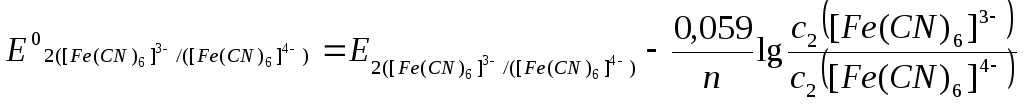 =
=
=
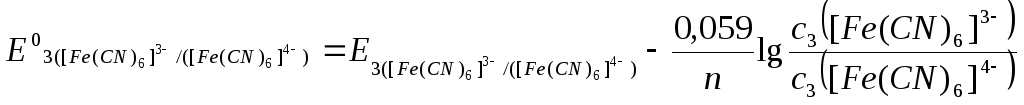 =
=
=
Обчислюють середнє значення
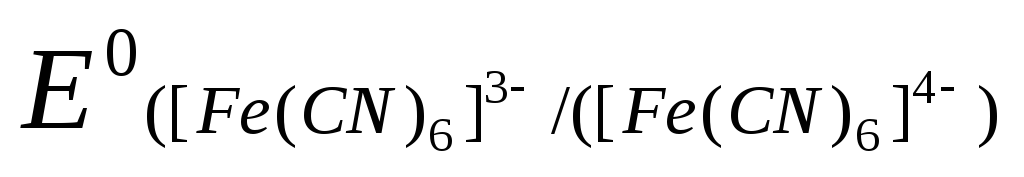 :
:
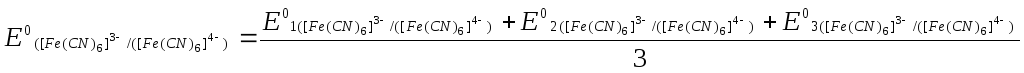 =
----------------------------------------- =
=
----------------------------------------- =
Висновок:
нормальний окисно-відновний потенціал
системи ![]() дорівнює______________________.
дорівнює______________________.
ЛАБОРАТОРНА РОБОТА № 12
