
- •Виконуючи наступні лабораторні роботи, студенти повинні набути такі практичні навички:
- •"Гідроліз солей"
- •Хід роботи
- •Хід роботи
- •"Дослідження залежності швидкості розкладу тіосульфатної кислоти від її молярної концентрції"
- •Хід роботи
- •Експериментальні дані
- •Обробка експериментальних даних
- •Експериментальні дані
- •Обробка експериментальних даних
- •"Адсорбція ацетатної кислоти на активованому вугіллі"
- •Експериментальні дані
- •"Кількісне визначення іонів кальцію у розчині методом іонообмінної адсорбції"
- •За допомогою методу тонкошарової хроматографії"
- •"Одержання, очищення та властивості колоїдних розчинів"
- •Приклад письмової роботи (Модуль 1)
- •Письмова робота
- •Приклад письмової роботи (Модуль 2)
- •Письмова робота
Хід роботи
Бюретку заповнити розчином натрій гідроксиду.
Відібрати 10мл титрованого розчину сульфатної кислоти за допомогою піпетки і перенести в колбу для титрування.
Додати в цю ж колбу 2-3 краплини розчину фенолфталеїну.
Титрувати розчин сульфатної кислоти розчином натрій гідроксиду до появи стійкого блідо-рожевого забарвлення.
Титрування (п.2-4) повторити 2-3 рази , дані занести до таблиці.
Експериментальні дані
Таблиця
|
№ п/п |
V(H2SO4), л |
c( моль/л |
V(NaOH), л |
|
|
1 |
|
|
|
|
|
2 |
|
| ||
|
3 |
|
|
Обробка експериментальних даних
Середнє значення об’єму розчину натрій гідроксиду розраховують за формулою:
![]() --------------------------------------------=
л.
--------------------------------------------=
л.
Молярну концентрацію еквівалента натрій гідроксиду в розчині обчислюють за
формулою:
c(NaOH)
=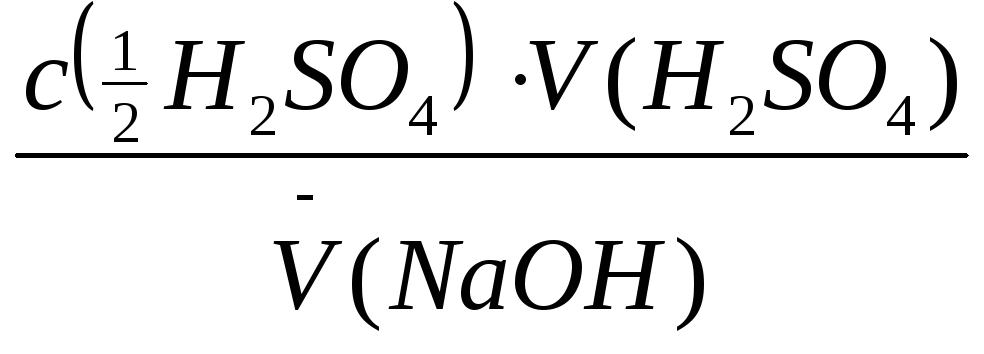 =
-----------------------------------
=
моль/л.
=
-----------------------------------
=
моль/л.
Висновок: молярна концентрація еквівалента натрій гідроксиду дорівнює
_______________________________________________________________________
ЛАБОРАТОРНА РОБОТА № 6
"ПРИГОТУВАННЯ БУФЕРНИХ РОЗЧИНІВ І ВИВЧЕННЯ ЇХ ВЛАСТИВОСТЕЙ"
Основною властивістю буферних розчинів є здатність зберігати практично незмінною концентрацію іонів Н+ при додаванні до них порівняно невеликих кількостей сильної кислоти або лугу, а також при розведенні.
В основі буферної дії ацетатного буферного розчину при додаванні до нього розчинів HCl і NaOH лежать реакції:
CH3COO- + H+ = CH3COOH або CH3COOH + OH- = CH3COO- + H2O.
Хід роботи
Заповнити одну бюретку розчином ацетатної кислоти, другу - розчином натрій ацетату з с0(CH3COOH) =с0(CH3COONa)=0,1моль/л.
У трьох склянках ємністю 50мл приготувати за допомогою бюреток буферні розчини з вказаними у таблиці співвідношеннями об’ємів розчинів CH3COOH і CH3COONa. Всі розчини перемішати скляною паличкою.
Виміряти рН приготовлених буферних розчинів за допомогою рН - метра або іонометра. Буферні розчини не виливати!
До одного з ацетатних буферних розчинів за допомогою піпетки додати 1мл розчину HCl (c(HCl)=0,01моль/л), до другого – 1мл розчину NaOH(c(NaOH)=0,01моль/л), а третій перенести в мірну колбу ємністю 200мл і довести дистильованою водою до позначки. Всі розчини перемішати.
Виміряти рН приготовлених буферних розчинів. Дані занести до таблиці.
Експериментальні дані
c0(CH3COOH)= моль/л с0(CH3COONa)= моль/л
с(HCl)= моль/л с(NaOH)= моль/л
Таблиця.
|
№
|
Об’єм розчинів, л |
pН (розраховано) |
рН (виміряно) | |||||||
|
CH3COONa |
CH3COOH |
HCl |
NaOH |
H2O |
pH0(i) |
pНi |
pH0(i) |
pНi | ||
|
1 |
1∙10-2 |
1∙10-2 |
1∙10-3 |
– |
– |
|
|
|
| |
|
2 |
1,5∙10-2 |
5∙10-3 |
– |
1∙10-3 |
– |
|
|
|
| |
|
3 |
5∙10-3 |
1,5∙10-2 |
– |
– |
0,180 |
|
|
|
| |
Обробка експериментальних даних
рН досліджуваних буферних розчинів до (рН0) і після додавання помірних кількостей сильної кислоти (рН1), лугу (рН2) або при десятикратному розведенні (рН3) розраховують за формулами, враховуючи, що
Kд(CH3COOH) = 1,75 ∙ 10-5моль/л,
pKд(CH3COOH) = __________________:
рH0
(1)
= pKд(CH3COOH)
+ lg![]()
= + lg -----------------------------------------= +lg =
=
рH0
(2)
= pKд(CH3COOH)
+ lg![]()
= + lg -----------------------------------------= +lg =
=
рH0
(3)
=
pKд(CH3COOH)
+ lg![]()
= + lg -----------------------------------------= +lg =
=
pH1
= pKд(CH3COOH)
+ lg![]() =
=
= + lg ------------------------------------------------------------------=
= +lg =
pH2
=pKд(CH3COOH)
+lg![]() =
=
= + lg ----------------------------------------------------------------------=
= +lg =
pH3
= pKд(CH3COOH)
+ lg![]() =
=
= + lg ----------------------------------------------------------------------=
= +lg =
Висновки:
а) Порівняти обчислені та виміряні значення рН ацетатних буферних розчинів до і після додавання до них розчинів електролітів_________________________________
________________________________________________________________________________________________________________________________________________
б) Як впливають добавки помірних кількостей сильної кислоти або лугу, а також розбавлення на рН буферних розчинів)?_____________________________________
________________________________________________________________________________________________________________________________________________
ЛАБОРАТОРНА РОБОТА №7
"ВИЗНАЧЕННЯ БУФЕРНОЇ
ЄМНОСТІ АЦЕТАТНОГО БУФЕРНОГО РОЗЧИНУ "
Будь-яка буферна суміш практично зберігає сталість рН лише за умови додавання невеликої визначеної кількості кислоти або лугу. Кількісною мірою здатності буферних систем підтримувати рН незмінним є буферна ємність. Вона виражається в моль/л або частіше в ммоль/л і обчислюється за такими формулами:
![]() ;
;
![]() ,
,
де:
Вк
– буферна ємність за кислотою; Вл
– буферна ємність за лугом; ΔpH – зміна
pН буферної системи при додаванні кислоти
(лугу);
![]() –
об’єм буферного розчину.
–
об’єм буферного розчину.
Буферна ємність тим більша, чим більша концентрація компонентів буферного розчину, при цьому співвідношення їх концентрацій має дорівнювати одиниці.
Хід роботи
Заповнити одну бюретку розчином ацетатної кислоти, другу - розчином натрій ацетату з с0(CH3COOH) =с0(CH3COONa)= 1∙10-2 моль/л.
У двох стаканчиках ємністю 25 мл приготувати буферні розчини об’ємом 10 мл із співвідношенням об’ємів розчинів CH3COOH та CH3COONa рівним одному.
Виміряти рН0 приготовлених буферних розчинів за допомогою рН - метра або іонометра.
Заповнити одну бюретку розчином хлоридної кислоти, другу - розчином натрій гідроксиду з с(HCl) =с(NaOH)=0,1моль/л.
До одного із ацетатних буферів додати розчин HCl (c(HCl)=0,1моль/л) при постійному перемішуванні до зміни рН0 розчину на одиницю – ΔрНк=рН0–рН1=1 (рН1 розчину контролювати за допомогою рН - метра або іонометра).
До другого ацетатного буферного розчину за допомогою бюретки додати розчин NaOH (c(NaOH)=0,1моль/л) при постійному перемішуванні до зміни рН0 розчину на одиницю – ΔрНосн.=рН2–рН0=1 (рН2 розчину контролювати за допомогою рН - метра або іонометра).
Виміряні значення об’єму розчинів HCl і NaOH та рН0, рН1, рН2 занести до таблиці.
Експериментальні дані
с(CH3COOH)= моль/л с(CH3COONa)= моль/л
с(HCl)= моль/л с(NaOH)= моль/л
Таблиця
|
№ |
Об’єм розчинів, л |
рН буферного розчину |
Вк Вл. | ||||||
|
CH3COONa |
CH3COOH |
Буферного розчину |
HCl |
NaOH |
рН0 |
pНi |
ΔрН | ||
|
1 |
5∙10-3 |
5∙10-3 |
|
|
– |
|
|
|
|
|
2 |
5∙10-3 |
5∙10-3 |
|
– |
|
|
|
|
|
Обробка експериментальних даних
Буферну ємність ацетатного буферного розчину розраховують за кислотою та лугом за формулами:
![]()
 =
=
![]()
 =
=
Висновки: (Порівняти буферну ємність за кислотою та лугом)_______________
_______________________________________________________________________
ЛАБОРАТОРНА РОБОТА №8
"ВИЗНАЧЕННЯ ТЕПЛОТ НЕЙТРАЛІЗАЦІЇ"
Теплота нейтралізації кислот лугами залежить від характеру дисоціації кислоти у розчині.
Хід роботи
В склянку Дьюара ємністю 250мл відміряти за допомогою мірного циліндра 25мл розчину лугу с(NaOH) = 1моль/л.
Обережно занурити в склянку термометр та виміряти початкову температуру розчину (Т1).
Відміряти мірним циліндром 25мл розчину сірчаної кислоти с(
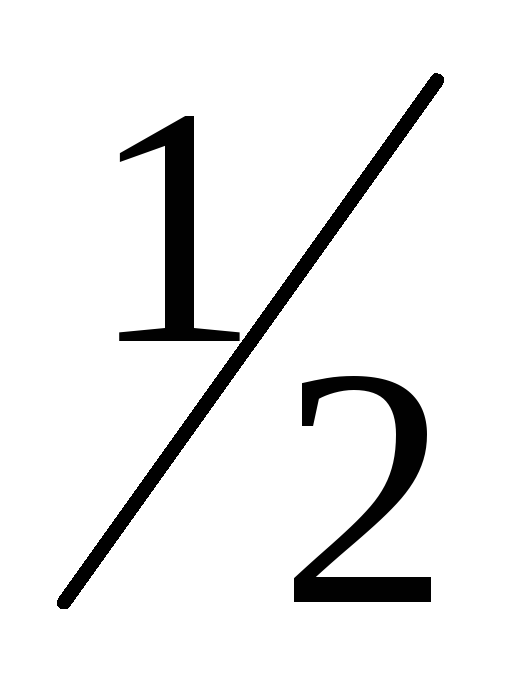 Н2SO4) =1моль/л.
Н2SO4) =1моль/л.Обережно перемішуючи скляною паличкою розчин лугу, швидко долити до нього розчин кислоти.
Відмітити температуру після зливання розчинів (Т2). Результати вимірювань занести в таблицю.
Повторити дії, описані у п.п.1-5, для розчинів наступних кислот: HCl,HNO3,CH3COOH.
Експериментальні дані
Таблиця
|
Кислота |
c( |
Т 1, К |
Т2,К |
ΔТ, К |
ΔНнейтрал.кДж/моль | |
|
Довідкове значення |
Експериментальне значення | |||||
|
Н2SO4 |
|
|
|
|
-53 |
|
|
HCl |
|
|
|
|
-56 |
|
|
HNO3 |
|
|
|
|
-56 |
|
|
CH3COOH |
|
|
|
|
-47 |
|
Обробка експериментальних даних
Обчислити значення теплоти нейтралізації для кожної з кислот за формулою:
ΔНнейтр.=![]() ,
,
де: С - теплоємність розчину, яка дорівнює 4,18кДж/К;
V(к-ти) - об’єм розчину кислоти, л;
V(лугу) - об’єм розчину лугу, л;
ρ - густина розчину, яка приблизно дорівнює 1кг/л;
c(![]() к-ти)
- молярна концентрація еквіваленту
кислоти, моль/л.
к-ти)
- молярна концентрація еквіваленту
кислоти, моль/л.
ΔНнейтр.(Н2SO4) =------------------------------------------------------------------------------------= = кДж/моль
ΔНнейтр.(HCl) =------------------------------------------------------------------------------------= = кДж/моль
ΔНнейтр.(HNO3) =------------------------------------------------------------------------------------= = кДж/моль
ΔНнейтр.(CH3COOH) =-------------------------------------------------------------------------------= = кДж/моль
Порівняти обчислені значення теплот нейтралізації кислот з довідковим:
_______________________________________________________________________
Записати молекулярні та іонні рівняння реакцій нейтралізації кислот.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ЛАБОРАТОРНА РОБОТА №9
