
- •Міністерство освіти і науки україни
- •І. Обробка та оформлення результатів лабораторних робіт
- •Іі. Правила роботи в лабораторії з фізичної хімії і техніка безпеки
- •Ліквідація нещасних випадків і надання першої допомоги
- •Ііі. Агрегатний стан речовин
- •1. Визначення маси моля речовини вимірюванням її об’єму в газоподібному стані
- •2. Визначення в’язкості системи етиловий спирт – вода
- •I. Хімічна термодинаміка
- •1. Визначення теплоти згоріння речовин за допомогою калориметра юнкерса
- •Експериментальна частина
- •2. Визначення теплоти розчинення і теплоти гідратації солі
- •V. Поверхневі явища (поверхнева енергія, поверхневий натяг та адсорбція на межі розділу фаз)
- •1. Визначення поверхневого натягу розчинів методом відліку крапель (сталагмометричним методом)
- •Поверхневий натяг води в залежності від температури
- •Густина води в залежності від температури
- •Густина розчинів NaCl при 293 к
- •2. Визначення площі та довжини молекули поверхнево-активної речовини
- •3. Адсорбція оцтової кислоти на активованому вугіллі
- •Методика експерименту
- •4. Дослідження адсорбції забарвлених речовин із розчинів
- •5. Дослідження адсорбції ізоамілового спирту із розчину за допомогою активованого вугілля
- •6. Визначення повної обмінної ємності (оє) катіоніту
- •7. Визначення вмісту лікарської речовини (глюконату кальцію) в розчині методом йонообмінної адсорбції
- •8. Обезсолювання води за допомогою йонітів
- •VI. Розчини неелектролітів
- •1. Визначення критичної температури взаємного розчинення рідин
- •2. Визначення молекулярної маси розчиненої речовини кріоскопічним методом
- •VII. Розчини електролітів
- •1. Визначення електропровідності електролітів і обчислення ступеня дисоціації
- •Експериментальна частина
- •Робота на змінному струмові
- •2. Bизначення розчинності малорозчинних сполук
- •3. Визначення іонного добутку води
- •4.Визначення концентрації кислоти методом кондуктометричного титрування
- •5. Визначення вмісту лікарської речовини в розчині
- •Хід роботи
- •Обробка результатів експерименту
- •VIII. Гальванічні елементи та електродні потенціали
- •1. Вимірювання електрорушійних сил гальванічних елементів
- •2. Визначення водневого показникa потенціометричним методом
- •3. Потенціометричне визначення рН, розрахунок константи дисоціації слабкої кислоти
- •Іх. Хімічна кінетика і каталіз
- •1. Визначення швидкості розкладу тіосульфатної кислоти
- •Дослід 1. Залежність швидкості розкладу тіосульфатної кислоти від її молярної концентрації
- •Дослід 2. Залежність швидкості розкладу тіосульфатної кислоти від температури
- •Виконання роботи
- •Склад реакційної суміші
- •Результати титрування
- •3. Дослідження гідролізу крохмалю в присутності соляної кислоти
- •4. Дослідження гідролізу крохмалю в присутності ферментів і соляної кислоти при температурі 310 к
- •5. Визначення швидкості розкладу пероксиду водню газометричним методом
- •6. Фотохімічний розклад н2о2
- •Послідовність виконання роботи
- •Х. Фізикохім ія дисперсних систем.
- •1. Методи одержання колоїдних розчинів
- •2. Коагуляція колоїдних розчинів електролітами
- •3. Визначення величини електрокінетичного потенціалу методом електрофорезу
- •4. Вивчення ізоелектричної точки білків
- •5. Набухання гелів
- •Хід виконання роботи
- •Хі. Біогенні елементи
- •1. Аналітичні реакції на йони s-елементів
- •Визначення хлор-йонів Cl– в питних водах за методом Фольгарда
- •2. Аналітичні реакції на р-елементи та їх сполуки
- •Реакція на бор (ііі) по кольору полум’я
- •Реакція на йон з розведеними кислотами
- •Реакція на йон з реактивом Несслера
- •Реакція на йон із розчином хлориду барію
- •(Реакція л.А. Чугаєва)
- •Контрольні питання до колоквіумів іii. Агрегатний стан речовин
- •Іv. Хімічна термодинаміка та біоенергетика
- •V. Поверхневі явища (поверхнева енергія, поверхневий натяг та адсорбція на межі розділу фаз)
- •Vі. Розчини неелектролітів
- •Vіі. Розчини електролітів
- •Vііі. Гальванічні елементи та електродні потенціали
- •IX. Хімічна кінетика і каталіз
- •Х. Фізикохімія дисперсних систем
- •Хі. Біогенні елементи
- •Додатки
- •Деякі фізичні константи
- •Густина деяких речовин
- •Густина деяких газів (н.У.)
- •Співвідношення між позасистемними одиницями
- •Пояснювальна записка
- •Зміст дисципліни
- •Тема 1. Предмет фізичної хімії та її значення. Розділи фізичної хімії. Методи дослідження. Розвиток фізичної хімії в Україні.
- •Тема 7.
- •Тема 8.
- •Тема 9.
- •Тема 10.
- •Тема 11.
- •Тема 12.
- •Тема 13.
- •Тема 14.
- •Орієнтовний перелік питань до підсумкового контролю знань з дисципліни.
- •Cписок літератури
- •І. Обробка та оформлення результатів
- •Гомонай Василь Іванович
7. Визначення вмісту лікарської речовини (глюконату кальцію) в розчині методом йонообмінної адсорбції
Для роботи необхідно: глюконат кальцію; Н-катіоніт; 0,1 М розчин NaOH; індикатор метиловий оранжевий.
УВАГА! При роботі з колонкою не допускається проникнення повітря в йоніт. Рівень рідини не повинен опускатися нижче верхнього рівня йоніту.
Через колонку з Н-катіонітом повільно пропускають 20 мл дослід- жуваного розчину, який містить глюконат кальцію. Потім колонку проми- ти 25 мл дистильованої води, збираючи її в ту ж колбу. Весь зібраний фільтрат відтитрувати 0,1 М розчином NaOH з індикатором метиловим оранжевим. Вміст глюконату кальцію вирахувати за формулою:
![]() .
.
8. Обезсолювання води за допомогою йонітів
Для роботи необхідно: Н-катіоніт; ОН-аніоніт; оксалат амонію; нітрат аргентуму; піпетка; штатив з пробірками; метилоранж.
Для обезсолювання води взяти воду з водогону. За допомогою якісних реакцій виявити у воді йони хлору (реакцією з AgNO3) і йони кальцію (реакцією з оксалатом амонію (NH4)2C2O4).
Через колонку з Н-катіонітом пропустити повільно 25 мл води з водогону, потім промити 25 мл дистильованої води. З отриманого розчину відібрати піпеткою по декілька крапель у 2 пробірки. В 1-й перевірити наявність Са2+ (реакція з (NH4)2C2O4), в 2-й – наявність йонів Н+ (ме- тилоранж). З одержаного попереднього розчину відібрати 25 мл і про- пустити через колонку з ОН-аніонітом та промити 25 мл дистильованої води. Відібрати в пробірку декілька крапель розчину і перевірити наявність йонів С1–.
9. РОЗДІЛЕННЯ ЙОНІВ Fе3+, Cu2+,Co2+ МЕТОДОМ ХРОМАТОГРАФІЇ НА ОКСИДІ АЛЮМІНІЮ
Для роботи необхідно: А12О3; металевий штатив; розчини CuSO4, FeCl3 i CoCl2.
Колонку з адсорбентом (А12О3) закріпити у штатив і пропустити через неї 1 мл суміші, що складається з рівних об’ємів розчинів CuSO4, FeCl3 i CoCl2 з масовою часткою 0,1. Спостерігати забарвлення розчину. У про- токолі замалювати шари адсорбенту відповідними кольорами.
VI. Розчини неелектролітів
1. Визначення критичної температури взаємного розчинення рідин
Для роботи необхідно: прилад для визначення критичної температу- ри; плитка електрична; технічні терези; піпетка, градуйована на 5–10 мл; штатив з пробірками; фенол; вода.
У випадку обмеження взаємної розчинності двох рідин у певній області концентрації завжди має місце рівновага між двома розчинами різного складу.
Очевидно, при заміні температури ця рівновага буде змінюватися в ту чи іншу сторону. Всі ці співвідношення можуть бути подані графічно на діаграмах температура – склад.
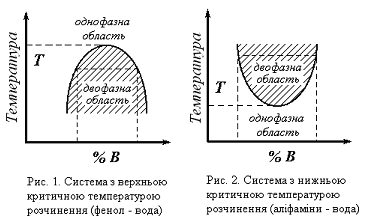
Температура, вище або нижче якої рідини взаємно розчинні у всіх співвідношеннях, називається критичною температурою розчинення. Роз- різняють верхню і нижню критичні температури розчинення.
Н
Рис.1. Система з верхньоюРис.2.Система з нижньою
критичною температурою критичною
температурою
розчинення (фенол – вода) розчинення
(аліфаміни – вода)
Криву взаємної розчинності двох рідин найпростіше знайти, визна- чаючи температуру зникнення або появи другої фази. Для визначення цієї температури зручно використовувати прилад, зображений на рис. 4.
Колба 1 служить водяною або масляною банею, в пробірку 2 помі- щають досліджувану суміш, в неї на коркові вставляють термометр 3 і мішалку 4.
Виходячи з загальної наважки і процентного вмісту, розраховують ва- гові кількості для одержання досліджуваних сумішей.
Якщо другими компонентами буде рідина, то її можна брати в об’єм- них одиницях. Для цього необхідно знати її густину. Густина води при температурі досліду приймається рівною одиниці.
Для дослідження беруть дві речовини, що погано розчиняються одна в одній, наприклад система фенол – вода.
Готують декілька сумішей з різним процентним складом, який вка- зується керівником занять. Загальна вага суміші не повинна перевищува- ти 5–6 г.
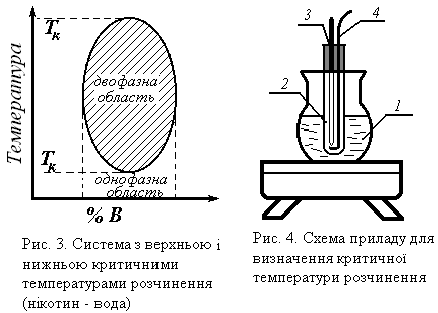
Рис. 3. Система з верхньою і Рис. 4. Схема приладу для
нижньою критичними визначення критичної
температурами розчинення температури розчинення.
(нікотин – вода).
Спочатку зважують необхідну кількість фенолу, потім відмірюють не- обхідну кількість води для одержання суміші певного процентного складу.
Встановлюють пробірку в прилад для визначення критичної темпера- тури і відмічають дві температурні точки: температуру гомогенізації (пере- хід системи в одну фазу) і температуру гетерогенізації (розділення системи на дві фази).
Для одержання точних даних потрібно змінювати температуру повіль- но, при безперервному перемішуванні суміші в пробірці з метою уник- нення перегріву, переохолодження.
При роботі з фенолом потрібно слідкувати за тим, щоб він не потра- пив на шкіру, так як він викликає опіки.
По одержаних даних будують діаграму: температура – склад, по якій визначають критичну температуру розчинення і проводять контрольне визначення процентного складу по температурі взаємного розчинення. Результати дослідів заносять у таблицю:
|
№№ пробірок |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
% фенолу |
|
|
|
|
|
|
|
|
|
|
|
|
|
Наважка фенолу, кг |
|
|
|
|
|
|
|
|
|
|
|
|
|
Наважка води, кг |
|
|
|
|
|
|
|
|
|
|
|
|
|
Температура гомогенізації, К |
|
|
|
|
|
|
|
|
|
|
|
|
|
Температура гетерогенізації, К |
|
|
|
|
|
|
|
|
|
|
|
|
|
Середня температура, К |
|
|
|
|
|
|
|
|
|
|
|
|
