
- •Міністерство освіти і науки україни
- •І. Обробка та оформлення результатів лабораторних робіт
- •Іі. Правила роботи в лабораторії з фізичної хімії і техніка безпеки
- •Ліквідація нещасних випадків і надання першої допомоги
- •Ііі. Агрегатний стан речовин
- •1. Визначення маси моля речовини вимірюванням її об’єму в газоподібному стані
- •2. Визначення в’язкості системи етиловий спирт – вода
- •I. Хімічна термодинаміка
- •1. Визначення теплоти згоріння речовин за допомогою калориметра юнкерса
- •Експериментальна частина
- •2. Визначення теплоти розчинення і теплоти гідратації солі
- •V. Поверхневі явища (поверхнева енергія, поверхневий натяг та адсорбція на межі розділу фаз)
- •1. Визначення поверхневого натягу розчинів методом відліку крапель (сталагмометричним методом)
- •Поверхневий натяг води в залежності від температури
- •Густина води в залежності від температури
- •Густина розчинів NaCl при 293 к
- •2. Визначення площі та довжини молекули поверхнево-активної речовини
- •3. Адсорбція оцтової кислоти на активованому вугіллі
- •Методика експерименту
- •4. Дослідження адсорбції забарвлених речовин із розчинів
- •5. Дослідження адсорбції ізоамілового спирту із розчину за допомогою активованого вугілля
- •6. Визначення повної обмінної ємності (оє) катіоніту
- •7. Визначення вмісту лікарської речовини (глюконату кальцію) в розчині методом йонообмінної адсорбції
- •8. Обезсолювання води за допомогою йонітів
- •VI. Розчини неелектролітів
- •1. Визначення критичної температури взаємного розчинення рідин
- •2. Визначення молекулярної маси розчиненої речовини кріоскопічним методом
- •VII. Розчини електролітів
- •1. Визначення електропровідності електролітів і обчислення ступеня дисоціації
- •Експериментальна частина
- •Робота на змінному струмові
- •2. Bизначення розчинності малорозчинних сполук
- •3. Визначення іонного добутку води
- •4.Визначення концентрації кислоти методом кондуктометричного титрування
- •5. Визначення вмісту лікарської речовини в розчині
- •Хід роботи
- •Обробка результатів експерименту
- •VIII. Гальванічні елементи та електродні потенціали
- •1. Вимірювання електрорушійних сил гальванічних елементів
- •2. Визначення водневого показникa потенціометричним методом
- •3. Потенціометричне визначення рН, розрахунок константи дисоціації слабкої кислоти
- •Іх. Хімічна кінетика і каталіз
- •1. Визначення швидкості розкладу тіосульфатної кислоти
- •Дослід 1. Залежність швидкості розкладу тіосульфатної кислоти від її молярної концентрації
- •Дослід 2. Залежність швидкості розкладу тіосульфатної кислоти від температури
- •Виконання роботи
- •Склад реакційної суміші
- •Результати титрування
- •3. Дослідження гідролізу крохмалю в присутності соляної кислоти
- •4. Дослідження гідролізу крохмалю в присутності ферментів і соляної кислоти при температурі 310 к
- •5. Визначення швидкості розкладу пероксиду водню газометричним методом
- •6. Фотохімічний розклад н2о2
- •Послідовність виконання роботи
- •Х. Фізикохім ія дисперсних систем.
- •1. Методи одержання колоїдних розчинів
- •2. Коагуляція колоїдних розчинів електролітами
- •3. Визначення величини електрокінетичного потенціалу методом електрофорезу
- •4. Вивчення ізоелектричної точки білків
- •5. Набухання гелів
- •Хід виконання роботи
- •Хі. Біогенні елементи
- •1. Аналітичні реакції на йони s-елементів
- •Визначення хлор-йонів Cl– в питних водах за методом Фольгарда
- •2. Аналітичні реакції на р-елементи та їх сполуки
- •Реакція на бор (ііі) по кольору полум’я
- •Реакція на йон з розведеними кислотами
- •Реакція на йон з реактивом Несслера
- •Реакція на йон із розчином хлориду барію
- •(Реакція л.А. Чугаєва)
- •Контрольні питання до колоквіумів іii. Агрегатний стан речовин
- •Іv. Хімічна термодинаміка та біоенергетика
- •V. Поверхневі явища (поверхнева енергія, поверхневий натяг та адсорбція на межі розділу фаз)
- •Vі. Розчини неелектролітів
- •Vіі. Розчини електролітів
- •Vііі. Гальванічні елементи та електродні потенціали
- •IX. Хімічна кінетика і каталіз
- •Х. Фізикохімія дисперсних систем
- •Хі. Біогенні елементи
- •Додатки
- •Деякі фізичні константи
- •Густина деяких речовин
- •Густина деяких газів (н.У.)
- •Співвідношення між позасистемними одиницями
- •Пояснювальна записка
- •Зміст дисципліни
- •Тема 1. Предмет фізичної хімії та її значення. Розділи фізичної хімії. Методи дослідження. Розвиток фізичної хімії в Україні.
- •Тема 7.
- •Тема 8.
- •Тема 9.
- •Тема 10.
- •Тема 11.
- •Тема 12.
- •Тема 13.
- •Тема 14.
- •Орієнтовний перелік питань до підсумкового контролю знань з дисципліни.
- •Cписок літератури
- •І. Обробка та оформлення результатів
- •Гомонай Василь Іванович
2. Аналітичні реакції на р-елементи та їх сполуки
Серед р-елементів
п’ять елементів є органогенними
(“елементи жит-
тя”): вуглець, азот,
кисень, фосфор, сірка, які складають
основу біологічно важливих молекул. До
біогенних елементів відносяться також
хлор та йод, а бор, фтор та бром наявні
в живих організмах у мікрокількостях.
Сполуки плюмбуму та арсену мають дуже
токсичні властивості. Як правило, в
живому організмі р-елементи входять до
складу складних органічних макромолекул
або йонів OH–,
Cl–,
![]() ,
,![]() ,
,![]() ,
,![]() ,F–.
Вони складають основу буферної системи
крові, забезпечують необхідний
осмо-
тичний тиск, містяться в шлунковому
соці та інших біологічних середови-щах.
Багато сполук р-елементів використовуються
в якості лікарських засобів.
,F–.
Вони складають основу буферної системи
крові, забезпечують необхідний
осмо-
тичний тиск, містяться в шлунковому
соці та інших біологічних середови-щах.
Багато сполук р-елементів використовуються
в якості лікарських засобів.
Реакція на бор (ііі) по кольору полум’я
У фарфоровій чашці випаровують 5–6 крапель розчину бури. Після охолодження до сухого залишку добавити 4–5 крапель концентрованого розчину Н2SO4 та 5–6 крапель етилового спирту. Суміш перемішати скляною паличкою та підпалити. Полум’я спирту, який горить, забарв- люється в зелений колір. Це забарвлення обумовлене летким етиловим ефіром борної кислоти В(ОС2Н5)3. Його отримують дією сірчаної кислоти та етилового спирту на тетраборат натрію:
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
H3BO3 + 3C2H5OH = B(OC2H5)3 + 3H2O,
За допомогою цих реакцій перевіряються такі лікарські препарати, як борна кислота та ії солі.
Реакція на йон з розведеними кислотами
У пробірку налити
0,5 мл розчину Na2CO3
або K2CO3
та додати туди 1–2 краплі розчину кислоти.
Що при цьому спостерігається? Написати
рівняння реакції в молекулярній та
йонній формі. Ця реакція вико-
ристовується
в санітарно-гігієнічній практиці при
визначенні таких ком-
понентів, як СО![]() та HCO
та HCO![]() у звичайних та стічних водах.
у звичайних та стічних водах.
Реакція на йон Pb2+ з йодидом калію
До декількох крапель розчину солі плюмбуму прилити стільки ж розчину йодиду калію. Випадає жовтий осад йодиду плюмбуму.
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
Pb2+ + 2I– = PbI2
До осаду прилити 1 мл оцтової кислоти та суміш нагріти до кипіння. Розчин повільно охолоджується. При цьому знов випадає осад йодиду плюмбуму у вигляді золотистих зерен.
![]()
Реакція на йон з реактивом Несслера
На предметне скло нанести на відстані (0,5–1)10–2 м один від одного по одній краплі розчину NH4Cl та реактиву Несслера. З’єднати краплі за допомогою скляної палички – випадає червонувато-бурий осад:
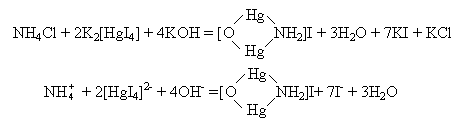
При дуже малих кількостях солей амонію замість осаду утворюється жовтий розчин. Цей ефект використовується у колориметричному методі аналізу для визначення загального та залишкового азоту крові, сечовини, у санітарно-гігієнічній практиці – при аналізі води, повітря, харчових про- дуктів.
Реакція
на йон
![]() з
сульфатом феруму (ІІ) в присутності
концентрованої сірчаної кислоти
з
сульфатом феруму (ІІ) в присутності
концентрованої сірчаної кислоти
На предметне скло нанести краплю розчину нітрату натрію, у середи- ну краплі помістити маленький кристалик FeSO47H2O. На нього нанести одну краплю (за допомогою крапельниці) концентрованої соляної кислоти. Навколо кристалика з’являється буре забарвлення:
3 FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 4H2O + 2NO
3Fe2+
+
![]() +
4H+
= 3Fe3+
+ 2H2O
+ NO
+
4H+
= 3Fe3+
+ 2H2O
+ NO
FeSO4 + NO = [ Fe(NO)]SO4
Fe2+
+ NO +
![]() = [Fe(NO)]SO4
= [Fe(NO)]SO4![]()
Реакція
на йон
![]() з
йодидом калію
з
йодидом калію
Краплю розчину нітриту калію або натрію розбавити до 3 мл водою, а потім добавити по одній краплі розчинів КІ, сірчаної кислоти та декілька крапель розчину крохмалю. Що при цьому бачимо?
Рівняння реакції:
2NaNO2 + 2NaI + 2H2SO4 = 2NO + I2 + 2H2O + 2Na2SO4
2NO2- + 2I- + 4H+ = 2NO + I2 + 2H2O
Реакція використовується для перевірки фармакопейного препарату NaNO2.
Реакція
на йон
![]() з молібдатом амонію
з молібдатом амонію
У пробірку налити 0,5 мл розчину Na2HPO4 та 0,5 мл розчину (NH4)2MoO4. Суміш підігріти. Що бачимо при охолодженні? Рівняння реакції:
12(NH4)2MoO4 + Na2HPO4 + 23HNO3 = (NH4)3H4[P(Mo2O7)6] +
+ NaNO3 + 10H2O + 21NH4NO3
Вказана реакція застосовується для визначення фосфору в ортофос- фатах, які розчинені у водах промислових відходів.
(Для визначення фосфору в біологічних рідинах використовується реакція з молібденовою кислотою за присутністю якогось відновлювача).
Аналітична реакція на арсен (ІІІ)
Ця реакція базується на отриманні гідроген арсену (ІІ), який віднов- лює солі аргентуму до металічного срібла. У пробірку налити 0,5 мл роз- чину розбавленої сірчаної кислоти та краплю розчину солі арсену. Щіль- но закрити пробірку фільтрувальним папером, змоченим 1–2 краплями розчину нітрату аргентуму, потім, трохи піднявши папір, внести у про- бірку кусок гранульованого цинку і знову швидко закрити отвір пробірки. Через декілька хвилин на внутрішній стороні фільтрувального паперу з’являється характерна пляма жовтого, коричневого або чорного кольору – в залежності від концентрації арсена в розчині:
2Na3AsO3 + 6Zn + 9H2SO4 = 2AsH3 + 6ZnSO4 + 3Na2SO4 + 6H2O
![]() + 3Zn +9H+
= AsH3
+ 3Zn2+
+ 3H2O
+ 3Zn +9H+
= AsH3
+ 3Zn2+
+ 3H2O
AsH3 + 6AgNO3 + 3H2O = H3AsO3 + 6Ag +6HNO3
AsH3 + 6Ag+ + 3H2O = H3AsO3 + 6Ag +6H+
Ця реакція використовується для визначення арсену в біологічних матеріалах та водах, забруднених промисловими відходами.
Реакція на йон Ві3+ з йодидом калію
До 0,5 мл розчину солі бісмуту добавити 2–3 краплі розчину КІ. Ви- падає чорно-коричневий осад йодиду бісмуту:
Ві(NO3)3 + 3KI = BiI3 + 3KNO3
Bi3+ + 3I– = BiI3
До одержаного осаду прилити ще (надлишок) розчину КІ та збовтати. Осад розчиняється з утворенням комплексної солі оранжевого кольору:
BiI3 + KI = K[BiI4]
BiI3 + I– = [BiI4]–
Реакція використовується для перевірки фармакопейного препарату ВіONO3.
