
- •Фізико-хімічні методи аналізу
- •Оптичні методи аналізу
- •Атомно-емісійна спектроскопія
- •Загальна схема спектральних приладів
- •Фотометрія полум’я
- •Люмінесцентний аналіз
- •Походження люмінесценції
- •Характеристики і закономірності люмінесценції
- •Якісний і кількісний аналіз
- •Можливості і практичне застосування
- •Абсорбційні методи аналізу
- •Електрохімічні методи аналізу
- •Кількісний аналіз проводять :
- •Практичне використання
- •Вольтамперометрія (полярографія)
- •Кулонометрія
- •Сорбційні (хроматографічні) методи аналізу
- •Рідинна хроматографія
- •Іонообмінна хроматографія
- •Гель-проникаюча хроматографія (молекулярне сито)
- •Газова хроматографія
- •Список літератури
Практичне використання
.
Кондуктометричні методи характеризуються
високою експресністю, простотою і
доступністю вимірювальних приладів,
зручністю роботи і достатньою точністю.
Прямі
кондуктометричні
вимірювання
мають
похибку
1...2
%. Похибка
кондуктометричного
титрування
без термостатування
розчинів
становить
приблизно
![]() .
Можуть
бути
проаналізовані
різного
роду
непрозорі
розчини,
зависи,
емульсії,
забарвлені
розчини.
.
Можуть
бути
проаналізовані
різного
роду
непрозорі
розчини,
зависи,
емульсії,
забарвлені
розчини.
Пряма кондуктометрія є найбільш ефективним методом контролю якості дистильованої і технічної води, оцінки забрудненості стічних вод. Кондукто- метричні датчики с успіхом використовуються в автоматизованих схемах контролю виробництва в деяких галузях хімічної, текстильної і харчової промисловості (для контролю якості молока, різноманітних напоїв і харчових продуктів). Широку область використання має кондуктометричне титрування сильних мінеральних кислот (НС1О4, НС1, НNO3 та ін.) і основ (NaOH, KOH та ін.) в водних розчинах для великих і досить малих концентрацій (до
10-4 моль/л). Великі можливості для розвитку нових методів аналізу відкриває використання неводних розчинників. наприклад, для визначення антибіотиків та інших продуктів фармацевтичної промисловості.
Вольтамперометрія (полярографія)
Даний метол аналізу засновано на процесах поляризації ( окисленні або відновленні) іонів на електроді. Суть метода полягає в наступному: в розчин поміщають два електроди, один з яких має велику поверхню і майже не поля-ризується (електрод порівняння), а другий – має набагато меншу поверхню (індикаторний електрод). Найчастіше використовують ртутні електроди, на яких відбувається відновлення великої кількості відомих іонів.На електроди подають напругу від зовнішнього джерела струму, яка плавно збільшується. Завдяки дуже малій поверхні індикаторного електроду густина струму (А/см2) на ньому досить велика. В результаті цього в частині розчину, яка знаходиться поблизу такого електроду, концентрація іонів,що визначаються, при електролізі швидко зменшується і в кінці кінців наступає момент рівноваги, коли всі іони, що підходять до електроду за рахунок дифузії, розряджаються і завдяки цьому сила струму стає постійною (граничний або дифузний струм iдиф). Відмічаючи силу струму, що проходить через ячейку, в залежності від поданої на електроди напруги отримують поляризаційні вольтамперні криві (полярограми, полярографічні хвилі). Потенціал напівхвилі Е1/2 (потенціал, що відповідає середині полярографічної хвилі) не залежить від концентрації іону, що відновлюється (окислюється), а залежить тільки від його природи і його використовують при проведені якісного аналізу.
Дифузний струм (iдиф)залежить від природи іону, його концентрації в розчині, параметрів полярографічної ячейки
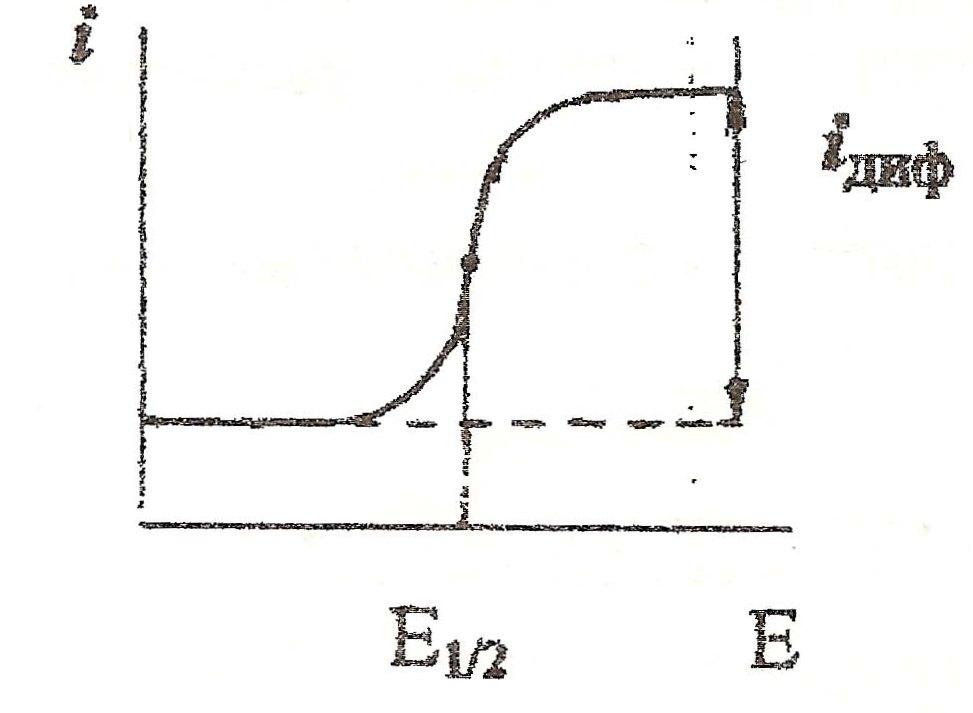 Кількісний
аналіз
проводять розра-
Кількісний
аналіз
проводять розра-
хунковим способом за рівнянням Ільковича
або застосовуючи градуювальник графік,
побудований в координатах iдиф - c(B).
Також використовують метод додатків.
Полярографію застосовують для визначення мікрокількостей (на рівні 10-6...10-4 г) важких металів, органічних речовини (альдегіди, кислоти, ароматичні речовини тощо).
Амперометричне титрування – це титриметричний варіант полярографії. Суть цього метода полягає в наступному: аліквоту аналізуємого розчину поміщають в електролізер з ртутним капаючим катодом і великим ртутним анодом. Між електродами встановлюють задану напругу, потрібну для виділення на катоді того чи іншого учасника реакції. Цей розчин титрують розчином реагенту, фіксуючи показання гальванометра. На основі отриманих результатів будують криву титрування, форма якої залежить від властивостей
I



 учасників
реакції. Злам на кривій титрування
учасників
реакції. Злам на кривій титрування
 2
відповідає точці еквівалентності.
2
відповідає точці еквівалентності.
1 3 Криві амперметричного титрування:
 т.е.
1 – на електроді відновлюється
визначаєма
т.е.
1 – на електроді відновлюється
визначаєма
 т.е.
т.е. речовина і не відновлюється
реагент; 2 – на
т.е.
т.е. речовина і не відновлюється
реагент; 2 – на
 електроді
відновлюються і визначаєма речови-
електроді
відновлюються і визначаєма речови-
V(реагенту) на і реагент; 3 – на електроді реагент віднов-
люється, а визначаєма речовина ні.
