
- •Фізико-хімічні методи аналізу
- •Оптичні методи аналізу
- •Атомно-емісійна спектроскопія
- •Загальна схема спектральних приладів
- •Фотометрія полум’я
- •Люмінесцентний аналіз
- •Походження люмінесценції
- •Характеристики і закономірності люмінесценції
- •Якісний і кількісний аналіз
- •Можливості і практичне застосування
- •Абсорбційні методи аналізу
- •Електрохімічні методи аналізу
- •Кількісний аналіз проводять :
- •Практичне використання
- •Вольтамперометрія (полярографія)
- •Кулонометрія
- •Сорбційні (хроматографічні) методи аналізу
- •Рідинна хроматографія
- •Іонообмінна хроматографія
- •Гель-проникаюча хроматографія (молекулярне сито)
- •Газова хроматографія
- •Список літератури
Рідинна хроматографія
Сорбційні методи аналізу розчинених в рідині речовин назвають методами рідинної хроматографії. В якості сорбентів використовують тверді гранульо-вані речовини, спеціальний папір, тонкий шар тонкодисперсних твердих ре-човин, закріплений на плоскій інертній підложці; органічні розчинники, які не змішуються з РФ. Сорбенти не повинні змішуватись з РФ, повинні бути механічно та хімічно стійкими в умовах аналізу, забезпечувати необхідну се-лективність та ефективність. Рідинну хроматографію проводять в колоночному та площинному варіантах.
Колоночну хроматографію проводять за наступною схемою: скляну трубку діаметром 0,2-5 см і довжиною 2-100 см заповнюють НФ, а РФ переміщується через НФ під дією сили тяжіння (класичний варіант) або під тиском до 40 МПа (високоефективна рідинна хроматографія ВРХ). На виході з колонки відбирають проби елюата і аналізують їх за допомогою різних хімічних або фізико-хімічних методів.
Іонообмінна хроматографія
Цей метод базується на хімічній реакції об-міну іонами між твердими гранульованими сорбентами (іонітами) і розчина-ми електролітів. Іоніти практично нерозчинні в РФ, з якими вони контактують. Основу гранули іоніту складає полімерний каркас (матриця), на якому закріплені функціональні групи. Заряд цих груп компенсується зарядом іонів протилежного знаку (протиіонів) і в цілому гранула іоніту нейтральна. Про-тиіони можуть заміщуватись на іони такого ж знаку при проходженні РФ че-рез іоніт. Протиіон функціональної групи визначає іонну форму іоніту.
Процес іонного обміну проходить такі головні стадії: 1) переміщення (дифузія) іона–витіснювача з розчину до функціональної групи гранули іоніту і витіснення протиіону; 2) переміщення витісненого протиіону з об’єму гранули іоніту до її поверхні; 3) дифузія витісненого іону з поверхні гра-нули іоніту в об’єм РФ.
Іоніти в залежності від природи функціональних груп можуть обмінюва- тись з розчином: катіонами (катіоніти), або аніонами (аніоніти). Катіоніти мають функціональні групи кислотної природи (-SO3-, -AsO32-, -PO32-, –COO-, –O-, -CH2COO- та ін.) і в якості протиіонів - катіони. Аніоніти містять функціональні групи основної природи (=N+=, =S+-, =P+=, –NH3+, =NH2+, ≡NH+ та ін. ) і містять в якості протиіонів - аніони.. Іоніти, які мають групи кислотної і основної природи , обмінюються з розчином катіонами і аніонами (амфоліти). Властивості іонітів мають природні речовини (силікагелі, бентоніти, глини, модифікована целюлоза, активоване вугілля та ін.). Однак вони, як правило, мають невелику обмінну ємність і не завжди відповідають вимогам до сорбентів. Найбільшого поширення набули синтетичні іоніти – високомолекулярні органічні речовини тривимірної структури. Їх отримують методами поліконденсації або емульсійної полімеризації органічних мономерів (стирол, дивінілбензол, фенолформальдегідні смоли та ін.). Процес іонного обміну відображають рівняннями хімічних реакцій:
катіонний обмін R-H + NaCl = R-Na + HCl
2R–Na + ZnSO4 = R2–Zn + Na2SO4
де R-H, R-Na, R2 – Zn – умовні позначення катіоніту в водневій, натрієвій, цинковій формах;
аніонний обмін: R-OH + NaCl = R-Cl + NaOH
2R–Cl + Na2SO4 = R2–SO4 + 2NaCl
де – R – OH , R – Cl , R2 – SO4 – умовні позначення аніоніту в гідроксильній, хлоридній, сульфатній формах.
Процеси іонного обміну проводять в умовах, які забезпечують строгу сте- хіометричність реакцій. Константа рівноваги іонного обміну описується рів- нянням Нікольського
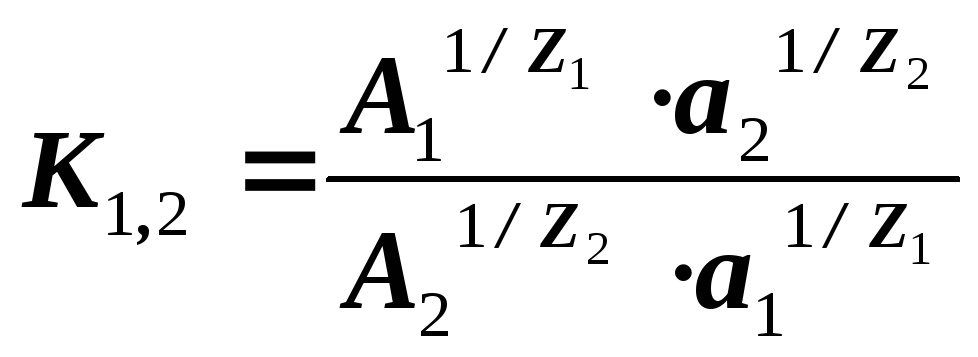
де А1, А2 - активності іонів сорбату і протиіонів в НФ; а1, а2 – активності іонів сорбату і протиіонів в РФ; z1, z2 - заряди іону сорбату і протиіону.
Кожний іон має певний коефіцієнт розподілу, за величинами яких роблять висновки про можливість розділення суміші іонів. Розділення іонів тим ефективніше, чім більше різниця в їх коефіцієнтах розподілу. Відношення кое-фіцієнтів розподілу двох іонів називають коефіцієнтом розділення іонів, який залежить від концентрації іонів в РФ , ступеня дисоціації функціональних груп іоніту, рН, іонної сили розчину, температури.
Підготовка іонітів до роботи полягає в замочувані їх в 5% -ному розчині хлориду натрію на 24 – 48 годин для набухання, очищенні їх від органічних і неорганічних домішок послідовним промиванням розчинами гідроксиду натрію і хлороводню ( 2 моль/л). Надлишки реагентів вимивають дистильова-ною водою. Очищений іоніт переводять у необхідну іонну форму, промива- ючи його розчином відповідного електроліту. Іоніти можна багаторазово переводити з однієї іонної форми в іншу ( регенерувати) практично без зміни їх сорбційних характеристик.
Іонний обмін в практиці аналізу застосовують для розділення сумішей
іонів, концентрування мікроелементів, видалення домішок. Цей процес широ ко застосовують для очищення води, технологічних розчинів, синтезу складних речовин тощо.
