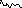- •Фізико-хімічні методи аналізу
- •Оптичні методи аналізу
- •Атомно-емісійна спектроскопія
- •Загальна схема спектральних приладів
- •Фотометрія полум’я
- •Люмінесцентний аналіз
- •Походження люмінесценції
- •Характеристики і закономірності люмінесценції
- •Якісний і кількісний аналіз
- •Можливості і практичне застосування
- •Абсорбційні методи аналізу
- •Електрохімічні методи аналізу
- •Кількісний аналіз проводять :
- •Практичне використання
- •Вольтамперометрія (полярографія)
- •Кулонометрія
- •Сорбційні (хроматографічні) методи аналізу
- •Рідинна хроматографія
- •Іонообмінна хроматографія
- •Гель-проникаюча хроматографія (молекулярне сито)
- •Газова хроматографія
- •Список літератури
Якісний і кількісний аналіз
Якісний люмінесцентний аналіз заснований на здатності досліджуваної речовини у відповідних умовах до люмінесценції, або, рідше, до гасіння люмі-несценції. Виникнення або зникнення люмінесценції звичайно спостерігається візуально. Власною люмінесценцією володіють іони лантанідів та ін., а також деякі органічні сполуки.
Дуже чутливими є якісні люмінесцентні реакції, які протікають при додаванні деяких органічних реактивів до розчину неорганічних речовин і супроводжуються яскравою люмінесценцією. Наприклад, інтенсивну люмінес-ценцію викликають додавання саліцилової кислоти до розчину солі цинку або 8-оксихіноліну до розчину солі літію, що може бути використане для їхнього якісного визначення.
За допомогою люмінесцентних вимірів можна проводити експрес-контроль якості зернових, м'ясних продуктів, різних видів рослинної сировини, готової продукції масложирової промисловості, хлібопекарської, кондитерської, молочно-консервної й інших галузей харчової промисловості.
Кількісний люмінесцентний аналіз засновано на прямій залежності інтенсивності люмінесценції від концентрації люмінесціюючої речовини. У практиці кількісного люмінесцентного аналізу звичайно застосовуються методи градуювального графіка, добавок і обмежуючих розчинів (див. розділ «Фото-метрія полум'я».) До теперішнього часу розроблені методи кількісного люміне-сцентного визначення майже всіх елементів при вмісті в середньому 1·10‑5 %.
Можливості і практичне застосування
Люмінесцентний метод аналізу відрізняється низькою межею виявлення (ГВ = 1·10-4 – 1·10-7 %), високою точністю аналізу (1-2 %), экспресністю, гарною відтворюваністю результатів вимірів (Sr = 0.01 - 0.05).
Методи, засновані на власній люмінесценції речовин, більш селективні, ніж методи визначення елементів, які використовують органічні реагенти. Вибірковість люмінесцентного аналізу можна підвищити, варіюючи експери- ментальними умовами (довжиною хвилі збудження і реєстрацією сигналу, хімічними параметрами, наприклад, pH розчину, температурою і т.д.)
Метод застосовують для визначення низьких вмістів іонів металів, зв'яза-них у люмінесцентний комплекс, для визначення мікотоксинів, антибіотиків, вітамінів групи B, алкалоїдів та ін. у харчовій сировині і продуктах харчування
Абсорбційні методи аналізу
Абсорбційні методи аналізу засновані на вибірковому поглинанні (абсор-бції) електромагнітного випромінювання частками (атомами, іонами, молекула-ми) речовини. При цьому речовина вступає у фізичну взаємодію з електромаг-нітним випромінюванням, поглинаючи його енергію. У результаті цього збіль-шується внутрішня енергія частки. Енергія, що поглинається речовиною, затра-чається на рух електронів, коливання атомів і обертання молекул. При цьому електрони, атоми або молекули переходять із основного стану з енергією Е в збуджений з енергіями Е', Е'' і т.д. Різниця в енергіях основного й збудженого станів відповідає поглинутій енергії
Е'
– Е = ∆Е = hν = h·с·ν =
![]() ,
,![]()
де h - стала Планка; с - швидкість світла у вакуумі.
Із цього рівняння випливає, що частота ν, хвильове число ν і довжина хвилі λ, при яких відбувається поглинання випромінювання речовиною – основ-ні величини, що характеризують різницю енергій основного і збудженого станів Ці величини тісно пов'язані із внутрішньою будовою атомів і молекул.
Фізичні зміни атомів і молекул залежать від частоти випромінювання, що поглинається, (табл. 3). Залежно від діапазону довжин хвиль (частот) випромі-нювання, що поглинається, розрізняють рентгенівську, ультрафіолетову (УФ), видиму, інфрачервону (ІЧ) і мікрохвильову спектроскопію. Кожен вид спектро-скопії обумовлений певними фізичними змінами частки речовини (табл. 3) Залежно від цих змін розрізняють: електронну, коливальну й обертальну спектроскопію.
Сукупність характерних (дозволених) для даної частки енергетичних станів називають її спектром поглинання. Розрізняють спектри обертання, молекулярного коливання, електронні. Тип спектра поглинання залежить від фізичних змін частки речовини при поглинанні енергії і, як правило, є сукуп-ністю різних спектрів частки (табл. 3). Спектр поглинання представляють у вигляді графічної залежності оптичних характеристик (оптична густина, інтен-сивність або потужність потоку випромінювання, пропускання випромінюван-ня) від довжини хвилі (частоти, хвильового числа) випромінювання, що погли-нається. Вигляд спектра поглинання залежить від будови частки (тобто дозво-лених для неї енергетичних рівнів). Оскільки переходи частки в різні енерге-тичні стани мають різну ймовірність, спектр поглинання являє собою криву, що має один або кілька максимумів. Прості частки (атоми, одноатомні іони) мають лінійний спектр, а складні (багатоатомні іони, молекули) - смугастий спектр. Чим складніша частка, тим складніший її спектр
Таблиця 3 - Електромагнітний спектр поглинання
λ, див 1 10-2 10-4 10-6 10-8 10-10
|
Спектра-льна область |
Мікро-хви-льо-ва |
Далека інф-ра-чер-вона |
Інфрачервона |
Видима |
Ультрафіо-летова |
Ультрафіоле-това вакуумна |
Рентгенів-ська |
|
П |
Обертання молекул | ||||||
|
Молекулярні коливання (атомів і груп атомів) | |||||||
|
| |||||||
|
Переходи внутрішніх електронів
| |||||||
.
Ёёё
Спектр поглинання використовують для: проведення якісного аналізу, вибору оптимальної довжини хвилі (частоти, хвильового числа) випромінюван-ня, що поглинається, при проведенні кількісного аналізу. Найбільша чутливість визначення (максимальний аналітичний сигнал) досягається при довжині хвилі (частоті, хвильовому числі), що відповідає максимуму спектра поглинання. Спектри поглинання реєструють за допомогою спектрографів, спектрофотомет-рів, фотоелектроколориметрів.
Кількісний аналіз абсорбційними методами засновано на вимірюванні зменшення інтенсивності (потужності) потоку електромагнітного випромінювання, пропущеного через шар речовини, і базується на дотриманні основного закону світлопоглинання (закону Бугера-Ламберта-Бера): розчини однієї і тієї ж забарвленої речовини при однаковій концентрації й товщині шару поглинають рівні кількості світлової енергії, тобто світлопоглинання таких розчинів однакове.
I
= I0
·
10-ε
· ι · с,
або А
= lg![]() = ε · с · ι
,
= ε · с · ι
,
де I0, I - інтенсивності падаючого і того, що пройшло через розчин, випромінювання, відповідно; ι - товщина шару розчину; ε - коефіцієнт поглинання, що не залежить від концентрації речовини; с - концентрація речовини; А - оптична густина.
Кількісний аналіз в УФ- і видимій спектроскопії засновано на строгому дотриманні основного закону світлопоглинання. Для забезпечення цього необхідне виконання наступних умов:
- падаюче випромінювання повинне бути строго монохроматичним і плоско- паралельним;
- випромінювання даної довжини хвилі (частоти) повинне поглинатися тільки одним типом часток;
- поглинаючі частки повинні бути рівномірно розподілені в об'ємі розчину, що аналізується, не взаємодіяти між собою й іншими компонентами;
- на поглинання частки не повинні впливати ні розчинник, ні іонна сила розчину;
- досліджуваний розчин повинен бути гомогенним ізотропним середовищем, що не розсіює, і розчинник повинен бути прозорий.
При проведенні кількісного аналізу використовують як прямі способи визначення концентрації (метод градуйовочного графіка, метод добавок тощо), так і титриметричні методи з фотометричним визначенням точки еквівалентності.
Ультрафіолетова і видима спектроскопії
Поглинання випромінювання в УФ- і видимій областях спектра пов'язані зі збудженням зовнішніх електронів (електронні спектри поглинання). В основно-му (незбудженому) стані електрони займають бідні енергією рівні
(σ- і π- орбіталі), а при збудженні вони переходять на рівні, багатші енергією, (n- орбіталі).
Поглинання випромінювання в УФ- і видимій областях обумовлене наяв-ністю в молекулі груп атомів, які називають хромофорами, що спричиняють забарвлення речовини. Хромофорами є групи, що містять одну або декілька кратних (ненасичених) зв'язків (=С=N‑, ‑N=N‑, ‑N=O) і їхні смуги поглинання викликані переходами електронів цих зв'язків. Слабоінтенсивні переходи можуть бути доказом наявності функціональних груп в молекулі і служать основою якісного аналізу.
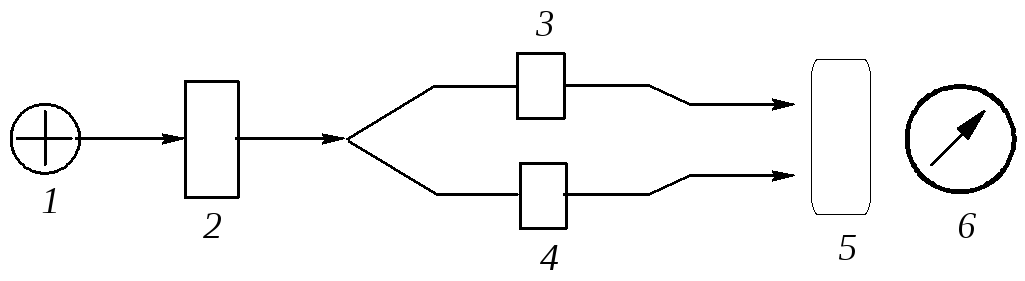
Рис. 8 - Блок-схема спектрофотометра (фотоколориметра): 1 - джерело випромінення; 2 – монохроматор; 3 – кювета з чистим розчинником (або порожня); 4 – кювета з досліджуваним розчином; 5 – приймач випромінення; 6 – реєстратор
Принцип дії: випромінювання від джерела 1 з безперервним спектром випромінювання пропускають через монохроматор 2 (дифракційна решітка або призма) для одержання монохроматичного (певної λ або ν) випромінюван--ня. Пучки монохроматичного випромінювання однакової інтенсивності (потужності) проходять паралельно через кювети однакової товщини із чистим розчинником (або порожню) 3 і розчином досліджуваної речовини в тому ж розчиннику 4. Потім у приймачі 5 порівнюються інтенсивності обох пучків Ι0 і Ι. Різниця інтенсивностей ∆І = Ι0 - Ι фіксується реєстратором 6.
Спектрофотометрія. Використовується випромінення такого діапазону довжин хвиль: 200...900 нм (УФ‑ , видима, ІЧ-області). Як монохроматор вико-ристовують дифракційну решітку (або призму), що дозволяє одержати строго монохроматичне випромінювання. Об'єкти аналізу - рідкі речовини й гомогенні розчини, що поглинають випромінювання даного діапазону. Якісний аналіз заснований на характеристичних спектрах поглинання. Кількісний аналіз заснований на дотриманні основного закону світлопоглинання. Градуювальний графік будують у координатах “оптична густина - концентрація речовини”. Інтервал робочих значень оптичної густини, що забезпечує максимальну відтворюваність результатів, дорівнює 0,10-1,0.
Криві спектрофотометричного титрування будують у координатах “оптична густина - об'єм розчину титранту”. Точку еквівалентності визначають по зламу кривої титрування.
Метод дозволяє аналізувати як індивідуальні речовини або однокомпонентні розчини, так і суміші речовин за умови різниці їхніх спектрів поглинання.
Фотоколориметрія. Використовують випромінення наступного діапазо-ну довжин хвиль : 400...750 нм (видима область). Об'єкти аналізу - рідкі забар-влені речовини або розчини. Як монохроматор використовують світлофільтри, що дозволяють одержувати поліхроматичне випромінювання вузького діапазо-ну довжин хвиль. Метод дозволяє виконувати ті ж визначення, що й спектрофо-тометрія, але з меншою точністю.
Атомно-абсорбційна спектроскопія (ААС). Це метод елементного аналізу, який проводять за інтенсивністю поглинання випромінювання шаром атомної пари елемента, що визначається. Використовують УФ-випромінювання, довжина хвилі якого відповідає найбільш інтенсивним і чутливим лініям спектра елемента, що визначається. Поглинання випромінення атомною парою підкоряється основному закону світлопоглинання. Кількісний аналіз проводять тільки прямими методами.
Принцип методу полягає в тому, що зразок, який аналізують, у вигляді аерозолю (аналогічно методу полум'яної фотометрії) або порошку вводять у зону високої температури атомізатора (полум'я горючого газу або електротермічний атомізатор). Під дією високої температури відбувається його випаровування і дисоціація молекул на окремі атоми. Цей процес називають атомізацією. Зона полум'я з атомною парою просвічується потоком характер-ристичного випромінювання певної інтенсивності. У результаті поглинання частини енергії атомами речовини інтенсивність світлового потоку зменшується, що реєструється за допомогою приймального пристрою (рис. 9).
Д жерела
повинні випускати випромінювання з
вузькими резонансними лініями шириною
0,01 - 0,001 нм. Як джерела резонансного
випромінювання
жерела
повинні випускати випромінювання з
вузькими резонансними лініями шириною
0,01 - 0,001 нм. Як джерела резонансного
випромінювання









1 2 3 4 5 6
Рис. 9- Блок-схема атомно-абсорбційного спектрофотометра: 1 – джерело
резонансного випромінювання; 2 – атомізатор; 3 – монохроматор;
4 – фотоелемент; 5 – підсилювач; 6 – гальванометр.
використовують лампи з порожнім катодом і кулькові лампи. Лампа з порожнім катодом являє собою циліндричну посудину, заповнену неоном або аргоном. Катод виготовлений з певного металу. Під дією високої напруги атоми інертно-го газу заряджаються й бомбардують катод. Атоми металу, які вибиваються з катода, збуджуються й випускають випромінювання характеристичної довжини хвилі. Якщо проводять визначення декількох металів у зразку ,то використову-ють лампи з комбінованим з декількох металів катодом.
У практиці ААС використовують горючі суміші, які складаються з паль-ного газу й газу-окислювача, склад яких наведений у табл. 4.
Таблиця 4- Полум'я, використовуване в ААС.
|
Пальний газ |
Температура °C | |
|
Ацетилен |
2100-2530 |
3000-3500 |
|
Бутан |
1300-1900 |
2900 |
|
Водень |
2000-2320 |
2500-2800 |
|
Пропан |
1900-2190 |
2800-3070 |
|
Ціан, диціан |
2590 |
4700-5200 |
Можливості і практичне застосування
Границя визначення становить 10-5 -10-6 %, точність 0.5-1 %.
ААС зараз є одним з найпоширеніших методів аналізу. Завдяки високій селективності цей метод дозволяє виключити стадію групового розділення елементів. Підготовка проби до аналізу зводиться до переведення її в розчин і відокремлення нерозчинних компонентів, наприклад SiO2. Цим методом можна визначати більше 60 елементів з досить високою чутливістю. Метод ААС використають, в основному, для визначення вмісту металів.
ІЧ-спектроскопія
ІЧ-спектроскопія відноситься до молекулярної оптичної спектроскопії, яка вивчає поглинання та відбиття електромагнітного випромінення молекула-ми в ІЧ-області. Поглинання молекулою випромінювання в ІЧ-області викликає коливання у молекулі - молекули переходять з нульового коливального стану переважно в перший збуджений стан. Такі типи коливань називають основними, власними або нормальними. Вони розташовані в області 400...4000 см-1 (25...2,5 мкм). Крім таких коливань у молекулах збуджуються також обертонні коливання (перехід на більш високі рівні) і комбінаційні коливання (накладення основних і обертонних коливань). Основні коливання підрозділяють на валентні (коливання в площині хімічного зв'язку) і деформаційні (пов'язані зі зміною валентних кутів молекули). На рис. 10 зазначені всі можливі види коливань трьохатомної молекули на прикладі молекули води. Рухом атома кисню можна знехтувати, тому що він розташований поблизу центра ваги молекули.
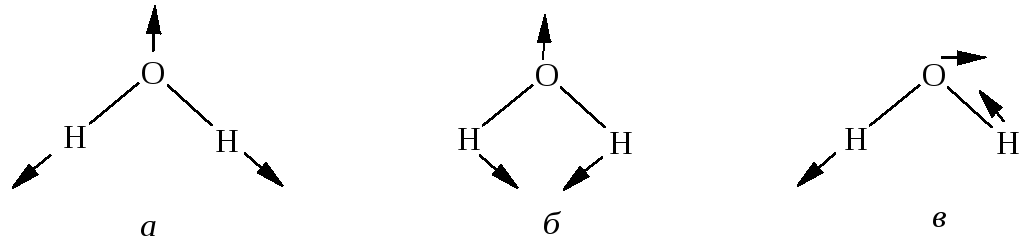
Рис. 10- Основні типи коливань трьохатомної молекули: а – валентне симетричне (паралельне); б – симетричне (паралельне); в – валентне (перпендикулярне антисиметричне).
Коливальні переходи обов’язково супроводжуються обертальними, тому коливальна спектральна лінія перетворюється в полосу, яка складається з множини ліній, а ІЧ-спектр є набором полос поглинання.
Закон Бугера-Ламберта-Бера справедливий для ІЧ-спектроскопії і тому ІЧ-спектри можна використати для кількісного аналізу. Таким чином, можна ідентифікувати й кількісно визначати сполуки (наприклад, стереоізомери), розділення яких хімічним шляхом викликає великі труднощі, у той час як по ІЧ-спектрах їх можна чітко розрізнити (наприклад, ізомери гексахлорциклогексану).
Можливості і практичне застосування
ІЧ-спектроскопія – метод ідентифікації і дослідження будови органічних і деяких неорганічних сполук. По ІЧ-спектрах можна зробити висновок про склад багатокомпонентних систем без іх хімічного розділення чи ідентифікув-авти індивідуальні речовини. Методом ІЧ-спектроскопії в харчових продуктах визначається вміст шкідливих жирів з транс-ізомерними жирними кислотами (жири з ненасиченими жирними кислотами, які в процесах гідрогенізації чи ізомерізації змінили цис-конфігурацію –СН=СН– груп ненасичених жирних кислот на транс конфігурацію). Визначення здійснюється по смузі поглинання з максимумом при 966 см‑ 1, що відноситься до несиметричних коливань зв'язку С-Н групи -СН=СН– з транс-розташуванням замісників. Слід відзначити, що завдяки достатньо високої границі визначення (10 – 0.1 %) і невеликої точністі результатів ( > 5 %) можливості використання ІЧ-спектроскопії в кількісному аналізі обмежено.

 ричини
погли-нання випромі-нювання
ричини
погли-нання випромі-нювання Переходи
зовнішніх
Переходи
зовнішніх  електронів
електронів