
- •Глава 1. Основні поняття та закони хімії
- •1.1. Основні поняття хімії
- •1.2. Фундаментальні та стехіометричні закони хімії
- •1.2.1. Закон збереження маси речовини
- •1.2.2. Закон сталості складу речовин
- •1.2.3. Закон кратних відношень
- •1.2.4. Закон еквівалентів.
- •1.3. Закони газового стану
- •1.3.1. Закон об’ємних відношень гей-люсака
- •1.3.2. Закон авогадро
- •1.3.3. Закон бойля – маріотта
- •Контрольні завдання
- •Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
- •В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
- •Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
- •Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
- •Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
- •Зі співвідношення (1.8) знаходимо еквівалентну масу h3ро4:
- •Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг к), а хлорид цього металу містить 61,2% металу.
- •Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: с – 82,76%, н – 17,24%.
- •Глава 2. Класи неорганічних сполук
- •2.1. Оксиди.
- •2.1.1. Способи одержання оксидів
- •2.1.2. Класифікація та хімічні властивості оксидів
- •2.2. Гідроксиди металів
- •2.2.1. Способи одержання гідроксидів
- •2.2.2. Хімічні властивості гідроксидів металів
- •2.3. Кислоти
- •2.3.1. Способи одержання кислот
- •2.3.2. Хімічні властивості кислот
- •2.4.1.Основні способи одержання солей
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •3.2. Корпускулярно-хвильова природа електрона
- •3.3. Принцип невизначеності
- •3.4. Періодичний закон
- •3.5. Періодична система елементів
- •3.6. Електронні хмари
- •3.7. Квантові числа
- •3.8. Принцип паулі
- •3.9. Послідовність заповнення електронами енерґетичних рівнів у багатоелектронних атомах
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •Приклад 8. Які найвищий та найнижчий ступені окислення у фосфору, сульфуру та хлору? Скласти формули сполук даних елементів, що відповідають цим ступеням окислення.
- •Приклад 12. Як залежать кислотно-основні властивості оксидів і гідроксидів від ступеня окиснення атомів елементів, що їх утворюють?
- •Приклад 13. Відомо, що кремній є неметалом з напівпровідниковими властивостями. Які властивості будуть виявляти алюміній і фосфор?
- •Приклад 15. Як змінюються властивості вищих оксидів елементів третього періоду?
- •4.1.1. Характерні властивості ковалентного зв’язку
- •4.1.1.1. Насиченість ковалентного зв’язку
- •Мал. 4.3. Різновиди σ-зв’язків.
- •Мал. 4.3. Різновиди π-зв’язків.
- •4.1.1.3. Полярність і поляризованість ковалентного зв’язку.
- •4.3. Водневий зв’язок
- •4.5. Міжчастинкові взаємодії
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач Приклад 1. Довжина диполя молекули дорівнює 2,2 10-11 м. Обчисліть дипольний момент молекули.
- •Приклад 2. Обчислити довжину зв’язку в молекулі hBr, якщо між’я-дерні відстані у молекулах h2 та Br2 відповідно дорівнюють 7,4 · 10-11 м та 2,28 10-10 м.
- •Приклад 3. Яка гібридизація електронних хмар має місце в атомі карбону при утворенні молекули cf4? Якою є просторова конфігурація цієї молекули?
- •Приклад 4. Якими є валентні можливості атома фосфору в основному та збудженому станах?
- •Приклад 5. Визначте, що є донором електронної пари при утворенні йона bh4-.
- •Глава 5. Основи хімічної термодинаміки
- •5.2. Перший закон термодинаміки
- •5.3. Закони термохімії
- •5.4. Поняття про ентропію
- •5.5. Другий закон термодинаміки
- •5.6.Третій закон термодинаміки
- •5.7. Вільна енергія Ґіббса
- •Приклад 1. Складіть термохімічне рівняння реакції горіння 1 моль ацетилену, якщо при цьому виділяється 1255,61 кДж теплоти.
- •Приклад 3. Не здійснюючи обчислень, поясніть, як змінюється ентропія системи (s): а) при переході води в пару; б) у реакції:
- •Приклад 4. Обчисліть зміну енерґії Ґіббса у хімічній реакції
- •І зробіть висновки про можливість мимовільного перебігу даної реакції за стандартних умов.
- •Стандартні зміни енерґій Ґіббса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •6.1. Поняття про швидкість хімічної реакції
- •6.2. Основний закон хімічної кінетики – закон діючих мас.
- •Межі застосування закону діючих мас.
- •6.3. Молекулярність реакції.
- •6.4. Порядок реакції.
- •6.5. Особливості кінетики гетероґенних реакцій.
- •6.6. Механізм хімічних реакцій.
- •6.7. Вплив температури на швидкість реакції. Правило Вант-Гоффа.
- •6.8. Рівняння Арреніуса. Енерґія активації
- •Вихідні Активов. Продукти
- •Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
- •Глава 7. Хімічна рівновага.
- •7.1. Константа хімічної рівноваги
- •7.2. Зсув хімічної рівноваги. Принцип Ле-Шательє
- •7.3. Рівновага у гетероґенних системах
- •Константа рівноваги.
- •Глава 8. Поняття про каталіз.
- •8.1. Автокаталіз
- •8.2.Промотори та каталітичні отрути
- •8.3. Селективність каталізаторів
- •8.4. Механізми гомоґенного та гетероґенного каталізу
- •Підставляючи дані нашої задачі, одержуємо:
- •Глава 9. Розчини
- •9.1. Процес розчинення. Типи розчинів
- •9.2. Способи виразу концентрації речовин
- •9.3. Хімічна (гідратна) теорія розчинів д.І. Менделєєва
- •9.4. Теплові ефекти розчинення
- •9.5. Розчинність
- •Глава 10. Властивості розчинів
- •10.1. Тиск пари розчинника над розчином
- •10.2. Температури замерзання та кипіння розчинів
- •10.3. Осмотичний тиск
- •Глава 11. Електролітична дисоціація.
- •11.1. Основні положення теорії електролітичної дисоціації
- •11.2. Ступінь дисоціації
- •11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
- •11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
- •11.5. Розчини сильних електролітів
- •11.6. Електролітична дисоціація води. Йонний добуток води. Водневий показник
- •11.7. Поняття про індикатори
- •11.8. Іонні реакції
- •11.8. Гідроліз солей
- •Типові випадки гідролізу.
- •11.8.1. Ступінь і константа гідролізу
- •Глава 12. Комплексні сполуки
- •12.1. Основні положення координаційної теорії а.Вернера
- •12.2. Класифікація комплексних сполук
- •12.3. Номенклатура комплексних сполук
- •12.3.1. Назви катіонних комплексних сполук
- •12.3.2. Назви аніонних комплексних сполук
- •12.3.3. Назви нейтральних комплексних сполук
- •12.4. Ізомерія комплексних сполук
- •12.5. Дисоціація комплексних сполук
- •Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішньоорбітальним. Іноді у комплексах проявляється йонно-дипольний зв’язок, наприклад в аквакомплексах.
- •Глава 13. Електрохімічні процеси
- •13.1. Хімічні процеси на електродах
- •13.2. Електродний потенціал
- •13.3. Електрохімічний ряд напруг металів
- •13.4. Гальванічний елемент
- •13.5. Окисні й відновні потенціали
- •13.6. Рівняння Нернста
- •13.7. Акумулятори
- •13.8. Паливні елементи
- •13.9. Електроліз
- •13.9.1. Закони Фарадея
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •13.10. Корозія металів
- •0,01 Моль/л 0,1 моль/л
- •Глава 14. Окисно-відновні реакції складання рівнянь окисно-відновних реакцій
- •Контрольні завдання
- •Додатки
- •Додаток 6 – Перехідні коефіцієнти
- •Предметний покажчик
- •Відновлення 18-19, 77, 81, 124, 126, 128, 135-139
- •Водень 14, 17, 37, 75, 125, 130-132, 139
- •Ізомерія 119
- •Лантаноїди 25
- •Натрій 20-21, 69, 89
- •Термодинамічні 8, 54
- •Атомів 33, 50
- •Список рекомендованої літератури
- •Глава 1. Основні поняття та закони хімії ........................ 5
Глава 10. Властивості розчинів
Властивості розчинів можуть залежати від природи розчинених речовин та розчинників, а також від відносного числа частинок речовин у розчині. Властивості, які залежать лише від концентрації та не залежать від природи розчинених речовин називаються коліґативними. До таких властивостей відносяться тиск пари розчинника над розчином, температура фазового переходу розчину порівняно з чистим розчинником і осмотичний тиск розчину.
10.1. Тиск пари розчинника над розчином
Якщо розчинити у рідині нелетку речовину, то тиск насиченої пари розчинника над рідиною знижується, бо зменшення концентрації розчинника порушує рівновагу рідина – пара. Залежність зниження тиску пари розчинника над розчином залежно від його концентрації виражається першим законом Рауля (1887): відносне пониження тиску насиченої пари розчинника над розчином дорівнює мольній (молярній) частці розчиненої речовини:
д![]() ерр-ка
та рр-ну
– тиск насиченої пари розчинника над
чистим розчинником і над розчином, а n1
та n2
– кількості розчинника та розчиненої
речовини відповідно.
ерр-ка
та рр-ну
– тиск насиченої пари розчинника над
чистим розчинником і над розчином, а n1
та n2
– кількості розчинника та розчиненої
речовини відповідно.
Закон Рауля виведено для розчинів нелетких речовин у летких розчинниках. Якщо ж парціальним тиском розчиненої речовини не можна знехтувати, то закон Рауля залишається справедливим для розчинника, а для розчиненої речовини є справедливим закон Генрі, згідно з яким розчинність леткої речовини пропорційна її парціальному тискові:
Рреч. = k · N2.
10.2. Температури замерзання та кипіння розчинів
Зниження тиску пари над розчином впливає на температуру замерзання (кристалізації) та кипіння розчинів. Явища пониження температури замерзання розчинів і підвищення температури кипіння розчинів нелетких речовин одержали назви кріоскопії та ебуліоскопії відповідно. Згідно з другим законом Рауля (наслідок із першого закону): підвищення температури кипіння та зниження температури замерзання розчину відносно чистого розчинника пропорційні моляльній концентрації розчиненої речовини:
ΔТкип. = Кебул. · μ ; ΔТзам. = Ккріоск. · μ ,
де μ – моляльна концентрація розчиненої речовини, а Кебул. та Ккріоск – ебуліоскопічна та кріоскопічна константи, які залежать лише від властивостей розчинника – його температури кипіння (замерзання), молярної маси та теплоти випаровування (плавлення): К = (RT2M): ΔН.
За зміною температур кипіння та замерзання розчинів можна визначити молярну (молекулярну) масу розчиненої речовини.
10.3. Осмотичний тиск
Коли у розчинах, відокремлених напівпроникною перетинкою (пропускає часточки розчинника, але не пропускає часточки розчиненої речовини), виникають нерівності концентрацій, то відбувається дифузія – процес самочинного вирівнювання концентрацій речовини внаслідок теплового руху частинок розчинника з простору з меншою концентрацією розчиненої речовини до простору з більшою концентрацією. Явище такої дифузії називається осмосом, а тиск, що є причиною осмосу – осмотичним тиском.
Осмотичний тиск розчину – це такий тиск, який створила би розчинена речовина, коли б вона перебувала у газоподібному стані при тій же температурі та займала об’єм розчину. Закон осмотичного тиску було відкрито Пфеффером та Вант-Гоффом у 1887 році. Його можна сформулювати:
осмотичний тиск розчину пропорційний молярній концентрації розчину та температурі: π = СМRT.
Даний вираз нагадує рівняння стану ідеального газу Клапейрона-Менделєєва, що свідчить про те, що у розведених розчинах частинки речовини поводяться дещо подібно до молекул газу. Виразивши молярну концентрацію через масу, молярну масу розчиненої речовини та об’єм розчину можна скласти вираз для молярної маси через осмотичний тиск.:
М = (mRT)/(πV).
Питання для самоперевірки
1. Як змінюється осмотичний тиск зі збільшенням концентрації розчиненої речовини?
2. У якому випадку пружність пари розчинника більша: над чистим розчинником чи над розчином нелеткої речовини в даному розчиннику?
3. Який фізичний зміст кріоскопічної та ебуліоскопічної констант?
Що таке ізотонічний коефіцієнт? Як, використовуючи закон Вант-Гофа, можна визначити його значення?
Як, користуючись другим законом Рауля, можна визначити масу розчиненої речовини?
КОНТРОЛЬНІ ЗАВДАННЯ
1. Розчин, що містить 80 г нафталіну (С10Н8) у 200 г діетилового етеру, кипить при 35,7 оС, а чистий етер – при 35 оС. Обчисліть ебуліоскопічну константу етеру.
Відповідь: 0,224.
2. Обчисліть кріоскопічну константу оцтової кислоти, знаючи, що розчин, що містить 4,25 г антрацену (С14Н10) у 100 г оцтової кислоти кристалізується при 15,718 оС. Температура кристалізації оцтової кислоти 16,65 оС.
Відповідь: 3,9.
3. Обчисліть температуру кипіння розчину нафталіну (С10Н8) у бензолі з масовою часткою нафталіну 5 %. Температура кипіння бензолу 80,2 оС, а ебуліоскопічна константа його дорівнює 2,57.
Відповідь: 81,25 оС.
4. При розчиненні 4,86 г сірки в 60 г бензолу температура кипіння його підвищилася на 0,81 оС. Скільки атомів сульфуру містить молекула сірки в цьому розчині, якщо ебуліоскопічна константа бензолу дорівнює 2,57?
Відповідь: 8.
5. Температура кристалізації розчину, що містить 66,3 г деякого неелектроліту в 500 г води дорівнює – 0,558 оС. Обчисліть молекулярну масу розчиненої речовини. Кріоскопічна константа води дорівнює 1,86.
Відповідь: 442 г/моль.
6. Обчисліть температуру кристалізації розчину етилового спирту з масовою часткою С2Н5ОН 2%, якщо кріоскопічна константа води дорівнює 1,86.
Відповідь: – 0,82 оС.
7. Скільки грамів сечовини ((NH2)2CO) слід розчинити в 250 г води, щоб температура кипіння підвищилася на 0,26 оС. Ебуліоскопічна константа води дорівнює 0,52.
Відповідь: 7,5 г.
8. При розчиненні 2,3 г деякого неелектроліту в 125 г води температура кристалізації понизилася на 0,372 оС. Обчисліть молярну масу розчиненої речовини. Кріоскопічна константа води Ккр. = 1,86.
Відповідь: 92 г/моль.
9. Обчисліть температуру кипіння водного розчину з масовою часткою гліцерину (С3Н5(ОН)3) 15 %. Ебуліоскопічна константа води дорівнює 0,52.
Відповідь: 100,997 оС.
10. Обчисліть масову частку глюкози (С6Н12О6) у водному розчині, знаючи, що цей розчин кипить при 100,26 оС. Ебуліоскопічна константа води рівна 0,52.
Відповідь: 8,26 %.
11. Скільки грамів фенолу (С6H5ОН) слід розчинити в 125 г бензолу, щоб температура кристалізації розчину була нижче температури кристалізації бензолу на 1,7 оС. Кріоскопічна константа бензолу дорівнює 5,1.
Відповідь: 3,91 г.
12. Обчисліть масову частку метанолу (СН3ОН) у водному розчині, температура кристалізації якого to = – 2,79 оС. Кріоскопічна константа води Kкр. = 1,86.
Відповідь: 4,58 %.
13. Обчисліть молярну масу неелектроліту, знаючи, що розчин, що містить 2,25 г цієї речовини в 250 г води кристалізується при температурі – 0,279 оС. Кріоскопічна константа води дорівнює 1,86.
Відповідь: 60 г/моль.
14. Обчисліть масову частку гліцерину (С3Н5(ОН)3) у водному розчині, знаючи, що цей розчин кипить при 100,39 оС. Ебуліоскопічна константа води дорівнює 0,52.
Відповідь: 6,45 %.
15. Розчин, що містить 3,04 г камфори (С10H16O) у 100 г бензолу, кипить при 80,714 оС. Температура кипіння бензолу 80,2 оС. Обчисліть ебуліоскопічну константу бензолу.
Відповідь: 2,57.
16. Обчисліть температуру кристалізації розчину сечовини, що містить 5 г сечовини ((NH2)2CO) у 150 г води. Кріоскопічна константа води дорівнює 1,86.
Відповідь: –1,03 оС.
17. Скільки грамів карбаміду ((NH2)2CO) слід розчинити в 125 г води, щоб температура кипіння підвищилася на 0,26 оС. Ебуліоскопічна константа води дорівнює 0,52.
Відповідь: 3,75 г.
18. Чόму дорівнює осмотичний тиск розчину глюкози (С6Н12О6) з молярною концентрацією 0,5 моль/л при 25 оС?
Відповідь: 1,24 МПа.
19. Обчисліть осмотичний тиск розчину, що містить 16 г С12Н22О11 (цукрози) у 150 г води. Густину розчину вважати рівною 1.
Відповідь: 311 кПа.
20. При 25оС осмотичний тиск розчину, що містить 2,8 г високомолекулярної сполуки в 200 мл розчину, дорівнює 0,7 кПа. Знайдіть Mr розч. речовини.
Відповідь: 4,95 104 а.о.м.
21. Скільки молів неелектроліту повинен містити 1 л розчину, щоб його осмотичний тиск при 25 оС дорівнював 2,47 кПа?
Відповідь: 0,001 моль.
22. Чόму дорівнює осмотичний тиск розчину аніліну (С6Н5NH2), у 1 л якого міститься 3,1 г цієї речовини при температурі 21 оС?
Відповідь: 8 104 Па.
23. Визначте осмотичний тиск розчину, що містить у 1 л 18,4 г гліцерину (С3Н5(ОН)3) при температурі 0 оС.
Відповідь: 4,54 102 Па.
24. Визначте осмотичний тиск розчину, що містить 190 г глюкози (С6Н12О6) у 4 л розчину при температурі 27 оС.
Відповідь: 3,12 102 Па.
25. У 0,5 л розчину міститься 2 г неелектроліту. Цей розчин при температурі 0 оС має осмотичний тиск, рівний 5,1 104 Па. Визначте молекулярну масу розчиненої речовини.
Відповідь: 178 а.o.м.
26. Знайдіть при 65 оС тиск пари над розчином, що містить 13,68 г цукрози (С12Н22О11) у 90 г води, якщо тиск насиченої пари над водою при тій самій температурі дорівнює 25 кПа (187,5 мм рт.ст).
Відповідь: 24,8 кПа.
27. Чому дорівнює тиск насиченої водяної пари над 10 % розчином карбаміду ((NH2)2CO) при 100 оС, якщо над водою він дорівнює 101320 Па?
Відповідь: 98 кПа.
28. Визначте тиск пари над розчином сечовини у воді з масовою часткою ((NH2)2CO) 10 % при 100 оС, якщо р0(Н2О) = 115 844 Па?
Відповідь: 1,12 105 Па.
29. Визначте відносну молекулярну масу аніліну, знаючи, що при температурі 30 оС тиск пари над розчином аніліну, що містить 3,09 г цієї речовини в 370 г етеру дорівнює 8,58 104 Па. Тиск пари чистого етеру при цій же температурі дорівнює 8,64 104 Па.
Відповідь: 92 а.о.м.
30. При 65 оС тиск пари над водою дорівнює 25003 Па. Визначте тиск пари над розчином 34,2 г цукру (С12Н22О11) у 90 г води за цієї ж температури.
Відповідь: 24512 Па.
31. Тиск водяної пари над розчином неелектроліту при температурі 80 оС дорівнює 1,4 104 Па. Скільки молів води приходиться на 1 моль розчиненої речовини, якщо тиск пари води при цій же температурі дорівнює 47375 Па.
Відповідь: 2,4.
32. Тиск пари над водою при 50 оС дорівнює 12334 Па. Обчисліть тиск пари над розчином 50 г етиленгліколю (С2Н4(ОН)2) у 900 г води при цій же температурі.
Відповідь: 12140 П а.
Приклади розв’язання задач
Приклад 1. Обчислити температури кристалізації і кипіння водного розчину глюкози з масовою часткою C6Н12O6 2%.
Розв’язання. За законом Рауля зниження температури кристалізації і підвищення температури кипіння розчину (to) у порівнянні з температурами кристалізації і кипіння розчинника виражається рівнянням
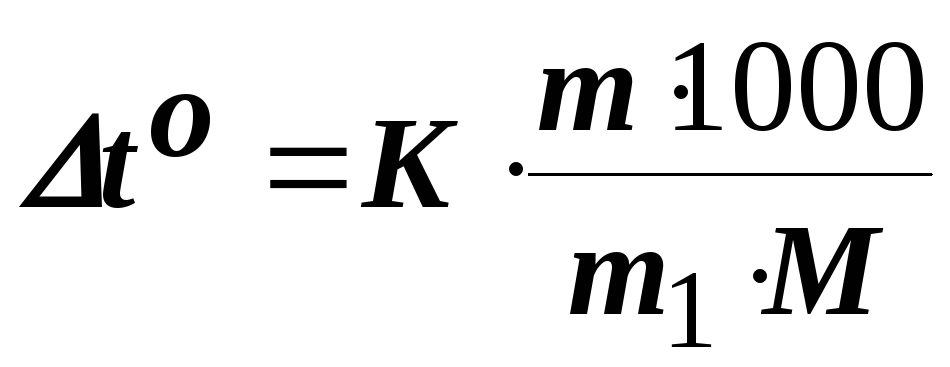 (8.1.)
(8.1.)
де К – кріоскопічна чи ебуліоскопічна константа (для води вони відповідно рівні 1,86 і 0,52 град/(кг моль)); m і М – відповідно маса і молярна маса розчиненої речовини; m1 – маса розчинника (г).
Зниження
температури кристалізації 2-відсоткового
розчину C6Н12O6
знаходимо за формулою (8.1):
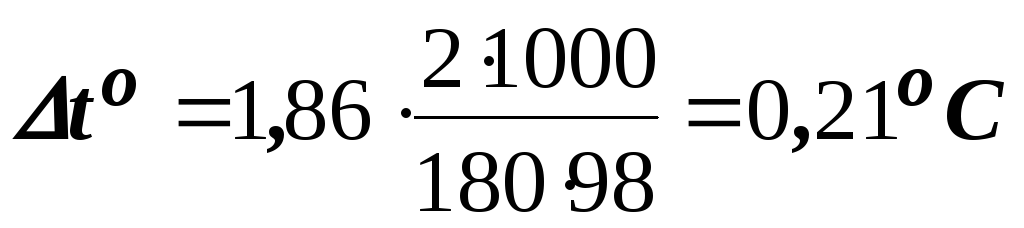 .
.
Вода кристалізується при 0оC, отже температура кристалізації розчину складе toкрист. = 0 – 0,21 = – 0,21оC.
За
формулою (8.1) знаходимо підвищення
температури кипіння 2%-го розчину
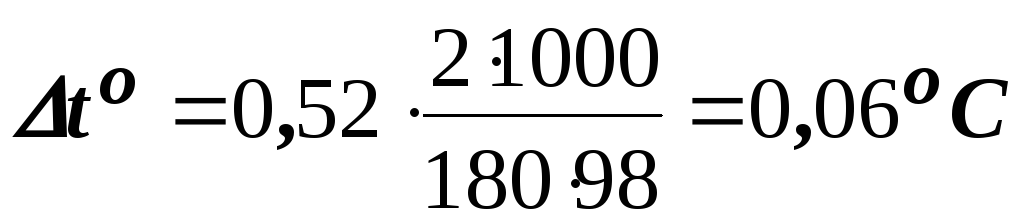 .
.
Вода кипить при 100оC, отже температура кипіння цього розчину буде toкип. = 100 + 0,06 = 100,06оC.
Приклад 2. Розчин, що містить 1,22 г бензойної кислоти C6Н5СООН у 100 г сірковуглецю, кипить при 46,529оC. Температура кипіння сірковуглецю 46,3оС. Обчислити ебуліоскопічну константу сірковуглецю.
Розв’язання. Підвищення температури кипіння to = 46,529 – 46,3 = =0,229оC. Молярна маса бензойної кислоти складає 122 г/моль. За формулою (8.1) знаходимо ебуліоскопічну константу:
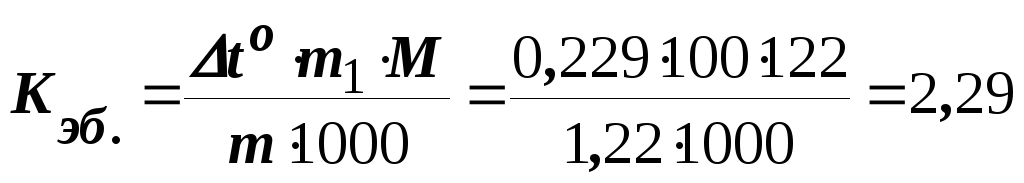 град/(кг
моль).
град/(кг
моль).
Приклад 3. Розчин, що містить 11,04 г гліцерину в 800 г води кристалізується при – 0,279оC. Обчислити молярну масу гліцерину.
Розв’язання. Температура кристалізації чистої води дорівнює 0оC, а зниження температури кристалізації to = 0 – (– 0,279o) = 0,279оC. Маса гліцерину, що доводиться на 1000 г води, дорівнює (11,04 1000) : 800 = 13,8 г. Підставляючи в рівняння (8.1), знаходимо М:
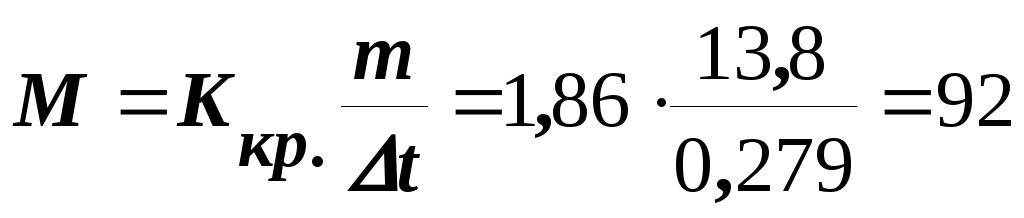 г/моль.
г/моль.
Приклад 4. Обчислити масову частку сечовини ((NH2)2CO) у водному розчині, знаючи, що температура кристалізації цього розчину to = – 0,465оC.
Розв’язання. Температура кристалізації чистої води дорівнює 0оC, отже зниження температури кристалізації to = 0о – (– 0, 465o) = 0,465оC. Молярна маса сечовини становить 60 г/моль. Знаходимо масу розчиненої речовини, що припадає на 1000 г води за формулою:
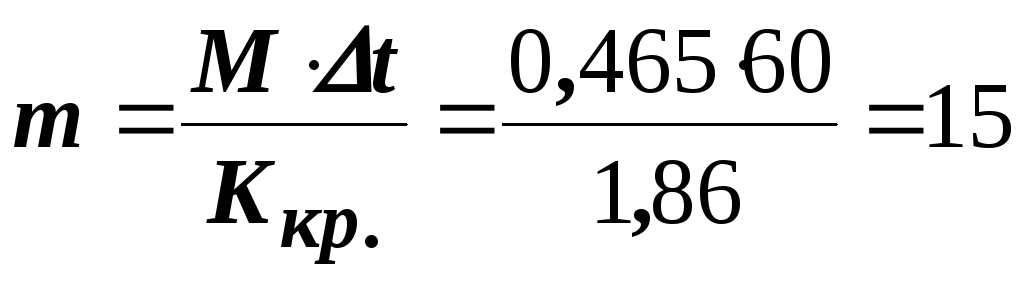 г.
г.
Загальна маса розчину, що містить 15 г сечовини, дорівнює 1000 + 15 = =1015 г. Масову частку сечовини знаходимо за формулою:
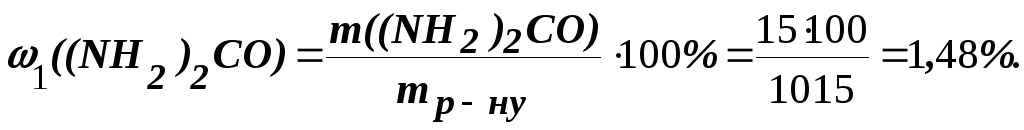
Приклад 5. Обчислити осмотичний тиск розчину, що містить у 1,4 л 63 г глюкози (C6Н12O6) при 0оC.
Розв’язання.
Осмотичний тиск розчину визначають за
законом Вант-Гоффа
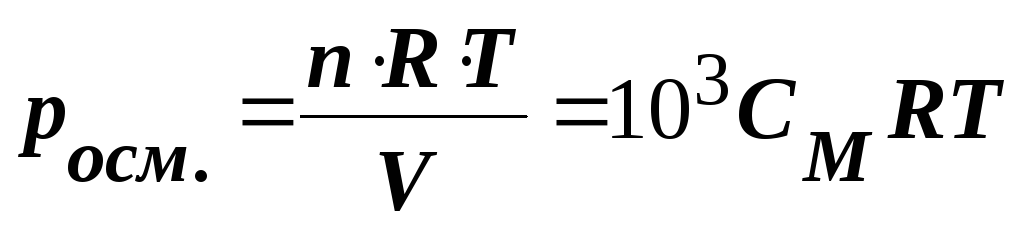 (8.2.)
(8.2.)
де n – кількість розчиненої речовини; V – об’єм розчину, м3; R – універсальна газова стала (8,314 Дж/(моль К)); T – абсолютна температура, K; СМ – молярна концентрація, моль/л.
У 1,4 л розчини міститься 63 г глюкози, молярна маса якої дорівнює 180,16 г/моль. Отже, кількість глюкози, що міститься в 1,4 л:
n = 63 : 180,16 = 0,35 моль.
Осмотичний тиск цього розчину глюкози становитиме
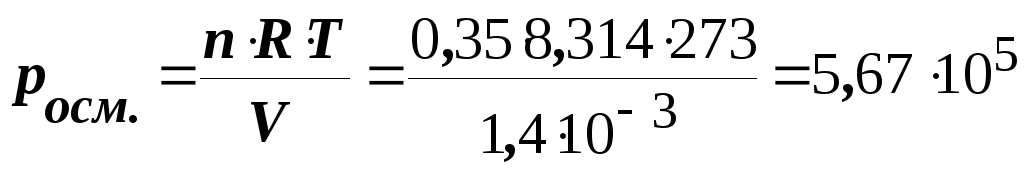 Па.
Па.
Приклад 6. Обчислити тиск пари над розчином, що містить 34,23 г цукру (C12Н22O11) у 45,05 г води при 65оC, якщо тиск пари води при цій температурі дорівнює 2,5 104 Па
Розв’язання. Тиск пари над розчином неелектроліту та нелеткої речовини у певному розчиннику завжди нижчий тиску пари над цим же чистим розчинником за однакової температури. Відносне зниження тиску пари розчинника над розчином відповідно до закону Рауля виражають співвідношенням
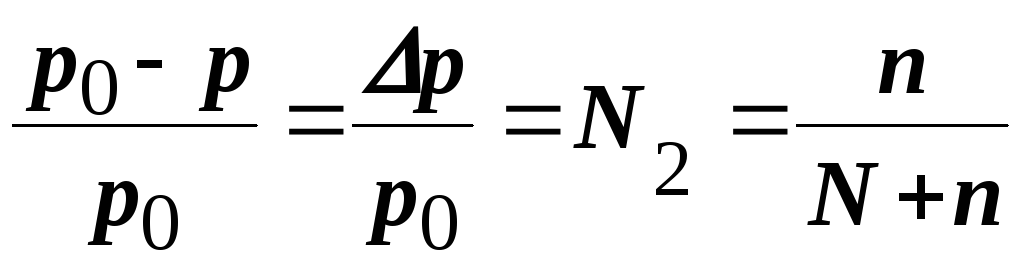 (8.3.)
(8.3.)
де р0 і р – тиски пари відповідно над чистим розчинником і розчинника над розчином; N2 – мольна частка розчиненої речовини; n – кількість молів розчиненої речовини; N – кількість молів розчинника.
Молярна маса цукру (C12Н22O11) дорівнює 342,3 г/моль, молярна маса води – 18,02 г/моль. Таким чином, кількість розчиненої речовини n = 34,23:342,3= = 0,1 моль, а води N = 45,05:18,02 = 2,5 моль.
Отже, тиск пари над розчином становитиме
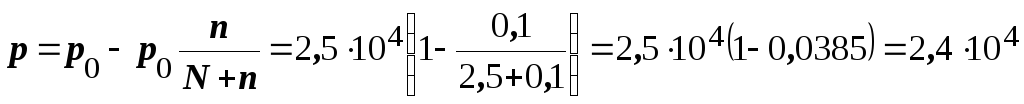 Па.
Па.
