
- •Глава 1. Основні поняття та закони хімії
- •1.1. Основні поняття хімії
- •1.2. Фундаментальні та стехіометричні закони хімії
- •1.2.1. Закон збереження маси речовини
- •1.2.2. Закон сталості складу речовин
- •1.2.3. Закон кратних відношень
- •1.2.4. Закон еквівалентів.
- •1.3. Закони газового стану
- •1.3.1. Закон об’ємних відношень гей-люсака
- •1.3.2. Закон авогадро
- •1.3.3. Закон бойля – маріотта
- •Контрольні завдання
- •Б) Із закону Авогадро випливає, що об’єм 0,025 моль h2s за нормальних умов
- •В) Відомо, що 1 моль будь-якої речовини містить 6,02 · 1023 молекул. Молярний об’єм газу за нормальних умов складає 22,4 л. Тому справедливо
- •Приклад 3. Який об’єм за нормальних умов займуть 4 10-4 м3 газу, що знаходиться при 50оС й тиску 9,54 104 Па?
- •Приклад 4. При згорянні 5 г металу утворилося 9,44 г оксиду металу. Визначити еквівалентну масу металу.
- •Приклад 5. Деяка кількість металу, еквівалентна маса якого дорівнює 28 г/моль, витісняє з кислоти 1,4 л водню, виміряного за нормальних умов. Визначити масу металу.
- •Розв’язання. Відповідно до закону еквівалентів (1.1), маси взаємодіючих речовин пропорційні їхнім еквівалентним масам:
- •Зі співвідношення (1.8) знаходимо еквівалентну масу h3ро4:
- •Приклад 8. Обчислити точну атомну масу металу, якщо питома теплоємність металу дорівнює 0,23 кДж/(кг к), а хлорид цього металу містить 61,2% металу.
- •Приклад 10. Визначити формулу речовини, якщо відомо, що її густина за воднем дорівнює 29, а масові частки елементів наступні: с – 82,76%, н – 17,24%.
- •Глава 2. Класи неорганічних сполук
- •2.1. Оксиди.
- •2.1.1. Способи одержання оксидів
- •2.1.2. Класифікація та хімічні властивості оксидів
- •2.2. Гідроксиди металів
- •2.2.1. Способи одержання гідроксидів
- •2.2.2. Хімічні властивості гідроксидів металів
- •2.3. Кислоти
- •2.3.1. Способи одержання кислот
- •2.3.2. Хімічні властивості кислот
- •2.4.1.Основні способи одержання солей
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •3.2. Корпускулярно-хвильова природа електрона
- •3.3. Принцип невизначеності
- •3.4. Періодичний закон
- •3.5. Періодична система елементів
- •3.6. Електронні хмари
- •3.7. Квантові числа
- •3.8. Принцип паулі
- •3.9. Послідовність заповнення електронами енерґетичних рівнів у багатоелектронних атомах
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач
- •Приклад 8. Які найвищий та найнижчий ступені окислення у фосфору, сульфуру та хлору? Скласти формули сполук даних елементів, що відповідають цим ступеням окислення.
- •Приклад 12. Як залежать кислотно-основні властивості оксидів і гідроксидів від ступеня окиснення атомів елементів, що їх утворюють?
- •Приклад 13. Відомо, що кремній є неметалом з напівпровідниковими властивостями. Які властивості будуть виявляти алюміній і фосфор?
- •Приклад 15. Як змінюються властивості вищих оксидів елементів третього періоду?
- •4.1.1. Характерні властивості ковалентного зв’язку
- •4.1.1.1. Насиченість ковалентного зв’язку
- •Мал. 4.3. Різновиди σ-зв’язків.
- •Мал. 4.3. Різновиди π-зв’язків.
- •4.1.1.3. Полярність і поляризованість ковалентного зв’язку.
- •4.3. Водневий зв’язок
- •4.5. Міжчастинкові взаємодії
- •Контрольні завдання
- •Приклади виконання завдань і розв’язання задач Приклад 1. Довжина диполя молекули дорівнює 2,2 10-11 м. Обчисліть дипольний момент молекули.
- •Приклад 2. Обчислити довжину зв’язку в молекулі hBr, якщо між’я-дерні відстані у молекулах h2 та Br2 відповідно дорівнюють 7,4 · 10-11 м та 2,28 10-10 м.
- •Приклад 3. Яка гібридизація електронних хмар має місце в атомі карбону при утворенні молекули cf4? Якою є просторова конфігурація цієї молекули?
- •Приклад 4. Якими є валентні можливості атома фосфору в основному та збудженому станах?
- •Приклад 5. Визначте, що є донором електронної пари при утворенні йона bh4-.
- •Глава 5. Основи хімічної термодинаміки
- •5.2. Перший закон термодинаміки
- •5.3. Закони термохімії
- •5.4. Поняття про ентропію
- •5.5. Другий закон термодинаміки
- •5.6.Третій закон термодинаміки
- •5.7. Вільна енергія Ґіббса
- •Приклад 1. Складіть термохімічне рівняння реакції горіння 1 моль ацетилену, якщо при цьому виділяється 1255,61 кДж теплоти.
- •Приклад 3. Не здійснюючи обчислень, поясніть, як змінюється ентропія системи (s): а) при переході води в пару; б) у реакції:
- •Приклад 4. Обчисліть зміну енерґії Ґіббса у хімічній реакції
- •І зробіть висновки про можливість мимовільного перебігу даної реакції за стандартних умов.
- •Стандартні зміни енерґій Ґіббса простих речовин прийнято вважати рівними нулю. Для даної системи:
- •6.1. Поняття про швидкість хімічної реакції
- •6.2. Основний закон хімічної кінетики – закон діючих мас.
- •Межі застосування закону діючих мас.
- •6.3. Молекулярність реакції.
- •6.4. Порядок реакції.
- •6.5. Особливості кінетики гетероґенних реакцій.
- •6.6. Механізм хімічних реакцій.
- •6.7. Вплив температури на швидкість реакції. Правило Вант-Гоффа.
- •6.8. Рівняння Арреніуса. Енерґія активації
- •Вихідні Активов. Продукти
- •Мал.6.3. Енерґетична діаграма Мал.6.4. Розподіл молекул за
- •Глава 7. Хімічна рівновага.
- •7.1. Константа хімічної рівноваги
- •7.2. Зсув хімічної рівноваги. Принцип Ле-Шательє
- •7.3. Рівновага у гетероґенних системах
- •Константа рівноваги.
- •Глава 8. Поняття про каталіз.
- •8.1. Автокаталіз
- •8.2.Промотори та каталітичні отрути
- •8.3. Селективність каталізаторів
- •8.4. Механізми гомоґенного та гетероґенного каталізу
- •Підставляючи дані нашої задачі, одержуємо:
- •Глава 9. Розчини
- •9.1. Процес розчинення. Типи розчинів
- •9.2. Способи виразу концентрації речовин
- •9.3. Хімічна (гідратна) теорія розчинів д.І. Менделєєва
- •9.4. Теплові ефекти розчинення
- •9.5. Розчинність
- •Глава 10. Властивості розчинів
- •10.1. Тиск пари розчинника над розчином
- •10.2. Температури замерзання та кипіння розчинів
- •10.3. Осмотичний тиск
- •Глава 11. Електролітична дисоціація.
- •11.1. Основні положення теорії електролітичної дисоціації
- •11.2. Ступінь дисоціації
- •11.3. Слабкі електроліти. Константа дисоціації слабких електролітів
- •11.4. Вплив однойменних іонів на дисоціацію слабких електролітів
- •11.5. Розчини сильних електролітів
- •11.6. Електролітична дисоціація води. Йонний добуток води. Водневий показник
- •11.7. Поняття про індикатори
- •11.8. Іонні реакції
- •11.8. Гідроліз солей
- •Типові випадки гідролізу.
- •11.8.1. Ступінь і константа гідролізу
- •Глава 12. Комплексні сполуки
- •12.1. Основні положення координаційної теорії а.Вернера
- •12.2. Класифікація комплексних сполук
- •12.3. Номенклатура комплексних сполук
- •12.3.1. Назви катіонних комплексних сполук
- •12.3.2. Назви аніонних комплексних сполук
- •12.3.3. Назви нейтральних комплексних сполук
- •12.4. Ізомерія комплексних сполук
- •12.5. Дисоціація комплексних сполук
- •Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішньоорбітальним. Іноді у комплексах проявляється йонно-дипольний зв’язок, наприклад в аквакомплексах.
- •Глава 13. Електрохімічні процеси
- •13.1. Хімічні процеси на електродах
- •13.2. Електродний потенціал
- •13.3. Електрохімічний ряд напруг металів
- •13.4. Гальванічний елемент
- •13.5. Окисні й відновні потенціали
- •13.6. Рівняння Нернста
- •13.7. Акумулятори
- •13.8. Паливні елементи
- •13.9. Електроліз
- •13.9.1. Закони Фарадея
- •1. Кількість речовини, що виділяється на електроді під час електролізу, пропорційна кількості електрики, яка пройшла крізь електроліт.
- •2. Однакова кількість електрики виділяє на електродах під час електролізу еквівалентну кількість різних речовин.
- •13.10. Корозія металів
- •0,01 Моль/л 0,1 моль/л
- •Глава 14. Окисно-відновні реакції складання рівнянь окисно-відновних реакцій
- •Контрольні завдання
- •Додатки
- •Додаток 6 – Перехідні коефіцієнти
- •Предметний покажчик
- •Відновлення 18-19, 77, 81, 124, 126, 128, 135-139
- •Водень 14, 17, 37, 75, 125, 130-132, 139
- •Ізомерія 119
- •Лантаноїди 25
- •Натрій 20-21, 69, 89
- •Термодинамічні 8, 54
- •Атомів 33, 50
- •Список рекомендованої літератури
- •Глава 1. Основні поняття та закони хімії ........................ 5
Мал. 4.3. Різновиди σ-зв’язків.
Пі-зв’язок виникає при перекриванні електронних орбіталей по обидва боки від лінії, яка з’єднує ядра атомів. Цей зв’язок може утворитись при взаємодії двох електронних орбіталей з двома областями перекривання за рахунок двох р-орбіталей чи двох d-орбіталей (мал.4.3).










p – p (π) d – d (π)
Мал. 4.3. Різновиди π-зв’язків.
Пі-зв’язки мають місце, наприклад у молекулі азоту. У молекулі азоту рх-орбіталі утворюють один -зв’язок при утворенні зв’язку ру- та рz-орбіталями виникають -зв’язки отже у молекулі азоту з трьох зв’язків один -зв’язок, а два інші – -зв’язки. Хімічний зв’язок утворений більш ніж однією електронною парою називається кратним. Підвищення кратності зв’язку призводить до перерозподілу міжатомної електронної густини та зменшення між’ядерної відстані (довжини зв’язку). Дельта-зв’язок (-зв’язок) зумовлений перекриванням усіх чотирьох пелюсток d-електронних орбіталей, розміщених у паралельних площинах.
Гібридизація атомних орбіталей. Просторова конфігурація молекул.
Дж. Слейтер і Л. Полінґ пояснили, що явище гібридизації валентних орбіталей полягає в тому, що електронні орбіталі різної симетрії, які не дуже відрізняються за енергією утворюють гібридизовані електронні орбіталі, які є результатом додавання та усереднення атомних орбіталей. При гібридизації початкова форма й енергія орбіталей взаємно змінюється й утворюються нові орбіталі, але вже однакової форми й з однаковою енергією. Число гібридизованих орбіталей дорівнює числу орбіталей, які взяли участь у гібридизації. Гібридизовані орбіталі витягнуті в напрямку утворення хімічних зв’язків і тому зумовлюють ліпше перекривання електронних хмар. Внаслідок цього хімічний зв’язок, що утворюється з участю електрона гібридизованої орбіталі, міцніший ніж утворений за рахунок електронів окремих вихідних орбіталей. Тип гібридизації визначається типом і кількістю орбіталей, що беруть участь у гібридизації. Якщо гібридизовані орбіталі утворюють одна s- і одна p-орбіталь то такий стан називають sp-гібридизацією, електронні орбіталі sp-гібридизованими, а якщо участь у гібридизації беруть одна s- і три p-орбіталі то кажуть, що має місце sp3-гібридизація та sp3-гібридизовані орбіталі.
Розглянемо sp - гібридизацію на прикладі молекули BeCl2
4Ве – 1s22s2 B = 0 (у незбудженому стані);
4Ве* – 1s22s12p1 В = 2 (у збудженому стані);
При комбінації однієї s- і однієї p - орбіталей виникають дві sp-гібридизовані орбіталі із кутом між їхніми осями, що дорівнює 180о (мал.4.4).
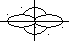


(s + p) орбіталі дві sp-орбіталі
Мал. 4.4. Утворення sp-орбіталей.
Зв’язки, які утворюються за участю електронів цих орбіталей, також розташовуються під кутом у 180о. Такий тип гібридизації має місце при утворенні галогенідів елементів ІІ групи періодичної системи: Be, Zn, Cd, Hg, атоми яких у валентному стані мають неспарені s- і p-електрони. В молекула ВеCl2 лінійна просторова конфігурація.
Cl – Ве – Cl

180o
У молекулах елементів інших груп, наприклад: О = С = О та НС СН, зв’язки утворено sp-гібридизованими орбіталями атома карбону.
Sp2-гібридизація на прикладі молекули BF3.
5В – 1s22s22p1 B = 1 (у незбудженому стані);
5В* – 1s22s12p2 В = 3 (у збудженому стані);
Комбінація однієї s- і двох p-орбіталей призводить до утворення 3 sp2-гібридизованих орбіталей, розташованих під кутом 120о (мал.4.5).




 120о
120о

(s + p + p) орбіталі три sp2-орбіталі
Мал. 4.5. Утворення sp2-орбіталей.
Під таким самим кутом розміщуються й зв’язки, утворені електронами цих орбіталей. Такий тип гібридизації характерний для елементів ІІІ групи періодичної системи, атоми яких у збудженому стані мають електронну будову Ns1Np2, що утворюють гібридизовані зв’язки. Молекула ВF3 має форму плоского трикутника внаслідок sр2-гібридизації атома бору:
F
 В
F
В
F
F
Тетраедричне розміщення зв’язків і форма тетраедра характерні для багатьох сполук чотиривалентного карбону, наприклад у молекулі СН4:
Н

109о28
 С
С

 Н
Н
Н Н
Метод гібридизації атомних орбіталей успішно пояснює геометричну будову великого числа молекул, але в деяких випадках теоретичні дані дещо розходяться з експериментами. Наприклад, для молекул СН4, NН3 та Н2О характерне утворення sp3-гібридизованих зв’язків. Тому можна було б чекати, що валентні кути між зв’язками у цих молекул будуть приблизно дорівнювати 109о. Але експериментально встановлено, що валентні кути дорівнюють: НСН = =109о28; НNН = 107о18; НOН = 104о30; Такі відхилення у молекул NН3 та Н2О метод валентних зв’язків пояснює наявністю неподілених електронних пар у атомів нітроґену та оксиґену, що призводить до взаємного відштовхування зв’язуючих та розслабляючих електронних пар, які перебувають на гібридизованих орбіталях.
