
- •Элементы viia подгруппы
- •Работа №1 Галогены
- •Опыт 1. Получение хлора из соляной кислоты действием различных окислителей
- •Опыт 2. Получение брома
- •Опыт 3. Растворимость брома и йода в органических растворителях
- •Опыт 4. Окислительные свойства галогенов
- •Опыт 5. Сравнительная характеристика окислительных cвойств свободных галогенов
- •Опыт 6. Сравнительная характеристика восстановительных свойств галогенид-ионов
- •Опыт 7. Гипохлориты и их окислительные свойства
- •Опыт 8. Хлораты и йодаты
- •Контрольные вопросы и задания
- •2. Элементы via подгруппы
- •Работа №2 Сера
- •Опыт 2. Получение малорастворимых сульфидов металлов.
- •Опыт 3. Окислительно – восстановительные свойства сернистой кислоты и сульфит - ионов ()
- •Опыт 4. Окислительные свойства персульфатов.
- •Опыт 5. Гидролиз солей.
- •Опыт 6. Качественное определение ионов серы.
- •Контрольные вопросы и задания
- •3.Халькогениды металлов
- •Значения пр некоторых сульфидов металлов
- •Растворители сульфидов
- •Работа № 3 Получение сульфидов металлов и исследование их свойств
- •Опыт 1. Получение осадков сульфидов металлов и исследование их растворимости
- •Опыт 2. Изучение растворимости осадков сульфидов металлов
- •Опыт 3 (контрольная задача). Качественное определение ионов металлов
- •Опыт 4. Получение пленки CdS методом осаждения из растворов
- •Контрольные вопросы и задания
- •4. Элементы vа подгруппы
- •Мышьяк. Сурьма. Висмут.
- •Работа № 4 а. Азот. Фосфор
- •Опыт 1. Восстановительные свойства аммиака.
- •Опыт 2. Свойства азотистой кислоты и нитритов.
- •Опыт 3. Качественное определение ионов азота
- •Опыт 4. Качественная реакция на фосфат-ион (po43-)
- •Опыт 7. Получение гидроксида висмута (III) и исследование его свойств
- •Опыт 8. Окислительно-восстановительные свойства соединений висмута (III)
- •Опыт 9. Окислительные свойства соединений висмута (V)
- •Контрольные вопросы и задания
- •5. Элементы iva подгруппы
- •Гидролиз солей олова и свинца протекает с образованием основных солей. Например:
- •Работа № 5 а. Кремний. Германий
- •Опыт 1 (демонстрационный). Получение аморфного кремния восстановлением диоксида кремния металлическим магнием Получение аморфного кремния основано на реакции
- •Опыт 2. Получение геля кремниевой кислоты
- •Опыт 3. Гидролиз силиката натрия
- •Опыт 7. Определение химической природы диоксида германия
- •Б. Олово. Свинец Опыт 8. Взаимодействие олова с концентрированными кислотами
- •Опыт 9. Получение гидроксида олова (II) и исследование его свойств
- •Опыт 10. Гидролиз солей олова (II)
- •Опыт 11. Восстановительные свойства соединений олова (II). Восстановление железа (III)
- •Опыт 12. Вытеснение свинца из раствора его соли более активными металлами
- •Опыт 13. Отношение свинца к разбавленным кислотам
- •Опыт 14. Малорастворимые соли свинца (п)
- •Опыт 15. Получение гидроксида свинца (п) и изучение его свойств
- •Опыт 16. Амфотерные свойства диоксида свинца
- •Опыт 17. Окислительные свойства соединений свинца (IV)
- •Контрольные вопросы и задания
- •6. Комплексные соединения
- •Работа №6. А Свойства комплексных соединений
- •Опыт 1. Получение и свойства аммиаката никеля.
- •Опыт 2. Получение и свойства ацидокомплекса ртути и изучение его свойств.
- •Опыт 3. Получение соединения,
- •Опыт 6. Разрушение комплексов.
- •Б Синтез двойных и комплексных солей
- •Синтез двойных солей.
- •Частные реакции на ионы
- •Синтез комплексных солей
- •Контрольные вопросы и задания
- •7. Металлы
- •Ib. Медь, серебро, золото
- •Iib. Цинк, кадмий, ртуть
- •Iiia. Элементы iiia подгруппы
- •Алюминий, галлий, индий, таллий
- •Viiib. Железо, кобальт, никель
- •Работа № 7. Химические свойства металлов
- •Опыт 1. Растворение металлов в кислотах и щелочах
- •Опыт 2. Получение гидроксидов металлов и исследование их свойств
- •Опыт 3. Получение сульфидов металлов
- •Опыт 4. Гидролиз солей некоторых металлов
- •Опыт 5. Комплексные соединения d-элементов
- •Опыт 6. Окислительно-восстановительные свойства ионов металлов
- •Индивидуальные задания.
- •Контрольные вопросы и задания
- •8. Элементы iа подгруппы
- •Работа № 8. Натрий
- •Опыт 1. Взаимодействие натрия с водой.
- •Опыт 2. Свойства пероксида натрия.
- •Опыт 3. Гидролиз карбоната и гидрокарбоната натрия.
- •Контрольные вопросы и задания
- •9. Элементы iiа подгруппы
- •Работа №9. Свойства металлов iia подгруппы и их соединений
- •Опыт 1. Получение гидроксида бериллия и исследование его свойств.
- •Опыт 2. Гидролиз хлорида бериллия.
- •Контрольные вопросы и задания
- •10. Элементы vib подгруппы
- •Изменение характера оксидов и гидроксидов хрома
- •Работа № 8. Хром
- •Опыт 1. Получение оксида хрома (ш) разложением бихромата аммония
- •Опыт 2. Получение гидроксида хрома (III) и исследование его свойств
- •Опыт 3. Гидролиз солей хрома
- •Опыт 4. Окисление хрома (III) до хрома (VI)
- •Опыт 5. Хроматы и бихроматы
- •Опыт 6. Получение малорастворимых хроматов бария, свинца, серебра
- •Опыт 7. Окислительные свойства хрома (VI) в кислой среде
- •Опыт 8. Образование надхромовой кислоты h2CrO6
- •Опыт 9. Травление хромовых покрытий
- •Опыт 10. Пассивирование (оксидирование) хрома
- •Контрольные вопросы и задания
- •11. Элементы viib подгруппы
- •Работа № 11. Марганец
- •Опыт 1. Получение гидроксида марганца (II)
- •Опыт 4. Окислительно-восстановительные свойства манганатов (реакция диспропорционирования)
- •Опыт 5. Окислительные свойства перманганатов
- •Опыт 6. Влияние среды на окислительные свойства перманганата
- •Контрольные вопросы и задания
- •12. Элементы viiiв подгруппы
- •Работа 12. Железо. Кобальт. Никель
- •Опыт 1. Получение гидроксида железа (II) и исследование его свойств.
- •Опыт 2. Получение гидроксидов кобальта (II) и никеля (II) и исследование их свойств.
- •Опыт 3. Получение гидроксида железа (III) и исследование его свойств.
- •Опыт 4. Гидролиз солей железа (II) и (III).
- •Опыт 5. Получение малорастворимых сульфидов железа, кобальта, никеля.
- •Опыт 6. Восстановительные свойства соединений железа (II).
- •Опыт 7. Окислительные свойства соединений железа (III).
- •Опыт 8. Комплексные соединения железа, кобальта, никеля.
- •Контрольные вопросы и задания
- •Приложение. Таблицы физико-химических констант.
- •Константы нестойкости некоторых комплексных ионов
- •Растворимость некоторых солей и оснований в воде
- •Оглавление
Iib. Цинк, кадмий, ртуть
Электронная конфигурация внешнего и предшествующего уровней атомов ns2(n-1)d10. Эти металлы могут проявлять степень окисления +2. Ртуть может иметь степень окисления +1. Например, в соединении Hg2Cl2 степень окисления ртути +1, а валентность равна 2, что отражено в структурной формуле Cl-Hg-Hg-Cl. Все они - типичные металлы, ртуть - единственный металл, жидкий при нормальных условиях.
Если щелочноземельные металлы (IIA подгруппы) относятся к числу сильных восстановителей, то восстановительная активность металлов подгруппы цинка значительно ниже: цинк и кадмий – средние восстановители, а ртуть - слабый. Все три элемента легко образуют сплавы друг с другом и многими другими металлами. Сплавы с ртутью называются амальгамами. Способность к взаимодействию этих металлов с простыми веществами представлена схемой:
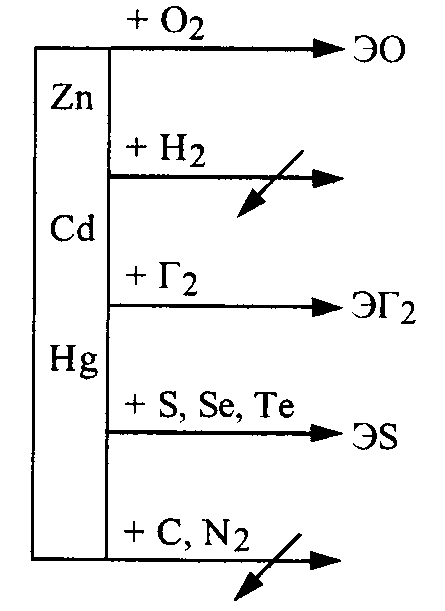
В ряду напряжений Zn и Cd находятся левее водорода, а Hg – значительно правее водорода. На воздухе цинк и кадмий покрываются тонким слоем оксида (или гидроксида), предохраняющим их от дальнейшей коррозии. Поэтому, несмотря на то, что эти элементы находятся в ряду напряжений левее водорода, они практически не вытесняют его из воды. Однако, если с них снять оксидную пленку, то они взаимодействуют с водой, выделяя водород:
Zn + 2H2O = Zn(OH)2 + H2![]() .
.
Цинк растворяется в щелочах с образованием цинкатов:
Zn + 2NaOH = Na2[Zn(OH)4] + H2![]() .
.
Растворение в щелочах характерно и для оксида и гидроксида цинка, благодаря их амфотерности. Оксиды и гидроксиды кадмия и ртути амфотерными свойствами не обладают и в щелочах не растворяются.
В разбавленных растворах соляной и серной кислот цинк растворяется легко, кадмий медленно, а ртуть нерастворима. Азотная кислота легко растворяет все три металла, при этом выделяются различные оксиды азота.
Особенность
взаимодействия ртути с азотной кислотой
состоит в том, что в зависимости от
соотношения кислоты и металла могут
получаться как соли окисной
![]() (при избытке кислоты), так и закисной
ртути
(при избытке кислоты), так и закисной
ртути![]() (при избытке ртути), например:
(при избытке ртути), например:
![]()
![]()
Соли ртути (I) в водных растворах диссоциируют с образованием ионов [Hg2]2+:
![]()
![]()
![]() .
.
Гидролиз солей цинка и его аналогов протекает ступенчато с образованием основных солей:
![]()
![]()
![]()
![]()
![]()
![]()
Поскольку
гидроксид ртути неустойчив, основные
соли ртути, образующиеся при гидролизе,
содержат не группу
![]() ,
а ион кислорода:
,
а ион кислорода:
![]()
![]()
![]()
![]()
![]()
![]() .
.
В окислительно–восстановительных реакциях Zn, Cd, Hg являются только восстановителями, ионы Э2+ - только окислителями, а ионы [Hg2]2+ могут проявлять окислительно-восстановительную двойственность:
1) Восстановительные свойства нейтральных атомов металлов:
![]()
![]()
2) окислительные свойства соединений элементов в высшей степени окисления:
HgCl2 + SnCl2 + 2НСl = Н2[SnCl6] + Hg;
3) окислительно-восстановительная двойственность ионов [Hg2]2+:
Hg2I2 + 2KI = K2[HgI4] + Hg.
Цинк, кадмий, ртуть - хорошие комплексообразователи, образуют комплексные соединения с различными лигандами:
Zn(OH)2 + 4NН3 = [Zn(NH3)4](ОН)2.
Благодаря комплексообразованию можно растворить любые нерастворимые в воде соединения цинка, кадмия, ртути при подборе комплексообразующего растворителя. Так, осадок HgS (ПР = 1,6·10-52), растворимый лишь в царской водке, легко растворяется в смеси КI и НСl:
HgS + 4KI + 2НС1 = K2[HgI4] + Н2S + 2КСl.
