
- •Глава1. История развития биоорганической химии …………………………………
- •Глава 2. Лекции по биоорганической химии …………………………………………
- •Глава 1
- •1.. Характеристика химических связей в биоорганических соединениях
- •2. Сопряженные системы
- •2.1. Общие понятия о строении сопряженных систем
- •2 . 3 . Циклические сопряженные системы. Ароматичность
- •1. Устойчивость к действию окислителя перманганата калия в растворе.
- •3. Способность к реакциям замещения в растворе по ионному( катионному,
- •2.3.1. Современные представления о строении бензола
- •2. 3. 2. Медико-биологическое значение карбоциклических ароматических
- •2. 3. 3. Гетероциклические ароматические соединения
- •2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
- •2.2. Кислотно-основные свойства органических соединений
- •2.3. Медико- биологическое значение изучения темы « Кислотно-основные
- •3.1. Виды изомерии
- •3.2. Структурная изомерия.
- •3.2.1. Изомерия скелета
- •3.3. Динамическая изомерия.
- •3. 3.1. Кето-енольная таутомерия.
- •3.3.2. Лактим-лактамная таутомерия
- •3.4 Пространственная изомерия
- •3.4.1 Геометрическая( цис, транс) изомерия
- •3.4.4. Медико-биологическое значение стереоизомерии
- •4.1 Классификация реакций в биоорганической химии
- •4.1.1 Типы разрыва химических связей
- •4.1.2. Гомолитический тип разрыва связей.
- •4.1.3. Гетеролитический тип разрыва связей
- •4.2.1. Реакции электрофильного присоединения в ряду алкенов(а е)
- •4.2.2. Реакции нуклеофильного присоединения
- •7.Реакции у α- углеродного атома в карбонильных соединениях
- •8. Альдольная конденсация
- •1. Реакция нитрования
- •2. Реация сульфирования
- •3.Реакция галогенирования
- •4. Реакция алкилирования
- •4.2.4. Реакции нуклеофильного замещения ( s n )
- •Лекция 5 карбоновые кислоты и их гетерофункциональные
- •5.1. Классификация карбоновых кислот
- •5.2. Строение карбоксильной группы
- •5.2.1. Значение величин рКа некоторых карбоновых кислот :
- •5.3. Химические свойства карбоновых кислот
- •Этилацетат
- •5.4. Характеристика отдельных представителей монокарбоновых кислот ,
- •Масляная кислота ( н- бутановая кислота)
- •5.5. Непредельные монокарбоновые кислоты
- •5.6. Дикарбоновые кислоты
- •5.7. Непредельные ди- и трикарбоновые кислоты
- •5.8. Гидроксикислоты
- •5.8.3. Дигидроксидикарбоновые кислоты
- •5.9. Oксокарбоновые кислоты( альдегидо -, кетокарбоновые кислоты)
- •5.10 Приложение : Происхождение названий карбоновых кислот Сn н2n о2
- •6.1. Определение « липиды»
- •6.3. Основные представители липидов
- •6.3.1.Природные высшие карбоновые кислоты
- •3. Тиоэфиры
- •4. Дегидрирование насыщенной кислоты в активной форме с участием фермента.
- •6.3.2. Триацилглицерины( триглицериды)
- •6.3.3. Фосфатиды ( фосфолипиды ) и фосфатидовая кислота
- •6. 4. Принципы создания липотропных лекарственных препаратов
- •6.5 . Строение и химический состав мембран клеток
- •7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
- •7. 2 Классификация природных аминокислот
- •7. 3Физические свойства природных аминокислот
- •7.4 Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка
- •7.5. Качественная реакция обнаружения аминокислот
- •7. 6 . Химические свойства аминокислот
- •7 .6. 1 Химические свойства аминокислот in vitro
- •7.6.2. Химические свойства аминокислот in vivo
- •7.7. Строение витамина в6 и механизм реакции с его участием
- •7.8. Реакция поликонденсации, образование полипептидов
- •7. 9. Медико - биологическое значение аминокислот
- •7. 10. Применение аминокислот и их производных в качестве
- •Незаменимые аминокислоты обозначены звездочкой*
- •8.1. Определения « пептид» «белок»
- •8.2. Классификация белков
- •8.3. Строение пептидов и белков.
- •8.3.1. Первичная структура белка
- •8.3.2. Вторичная структура белка
- •8.3.3. Третичная и четвертичная структура белка
- •8.4. Физико-химические свойства белка
- •8.4.1. Амфотерность - кислотно- основные свойства белков.
- •8.4.2. Денатурация белка
- •8.5.Качественные реакции обнаружения белков в биологических объектах.
- •8. 6. Приложение. История развития химии белков
- •9. 1. Классификация углеводов
- •9.2. Моносахариды
- •9.3. Изомерия моносахаридов. Стереоизомерия. L- и д- ряды. Диастереомеры, энантиомеры, эпимеры. Значение отдельных представителей
- •9.4 Химические свойства моносахаридов
- •9.4. 3. Фосфорные эфиры
- •9.4.3 Образование гликозидов
- •9.4.4. Реакции восстановления
- •9.4.5Реакции окисления моносахаридов
- •9.5. Биологическое значение моносахаридов и их производных.
- •10.1. Олигосахариды. Дисахариды
- •10.1.1. Нередуцирующие дисахариды
- •10.1.2 Редуцирующие дисахариды.
- •10.2. Полисахариды
- •10.2.1.Гомополисахариды
- •11.1. Классификация нуклеиновых кислот, отличия в строении и составе как следствие различных биологических функций
- •11.2.Азотистые основания нуклеиновых кислот
- •11.2.2. Азотистые основания- производные пурина( аденин, гуанин)
- •11.3. Нуклеозиды
- •11.4. Нуклеотиды
- •11.5.Строение нуклеиновых кислот
- •11.6.Метаболизм пуриновых соединений в клетке
- •11.7. Биологически важные соединения- мононуклеотиды, динуклеотиды- участники важнейших биохимических процессов
- •11.8 Приложение . Справочные материалы к теме лекции
- •1953 – Дж. Уотсон и ф. Крик - модель двухцепочечной структуры днк.
- •12.1 Современная концепция создания биоорганических соединений –
- •12.1.1. Особые химические требования к лекарственному веществу
- •12.1.3. . Пути поиска и создания лекарственных препаратов
- •12.1.4 Классификация лекарственных веществ
- •12.2 Синтез, химические и физическиесвойства лекарственных соединений
- •12.2.1. Производные 4-аминобензойной кислоты
- •12.2.2. Производные 4-аминобензолсульфокислоты
- •Hso3Cl сульфохлорирование h2nr’ амин
- •Ацетиланилин
- •12. 2. 3. Лекарственные средства, производные салициловой кислоты
- •12.2.4. Лекарственные средства, производные 4 –аминофенола
- •12.2.5 Лекарственные средства на основе пиридинкарбоновых кислот
- •12. 2. 6. Производные пиримидина
- •12. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
- •13.1. Номенклатура алкалоидов
- •13.2. Классификация алкалоидов
- •13. 3. Функции алкалоидов
- •13.4. Содержание в растениях
- •13.5. Качественные реакции обнаружения алкалоидов
- •13.6. Фармакологическая активность- общий взгляд
- •13.7. Отдельные представители
- •13. 7.1. Алкалоиды группы фенилэтиламина
- •7.2 Производные пяти – и шестичленных гетероциклических соединений
- •137.3. Группа тропана
- •13.8. Витамины
- •Действие в организме
- •Стадии зрительного процесса на сетчатке глаза
- •14.1. Полимеры-определение. Виды полимеров
- •14. 2. Классификация вмс
- •14.3. Реакции полимеризации
- •14.3.1. Номенклатура полимеров.
- •14.3.2 . Общая характеристика мономеров.
- •14.3.3. Механизмы реакции полимеризации
- •14.4. Радикальная полимеризация
- •14.5. Ионная полимеризация
- •14.5.1. Катионная полимеризация
- •14.5.2. Анионная полимеризация
- •14.6. Координационная полимеризация
- •14.7.1. Блочная полимеризация
- •14.7.2. Эмульсионная полимеризация
- •14.7.3. Полимеризация в растворе
- •14.8. Конфигурация полимеров
- •14. 10. Физическое состояние полимеров
- •14.10.1. Аморфные полимеры
- •14 10.2. Кристаллические полимеры
- •14.11. Натуральный каучук
- •14.12 . Конденсационные полимеры
- •14. 13 Основные представители вмс
- •2. Структурные формулы биоорганических соединений
- •Сопряженные соединения
- •Карбоновые кислоты (указаны тривиальные названия)
- •Незаменимые аминокислоты обозначены звездочкой -*
- •Углеводы и их производные
- •Азотистые основания и их производные
- •1. Теоретические положения строения и свойств биоорганических
- •2. Важнейшие биополимеры организма
- •3. Липиды и низкомолекулярные регуляторы метаболизма.Важнейшие группы лекарственных средств
- •Курс лекций по биоорганической химии
- •060103 – Педиатрия
- •060104 –Медико-профилактическое дело
- •060105 - Стоматология
4.2.2. Реакции нуклеофильного присоединения
к карбонильной группе альдегидов и кетонов ( АN )
В карбонильной группе присутствуют две связи π и σраспределение электронной плотности , неравномерное вследствие различной электроотрицательности атомов углерода и кислорода , которые находятся вsp2– гибридном состоянии. Создаются два центра, которые отзываются на активные частицы с противоположными зарядами ( + ) и ( - )
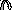
б+ б–

 >
С = О
>
С = О
электрофильный центр нуклеофильный центр
атакует частица ( -) или с атакует частица (+ ),
повышенной электронной электрофил Е+.
плотностью, нуклеофил Nu
Донорные заместители подают электронную плотность в сторону атома углерода и снижают величину заряда б+ . Акцепторные заместители смещают электронную плотность от атома углерода и увеличивают заряд б+, усиливая поляризацию связи ( условно изображены разные величины частичных зарядов).
б+ б+
R—> СН = О R<— СН = О
донор акцептор
Акцепторные заместители должны увеличивать скорости реакций, а донорные заместители- уменьшать.
Химические свойства карбонильных соединений:
1. реакции нуклеофильного присоединения к карбонильной группе
2. электрофильные реакции замещения у атома углерода в соседнем, α– положении к карбонильной группе.
Реакции нуклеофильного присоединения
Карбонильные соединения реагируют с достаточно большим количеством
нуклеофилов :
НОН, RОН , НСN,RSН , Н2S,RNН2, НС1, НВг,NаНSО3( натрия гидросульфит),RNHNH2( гидразин).
Механизм реакции становится ясным, если представить схему процесса и образование двух возможных промежуточных соединений:
А) Первым атакует ( Е+) электрофил. Образуется карбокатион, на атоме углерода появляется заряд (+). Атом углерода имеет гибридизациюsp2 и тригональное строение .
 б + б -
( +)
б + б -
( +)
> С = О + Е+ Nu– ——>> С — О — Е
Б) Первым атакует (Nu–) нуклеофил. Образуется анион, отрицательный заряд локализован на атоме кислорода, атом углерода тетраэдрический, гибридизацияsp3, образует 4 ковалентные связи.
 б+ б-
б+ б-
> С = О + Е+ Nu– ——>> С — О ( - )
|
Nu
Понятно, что анион( вариант Б) является более устойчивым,, чем карбокатион
( вариант А ). Известно множество примеров существования устойчивых анионов :
гидроксид НО –, анионы неорганических и органических кислотRCOO–.
Поэтому реакции с участием карбонильной группы проходят по механизму нуклеофильного присоединения. Для большинства реакций требуется кислая среда, которая способствует образованию карбокатиона, к которому легко присоединяется
нуклеофильная частица.
б+ б- + Nu
> С = О + Н+ ——>> С – О —Н + ——>> С — О– + Н+
|
Nu
1. Присоединение воды. Обратимая гидратация карбонильной группы происходит при растворении альдегида в воде, образуются гем-диолы, которые существуют только в растворе. Формальдегид гидратирован на 100% , ацетальдегид- на 58%, ацетон – менее 1%. Эти данные доказывают снижение реакционной способности карбонильной группы под влиянием заместителей с (+) индуктивным эффектом. Водный раствор формальдегида- формалин,w=40%, используется для изготовления анатомических и гистологических препаратов.
R—СН = О + НОН <=>R—СН – ОН
|
ОН гидрат альдегида
Трихлорэтаналь( жидкость, Т кип. 970) присоединяет воду и существует в виде устойчивого кристаллического соединения- хлоралгидрата СС13СНО • Н2О, который использовали как успокаивающее и снотворное средство, и сейчас применяют в ветеринарии. Пример этого соединения подтверждает, что заместители с (–) индуктивным эффектом увеличивают реакционную способность карбонильной группы и устойчивость продуктов присоединения.
ОН
|
С13С- СНО + НОН —> С13С– С – ОН
трихлорэтаналь | хлоралгидрат
ОН
Образование полуацеталей и ацеталей
Альдегиды в кислой среде образуют полуацетали при взаимодействии со спиртами. Полуацеталь сохраняет свойства альдегида и качественные реакции, характерные для альдегидной группы( «серебряного зеркала» и др.). При действии избытка спирта полуацеталь превращается в ацеталь, который не сохраняет свойства альдегидной группы. Гидролиз полуацеталя и ацеталя возможен только в кислой среде и не возможен в щелочной.
б+ б- б+ б - ROH
R—СН = О +Н —ОR<=>R—СН – ОН——>R—СН –ОR
АN|SN|
ОR ОR
полуацеталь ацеталь
Циклические полуацетали – результат внутримолекулярной реакции АN, которая возможна у гидроксиальдегидов, если гидроксигруппа находится в положении 4 или 5 в углеродной цепи.
б-
С Н2–
СН2– СН2–СН2– СНО
СН2–СН2–
СН–ОН
Н2–
СН2– СН2–СН2– СНО
СН2–СН2–
СН–ОН
| <=> | |
О - НСН2–СН2–О циклический полуацеталь
5-гидроксипентаналь шестичленный цикл носит название пирановый
пространственное строение «кресло»
Среди природных соединений распространены циклические полуацетали моносахаридов ( подробно в лекции по теме « Углеводы»).
Полуацетали образуются в качестве промежуточных соединений при обмене пировиноградной и α– кетоглутаровой кислот при участии витамина В1– тиаминпирофосфата.
3.Образование циангидринов- присоединение циановодородаНСN к карбонильной группе альдегидов и кетонов
Реакция катализируется основаниями. т.к. НСN– слабая кислота. Циангидрины распространены в природе, в растениях они связывают синильную кислоту. В горьком миндале содержится до 2-4% циановодорода, много в вишневых и незрелых косточках
абрикоса, поэтому они представляют опасность при употреблении в пищу или изготовлении варенья, компотов с косточками.
Бензоциангидрин синтезируется некоторыми насекомыми и используется в качестве защиты, парализуя дыхательный центр врагов-насекомых.
С6Н5— СН = О +НСN ——> С6Н5— СН — ОН
|
бензальдегидСN бензоциангидрин
4.Образование тиополуацеталей - присоединение тиолов( синонимы - тиоспиртов, меркаптанов)
Реакция исключительно важна для понимания процессов с участием ферментов, которые в своем активном центре содержат тиольные группы аминокислоты цистеина.
R—СН = О +Н —SR<=>R—СН – ОН
АN|
SR
тиополуацеталь
Образование тиополуацеталей in vivoнеобходимо в процессе реакций биологического окисления.( см. раздел «реакции окисления биоорганических соединений).
Присоединение натрия гидросульфита
Используют для очистки альдегидов от посторонних примесей. Продукт присоединения выпадает в осадок в спиртовом или
эфирном растворе. Его отделяют, проводят гидролиз, выделяется чистый альдегид.
R—СН = О +NаНSО3 <=>R—СН — О Н
|
SО3 – Nа+
6.Взаимодействие с аминами и гидразинами- образование азометинов( синоним- основания Шиффа) и гидразоновВ процессе взаимодействия карбонильных соединений с аминами и гидразинами реакция АNзатем сопровождается элиминированием воды . Процесс можно обозначить
( АN –Е ) .
R1—СН = О +NH2–R2 <=>R1—СН – ОН——>Н2О +R1—СН =N–R2
| азометин
NH–R2
Азометины- твердые кристаллические вещества, имеющие четкие температуры плавления, что позволяет проводить идентификацию альдегидов в виде оснований Шиффа.
В клетках in vivoобразование азометинов происходит с участием витамина В 6
в процессе метаболизма природных аминокислот: декарбоксилирования и транс(пере)аминирования. Витамин В 6 существует в трех активных формах: альдегидной ( пиридоксаль ) и амино( пиридоксамин ), что позволяет ему образовывать азометины в виде альдегида и в виде амина.

Подробно участие витамина В 6 в обмене аминокислотin vivoрассматривается в лекции «Природные аминокислоты».
