
Meditsinskaya_genetika_3
.pdfГБОУ ВПО «КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РФ
КАФЕДРА МЕДИЦИНСКОЙ БИОЛОГИИ И ГЕНЕТИКИ
МЕДИЦИНСКАЯ ГЕНЕТИКА
Часть 3. Полиморфизм генов. Прямая ДНКдиагностика. Частота мутантных генов в популяции
КАЗАНЬ 2014
УДК 611:018(075.8)
ББК 28.05+28.06
Печатается по решению Центрального координационно-методического совета Казанского государственного медицинского университета.
Авторы:
Иллариошкин С.Н., Скоблов М.Ю., Исламов Р.Р., Блатт Н.В., Кошпаева Е.С.
Под общей редакцией: Исламова Р.Р.
Рецензенты:
Заведующий кафедрой гистологии, цитологии и эмбриологии КГМУ проф. Челышев Ю.А.
Заведующий кафедрой гистологии, цитологии и эмбриологии РНИМУ им. Н.И. Пирогова проф. Глинкина В.В.
Медицинская генетика. Часть 3. Полиморфизм генов. Прямая ДНК-диагностика. Частота мутантных генов в популяции. Учебно-методическое пособие / Иллариошкин С.Н., Скоблов М.Ю., Исламов Р.Р., Блатт Н.В., Кошпаева Е.С. – Казань: КГМУ, 2014. – 67 с.
Учебно-методическое пособие составлено в соответствии с Государственным образовательным стандартом высшего профессионального образования (ФГОС-3) и типовой Учебной программой по дисциплине «Биология». В 3 части «Полиморфизм генов. Прямая ДНК-диагностика. Частота мутантных генов в популяции» Учебнометодического пособия «Медицинская генетика» изложены цели и задачи данной темы, указаны формируемые компетенции, приведён теоретический обзор изучаемого материала, изложенный в лаконичной, рубрицированной форме и имеющий медицинскую направленность. Практические навыки включают освоение метода полимеразной цепной реакции и применение ПЦР в прямой ДНК-диагностике и фамакогенетике, решение ситуационных задач по формуле Харди-Вайнберга. Пособие включает типовые тестовые вопросы, вопросы самоконтроля, справочник терминов и приложение (генная карта наследственных заболеваний).
Учебно-методическое пособие предназначено для студентов младших курсов медицинских факультетов и медицинских вузов.
© Казанский государственный медицинский университет, 2014
Часть 3
Полиморфизм генов. Прямая ДНК-диагностика. Частота мутантных генов в популяции
Целью публикации настоящего учебно-методического пособия является систематизация знаний и представлений студентов по некоторым вопросам генетики человека. В учебно-методическом пособии приводится обзор литературы, содержащий современные представления о полиморфизме генов и их фенотипическом выражении, об основных методах прямой ДНК-диагностики наследственных заболеваний человека. В учебно-методическое пособие включена новейшая информация, которая не представлена в учебниках, используемых студентами.
Задачей учебно-методического пособия является ознакомление студентов с современными представлениями о методах ДНК-диагностики, выработка навыков решения ситуационных задач, выработка навыков самостоятельной работы.
Цель занятия:
Познакомиться с фенотипически выраженными и невыраженными полиморфизмами генов. Сформировать представление о прямой ДНК-диагностике наследственных заболеваний. Научиться применять популяционно-статический метод для выявления частоты мутантных генов в популяции.
Задачи занятия:
1.Уяснить причины полиморфизмов генов и их типы.
2.Научиться применять формулу Харди-Вайнберга и анализировать частоту мутантных генов в популяции.
3.Усвоить суть прямой ДНК-диагностики наследственных заболеваний.
4.Овладеть методом полимеразной цепной реакции и знать область его применения.
5.Получить представление о фармакогенетике.
Формируемые компетенции:
ОК-1, ПК-2, ПК-3, ПК-9, ПК-31, ПК-32
Студент должен знать:
1.О полиморфизме генов и его роли в развитии наследственных и соматических заболеваний.
2.Методы прямой ДНК диагностики наследственных заболеваний. Достоинства и недостатки.
3.Основные этапы протокола полимеразной цепной реакции.
4.Сущность закона Харди-Вайнберга
5.Цели и методы фармакогенетики.
Студент должен уметь:
1.Применять формулу Харди-Вайнберга и анализировать частоту генов и генотипов в популяции.
2.Решать ситуационные задачи по теме.
3.Работать с обучающей компьютерной программой при изучении темы.
4.С помощью полиморфного маркёра выявлять носительство мутантного аллеля
гена.
Студент должен владеть:
1.Основными понятиями и терминами по теме.
2.Практическими навыками по применению популяционно-статистического метода для определения частот генов и генотипов в популяции.
3.Навыками косвенной ДНК-диагностики.
Оснащение занятия:
1.Таблицы
2.Мультимедийный проектор
3.Компьютеры
4.Билеты с ситуационными задачами
Хронологическая карта занятия:
1.Организационная часть.
2.Письменный тестовый контроль базового уровня знаний.
3.Разбор теоретического материала.
4.Самостоятельная работа студентов и текущий контроль за выполнением заданий.
5.Проверка выполненных работ в тетрадях и альбомах.
6.Установка задания для подготовки к следующей теме.
Теоретический обзор
Полиморфизм генов
Геномы различных организмов в рамках одного биологического вида идентичны с точки зрения общего набора генов и их тонкой внутренней структуры. В то же время существует значительное число межиндивидуальных различий, связанных с теми или иными вариациями нуклеотидной последовательности ДНК. Таким образом, любой ген (в более широком смысле – любой генетический локус) может существовать в виде различных альтернативных вариантов – аллелей. Количество аллелей одного гена может составлять от двух до нескольких десятков. Аллели имеют идентичную локализацию в гомологичных хромосомах. Обычно белки, кодируемые разными аллелями одного гена, обладают одинаковыми функциональными свойствами, то есть замена аминокислоты нейтральна или почти нейтральна с точки зрения естественного отбора. О наличии тех или иных аллелей часто судят на основании анализа аминокислотной последовательности соответствующих белков. Большинство генов в каждом организме представлено двумя аллелями, один из которых унаследован от отца, а другой — от матери. Если оба аллеля идентичны, то организм считается гомозиготным, если разные — гетерозиготным. В ходе эволюции разные аллели произошли в результате мутаций от единого аллеляпредшественника. Таким образом, гены, которые представлены в популяции несколькими разновидностями (аллелями), называют полиморфными. Существование генетического полиморфизма обусловливает разнообразие признаков внутри вида и является обязательным условием разнообразия живой природы. Изучение полиморфизмов ДНК широко используются для исследования популяционного разнообразия, поиска причин возникновения генетических заболеваний, выявления генетических ассоциаций, оценки чувствительности пациента к лекарственному средству, генетической идентификации личности.
Причины возникновения полиморфизмов
Любое изменение структуры ДНК, возникающее спонтанно либо индуцированное путем целенаправленного воздействия физическими или химическими факторами, называется мутацией. Мутации ведут к возникновению новых аллелей соответствующих генов и лежат в основе генетической изменчивости в живой природе. Во многих случаях мутация не имеет каких-либо заметных фенотипических последствий например, при ее локализации в функционально незначимых областях молекулы ДНК. Другим примером «молчащей мутации» является такая замена нуклеотида, при которой новый кодон имеет прежний информационный смысл, т.е. кодирует ту же самую аминокислоту и поэтому не меняет структуру белка. Такие нейтральные мутации рассматриваются как нормальные полиморфизмы, они не элиминируются отбором и могут иметь достаточно высокую частоту в популяции. В отличие от нейтральных мутаций (полиморфизмов), патологические мутации приводят к нарушению механизма транскрипции/трансляции гена либо к синтезу аномального белкового продукта. В литературе общий термин «мутация» нередко используется применительно именно к таким случаям нарушений структуры гена, которые имеют несомненное патогенетическое значение.
Типы полиморфизмов
Полиморфизмы нуклеотидных последовательностей обнаружены во всех структурных элементах генома: экзонах, интронах, регуляторных участках и т.д. Тем не менее, вариации, затрагивающие кодирующие фрагменты генов и отражающиеся на аминокислотной последовательности их продуктов, встречаются относительно редко. Полиморфизм ДНК еще более выражен в некодирующих областях генома, что может
приводить к изменению в уровне экспрессии мРНК гена. Если один и тот же ген у разных людей отличается только на один нуклеотид, то в таком случае говорят об однонуклеотидном полиморфизме или SNP (англ. single nucleotid polymorphism). Однонуклеотидный полиморфизм является самым распространённым. Так в геноме человека в среднем он встречается один на 300 нуклеотидов. Такая высокая плотность позволяет эффективно использовать SNP в качестве генетического маркёра. Помимо замены отдельных нуклеотидов в основе полиморфизма ДНК лежат вставки, делеции и изменение числа микросателлитных (1-6 п.н. STR — short tandem repeats) и
минисателлитных (7-190 п.н. VNTR — variable number tandem repeats) тандемных повторов. Приблизительное число уникальных полиморфизмов составляет — 50 млн. Другим распространённым видом генетического полиморфизма является вариация числа копий (Copy number variation, CNV). В этом случае в популяции наблюдаются вариации числа копий протяжённых участков ДНК, которые могут нести в себе функциональные гены. Происходит это за счет небалансированных хромосомных перестроек, таких как делеции и дупликации. Около 100 полиморфизмов возникают de novo в каждом поколении. В геномах разных людей различается одна из 100-200 п.н. Ген, считается полиморфным, если его самый распространенный аллель встречается менее чем у 99% людей или частота наиболее редкого аллеля при полиморфизме должна быть не менее 1%. Это определение отражает только распространенность разных аллелей, а не их функциональные различия.
Генетический полиморфизм и фенотип
Фенотипическое выражение десятков миллионов полиморфных участков ДНК в человеческой популяции проявляется в колоссальном генетическом разнообразии популяции. Широко известное использование полиморфизма в криминалистике является мощным и надёжным инструментом для установления тождества личности. В науке и медицине полиморфизм используют в качестве генетического маркера для поиска генов ответственных за возникновения генетических заболеваний. Для функционального исследования генетического полиморфизма в 2008 году был запущен проект под название «1000 геномов», который поставил целью описать все генетическое разнообразие человеческой популяции. В результате секвенирования около 1100 геномов людей, относящихся к 14 популяциям (в Европе, Африке, Восточной Азии, Северной и Южной Америках) было картировано 38 миллионов SNP, 1,4 миллиона инсерций/делеций и свыше 14 тысяч крупных делеций. Полученные данные сегодня активно используются мировым научным сообществом для исследования генетики сложных заболеваний, таких как рак, болезни сердца и диабет, и многие другие.
Прямая ДНК-диагностика
Выдающийся медицинский генетик Виктор Алмон Маккьюсик в 1966 году создал и опубликовал каталог генов - «MIM» («Mendelian Inheritance in Man»), менделеевской наследственности у человека. Этот труд претерпел уже 12 изданий, и на сегодняшний день существует в виде удобной интернет базы данных – OMIM, в которой собирается информация об известных заболеваниях с генетическим компонентом и генах, ответственных за их развитие.
На сегодняшний день в OMIM описано 4026 фенотипов для которых известна молекулярная основа патогенеза и 1719 фенотипов для которых она не известна. Моногенные болезни, обусловленные мутациями в одном гене, подчиняются менделевским законам наследования. Моногенные болезни составляют 18% случаев наследственных заболеваний.
Прямая ДНК-диагностика предполагает непосредственное выявление мутации (измененной нуклеотидной последовательности в исследуемом гене), являющейся непосредственной причиной заболевания. Она обладает практически абсолютной (100%) точностью, требует для анализа только образец ДНК обследуемого лица и может проводиться как в семейных, так и в спорадических случаях заболеваний.
Исходным материалом для проведения ДНК-диагностики заболеваний, обусловленных мутациями ядерных генов, могут служить любые клетки организма, содержащие ядро. Обычно для этих целей используются кровь обследуемого. В некоторых случаях (например, при митохондриальных болезнях, обусловленных мутациями мтДНК с преимущественной экспрессией мутации в мышечной ткани) более адекватным источником ДНК являются биоптаты мышц. Генодиагностика может также проводиться на основе исследования ДНК, выделяемой из клеток эпителия полости рта, кожных фибробластов и т.д. При проведении пренатальной ДНК-диагностики у плода (обычно на 10 21-й неделе беременности) источником ДНК служат биоптаты хориона, плаценты, клетки амниотической жидкости (получаемые при амниоцентезе) или лимфоциты пуповинной крови (кордоцентез).
Методы детекции мутантных генов
Для проведения прямой ДНК-диагностики необходимо точно знать структуру гена или конкретного участка гена, содержащего анализируемую мутацию. Методические подходы, используемые при прямой ДНК-диагностике того или иного наследственного заболевания, зависят от характера мутаций и молекулярной организации соответствующего гена. Характер изменений нуклеотидного состава гена может быть различным. Наиболее распространенными являются нуклеотидные замены, ведущие к нарушению аминокислотного состава белка. Такие мутации обозначаются термином точечные мутации; они могут локализоваться в любой области гена. Поиск точечных мутаций у конкретного больного основывается на сочетании специальных методов скрининга кодирующей области гена с прямым секвенированием (определением первичной нуклеотидной последовательности) мутантного фрагмента ДНК. Такой подход является исключительно трудоемким и может применяться лишь в высокоспециализированных лабораториях. Однако в конкретных популяциях мутационный анализ при том или ином наследственном заболевании может быть существенно упрощен в связи с высокой частотой так называемых мажорных мутаций, обусловленных эффектом основателя. Например, при гепатолентикулярной дегенерации описано свыше 100 различных мутаций в гене АТР7В; при этом одна и та же точечная мутация в 14-м экзоне гена, ведущая к замене гистидина на глутамин, выявляется в славянских популяциях России у более, чем 60% больных. Это позволяет проводить относительно простую и экономную ДНК-диагностику гепатолентикулярной дегенерации (включая доклиническую диагностику носительства мутантного гена) в большинстве обследуемых семей из данной этнической группы.
В настоящее время большинство протоколов прямой ДНК-диагностики базируется на полимеразной цепной реакции (ПЦР). Метод ПЦР позволяет обнаружить в пробе всего одну молекулу ДНК. Принцип метода основан на многократном увеличении числа копий искомого участка ДНК, достаточного для достоверной визуализации. Амплификацию (умножение) нуклеотидной последовательности ДНК катализирует ДНК-полимераза. Процесс репликации искомого фрагмента ДНК обуславливают генспецифические праймеры ДНК-олигонуклеотиды, каждый из которых комплементарен одной из двух цепей молекулы ДНК (рис. 1). Праймеры (20–30 нуклеотидных пар) служат затравками для ДНК-полимеразы при синтезе комплементарной цепи ДНК. Длина амплифицируемого
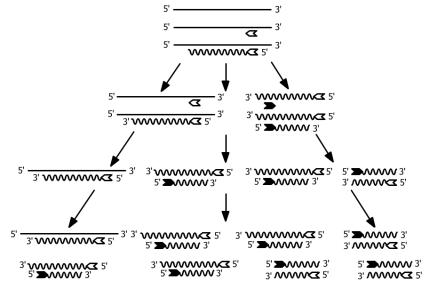
участка синтезируемой ДНК ограничена праймерами и обычно составляет несколько сот п.н. При этом каждая вновь синтезированная цепь ДНК (амплификон) служит матрицей для синтеза новой цепи комплементарной ДНК. Для получения достаточного количества копий искомого фрагмента ДНК требуется от 20 до 30 циклов ПЦР, характеризующихся экспоненциальным увеличением числа копий специфического фрагмента ДНК. Каждый цикл реакции включает 3 этапа, протекающих в различных температурных режимах.
1 этап (денатурация). Нагревание ДНК до 95 С, в результате чего двухцепочечные молекулы ДНК расплетаются с образованием двух одноцепочечных молекул.
2этап (отжиг). Гибридизация праймеров при 55–60 С с комплементарными последовательностями на противоположных цепях ДНК (на левой и правой границах амплифицируемого фрагмента). Генспецифические праймеры создают при помощи компьютерных программ, использующих информацию о нуклеотидной последовательности известных генов микроорганизмов или генов человека, предоставленных на сайтах GenBank (www.ncbi.nlm.nih.gov/) и EMBL (www.ebi.ac.uk/embl.html).
3этап (элонгация). При температуре 68–72 С праймеры в присутствии ДНК-полимеразы и дезоксирибонуклеотидтрифосфатов служат затравками для синтеза комплементарной цепи на ДНК-матрице, начинающийся от места гибридизации праймера и происходящий в
направлении 5’ 3’. В последующих циклах вновь синтезируемые молекулы ДНК становятся, в свою очередь, матрицей для аналогичного синтеза новых копий. Поскольку синтез каждой из 2 антипараллельных цепей ДНК начинается от места гибридизации праймера, эти места и становятся границами синтезируемого участка. По сути, метод ПЦР как бы «имитирует» на ограниченном участке гена естественный процесс репликации ДНК, происходящий in vivo.
Рис. 1. Полимеразная цепная реакция. Специфическая пара праймеров служит затравкой для амплификации искомого фрагмента ДНК. Один из праймеров (светлая стрелка) обеспечивает синтез ДНК от правой границы амплифицируемого фрагмента, а второй (чёрная стрелка) от левой. При этом каждая вновь синтезированная цепь ДНК является матрицей для дальнейшего синтеза ДНК. Поэтому с каждым циклом реакции происходит экспоненциальный рост количества копий искомого фрагмента ДНК.
Мультиплексная (мультипраймерная) ПЦР основана на одновременной амплификации в одной реакции нескольких экзонов исследуемого гена, что позволяет проводить экономный экспресс-скрининг наиболее частых мутаций в гене. Например, для быстрой диагностики носительства делеций в гене дистрофина у больных прогрессирующей мышечной дистрофией Дюшенна и Бекера проводится одновременная амплификация набора наиболее часто мутирующих экзонов данного гена. Поскольку эти заболевания наследуются по Х-сцепленному рецессивному типу и связаны с повреждением у мальчиков единственной Х-хромосомы, в случае протяженной делеции при электрофорезе продуктов реакции будет выявлено отсутствие одного или нескольких фрагментов ДНК (экзонов), что может служить молекулярным подтверждением диагноза. Более того, путем подбора для ПЦР-амплификации конкретных участков гена возможна достаточно точная оценка общей протяженности делеции и точек разрыва гена (вплоть до экзона). Комбинированное использование нескольких мультиплексных реакций позволяет диагностировать до 98% всех делеций, имеющих место у больных прогрессирующей мышечной дистрофией Дюшенна/Бекера. Это составляет приблизительно 60% от общего числа известных мутаций в гене дистрофина и свидетельствует о весьма высокой эффективности данного скринингового метода ДНК-диагностики дистрофинопатий. На рисунке 25 показан пример прямой ДНК-диагностики мышечной дистрофии Дюшенна при мультиплексной ПЦР (выявление различных делеций в гене дистрофина).
Аллель-специфическая амплификация основана на использовании двух самостоятельных пар праймеров к конкретному участку ген: один праймер в обеих парах является общим, а второй праймер в каждой паре имеет различную структуру и является комплементарным либо нормальной, либо мутантной последовательности ДНК. В результате такой реакции в растворе одновременно могут синтезироваться две разновидности ПЦР-продуктов – нормальные и мутантные, причем дизайн используемых праймеров дает возможность четко дифференцировать нормальные и мутантные продукты амплификации по их молекулярному размеру. Метод является очень наглядным и позволяет верифицировать как гомо-, так и гетерозиготное носительство мутантного аллеля.
ПЦР с обратной транскрипцией. Для выявления специфических участков генома РНКсодержащих вирусов или исследования транскрипции гена-мишени (синтеза информационной РНК) сначала получают ДНК-копию с РНК-матрицы (информационной РНК), используя реакцию обратной транскрипции, катализируемую ферментом ревертазой (обратной транскриптазой). Синтезированные таким образом комплементарные ДНК (кДНК) служат матрицами для генспецефических праймеров в ПЦР. Положительная ПЦР с праймерами, комплементарыми специфической вирусной РНК, доказывает присутствие данного вируса в исследуемом материале. Обнаружение информационной РНК мутированного гена в образце ткани свидетельствует о транскрипции данного гена, т.е. его функциональной активности. Метод позволяет ответить на вопрос, работает или молчит определённый ген.
ПЦР в реальном времени. Показателем уровня экспрессии гена служит концентрация соответствующей информационной РНК. Метод ПЦР в реальном времени даёт возможность не только обнаружить в исследуемой ткани разрешённый к экспрессии ген, но и по динамике изменения концентрации информационной РНК количественно оценить активность этого гена. Из исследуемого материала экстрагируют РНК и с помощью обратной транскриптазы синтезируют комплементарные ДНК. Далее с кДНК-матрицы (реплика информационной РНК) в присутствии генспецифических праймеров и ДНКполимеразы выполняют ПЦР. В ходе реакции каждый амплифицируемый фрагмент включает флуоресцентую метку. По характеру включения метки специальные
компьютерные программы позволяют определить абсолютное количество молекул мРНК в ткани и таким образом оценить степень функциональной активности гена.
Частота мутантных генов в популяции
Частые наследственные заболевания – 1:10 000 и чаще
Редкие наследственные заболевания – 1:100 000 и реже
Частота мутантных генов в человеческих популяциях обусловлена влиянием естественного отбора и зависит от принадлежности популяции к этнической группе, занимающей определённую географическую зону. Преимущественно наследственные заболевания и заболевания с наследственной предрасположенностью наследуется по рецессивному типу. Заболевания проявляются у детей в браке гетерозиготных носителей (отца и матери) мутантного гена. В популяциях поддерживается сбалансированный полиморфизм генов — присутствие двух и более аллелей одного гена при условии доминирования нормального аллеля. Если частота мутантного аллеля гена в популяции достаточно высока, то соответственно повышается риск проявления рецессивных мутаций.
В некоторых районах Африки до 40% новорождённых гетерозиготны по мутантному аллелю (S) гена гемоглобина. У гомозигот S/S развивается смертельная серповидноклеточная анемия. Гетерозиготы А/S остаются здоровыми. Казалось бы, что естественный отбор должен элиминировать мутантный аллель гена гемоглобина (со смертью гомозиготных носителей), однако его частота остаётся высокой. Сохранение в популяции гетерозигот А/S обусловлено фактом, что такие гетерозиготы более устойчивы к малярии, распространённой на этой геграфической зоне. Селективное преимущество гетерозигот препятствует элиминации мутантных генов в гомозиготном состоянии и таким образом поддерживается сбалансированный полиморфизм генов. Особенности географической локализации наследственных болезней могут быть также обусловлены накоплением мутантных аллелей генов на определённой территории в результате высокой частоты близкородственных браков или миграцией носителей мутатного аллеля гена вдоль исторически сложившихся торговых путей, например путей, связывавших в прошлом Индию со средиземноморскими странами.
Скрининг новорожденных на наследственные болезни
В связи с важностью профилактики наследственных заболеваний принята специальная государственная программа (Национальный проект), по обязательному исследованию всех беременных женщин на шесть наиболее распространённых тяжелых генетических заболеваний:
1.синдром Дауна;
2.фенилкетонурия;
3.врождённый гипотериоз;
4.галактоземия;
5.адреногенитальный синдром;
6.муковисцидоз.
Скрининг популяции на гетерозиготное носительство мутантных генов
Каждый человек — гетерозиготный носитель 5 и более мутаций. Если у обоих брачующихся будут обнаружены одинаковые мутации, ведущие к болезни Тея-Сакса (детское слабоумие) или муковисцидозу, то вероятность рождения больных детей у таких
