
- •Поверхневі явища та дисперсні системи
- •Лабораторна робота № 1 «адсорбція»
- •Стислі теоретичні відомості
- •Робота 1.1. Адсорбція органічної кислоти вугіллям з водного розчину Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 2 «поверхневий натяг. Адсорбція на рідкій поверхні»
- •Стислі теоретичні відомості
- •Методи визначення поверхневого натягу
- •Метод підрахунку крапель
- •Метод максимального тиску газового пухирця (метод Ребіндера)
- •Робота 2.1. Адсорбція на поверхні рідини
- •Хід виконання роботи
- •Робота 2.2. Визначення питомої поверхні адсорбента
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 3 «теплота змочування»
- •Стислі теоретичні відомості
- •Робота 3.1. Визначення природи поверхні гідрофільних та гідрофобних речовин калориметричним методом
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 4 «седиментація»
- •Стислі теоретичні відомості
- •Робота 4.1. Седиментаційний аналіз суспензії
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 5 «в’язкість»
- •Стислі теоретичні відомості
- •Робота 5.1. Дослідження в’язкості структурованих розчинів
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Таблиця 5.4. Значення констант k та рівняння Марка–Куна–Хаувінка для деяких систем полімер – розчинник
- •Хід виконання роботи
- •Таблиця 5.5. Дані для приготування досліджуваних розчинів
- •Таблиця 5.6. Експериментальні дані та результати розрахунків
- •Питання до лабораторної роботи
- •Лабораторна робота № 6 «одержання та коагуляцiя золів»
- •Стислі теоретичні відомості
- •Робота 6.1. Приготування золів
- •Хід виконання роботи
- •1. Фiзична конденсацiя (замiна розчинника)
- •2. Хiмiчна конденсацiя
- •2.1. Метод окисно-вiдновних реакцiй
- •2.2. Метод реакцiй обмiну
- •2.3. Реакцiї гiдролiзу
- •3. Отримання золю гiдроксиду залiза (III) пептизацiєю
- •3.1. Адсорбцiйна пептизацiя
- •3.2. Диссолюцiйна пептизація
- •4. Одержання емульсiї
- •Робота 6.2. Визначення знаку заряду частинок золів на підставі правила валентності – значності Хід виконання роботи
- •Робота 6.3. Визначення порогу коагуляцiї золю Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 7 «електрофорез»
- •Стислі теоретичнi вiдомостi
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Перелік рекомендованої літератури
Лабораторна робота № 1 «адсорбція»
Перед тим, як виконувати лабораторну роботу, необхідно засвоїти основні поняття (адсорбент, адсорбат, ізотерма адсорбції), ознайомитися з кількісним описом залежності величини адсорбції на твердому адсорбенті від концентрації адсорбата (рівняння Фрейндліха та Ленгмюра). Слід звернути особливу увагу на одиниці вимірювання та методику визначення величини адсорбції, а також на розрахунок констант ізотерм адсорбції.
Метою роботи є експериментальне встановлення параметрів адсорбційного процесу на твердій поверхні.
Стислі теоретичні відомості
Тверді тіла, що контактують з розчином, здатні поглинати деяку кількість розчиненої речовини, накопичуючи її на своїй поверхні. Аналогічні явища спостерігаються і при контакті твердих тіл з газами. Процес адсорбції можна розглядати як самочинну зміну концентрації одного з компонентів гетерогенної системи на межі поділу фаз. Фаза гетерогенної системи, на поверхні якої відбувається адсорбція, називається адсорбентом, речовина, що адсорбується, – адсорбатом. Причиною адсорбції є те, що поверхневі молекули адсорбенту енергетично ненасичені і мають надлишок вільної поверхневої енергії. Щоб зменшити цей надлишок, поверхня адсорбенту поглинає молекули адсорбату з оточуючого газу або розчину. При цьому величина вільної енергії системи зменшується (ΔG < 0), тому даний процес перебігає самочинно.
Величину адсорбції
![]() прийнято виражати або як відношення
кількості речовини адсорбату до одиниці
площі поверхні адсорбенту (кмоль/м2),
або як відношення кількості речовини
адсорбату до одиниці маси адсорбенту
(кмоль/кг). В останньому випадку вона
називається питомою адсорбцією. Величина
адсорбції залежить від природи адсорбенту,
стану та величини площі його поверхні,
природи адсорбату, температури,
концентрації розчину (у випадку адсорбції
газу або пари – від їх парціального
тиску). На адсорбцію з розчинів впливає
також природа розчинника.
прийнято виражати або як відношення
кількості речовини адсорбату до одиниці
площі поверхні адсорбенту (кмоль/м2),
або як відношення кількості речовини
адсорбату до одиниці маси адсорбенту
(кмоль/кг). В останньому випадку вона
називається питомою адсорбцією. Величина
адсорбції залежить від природи адсорбенту,
стану та величини площі його поверхні,
природи адсорбату, температури,
концентрації розчину (у випадку адсорбції
газу або пари – від їх парціального
тиску). На адсорбцію з розчинів впливає
також природа розчинника.
Залежність величини
адсорбції
![]() від рівноважної концентрації
від рівноважної концентрації![]() адсорбату у розчині за сталої температури
називається ізотермою адсорбції (рис.1).
адсорбату у розчині за сталої температури
називається ізотермою адсорбції (рис.1).

Рис.1. Ізотерма мономолекулярної адсорбції за Ленгмюром
При малих значеннях
рівноважної концентрації адсорбату в
розчині величина адсорбції збільшується
прямо пропорційно цій концентрації,
при середніх значеннях
![]() на ізотермі адсорбції спостерігається
випукла ділянка, а при великих значеннях
рівноважної концентрації адсорбату
на ізотермі адсорбції спостерігається
випукла ділянка, а при великих значеннях
рівноважної концентрації адсорбату![]() прагне до певної величини, яку називають
граничною адсорбцією і позначаютьa
.
прагне до певної величини, яку називають
граничною адсорбцією і позначаютьa
.
При адсорбції з розчинів ізотерма адсорбції у широкому діапазоні концентрацій адсорбату добре описується рівнянням Ленгмюра:
|
|
(1.1) |
де a
– величина адсорбції (кмоль/кг) за
рівноважної концентрації адсорбату
![]() (моль/м3);
a∞
– гранична адсорбція (кмоль/кг); К
– константа рівноваги процесу адсорбції
(м3/кмоль).
(моль/м3);
a∞
– гранична адсорбція (кмоль/кг); К
– константа рівноваги процесу адсорбції
(м3/кмоль).
Криволінійну ділянку ізотерми адсорбції добре описує рівняння Фрейндліха
|
|
(1.2) |
де k і n – емпіричні константи.
Робота 1.1. Адсорбція органічної кислоти вугіллям з водного розчину Хід виконання роботи
Визначити концентрацію вихідного розчину одноосновної карбонової кислоти (мурашиної, оцтової або пропіонової за вказівкою викладача). Для цього відібрати піпеткою зі склянки з кислотою в колбу для титрування 5 см3 розчину кислоти та відтитрувати його 0,1–молярним розчином лугу КОН в присутності індикатора – фенолфталеїну. Розчин титрувати 3 рази до одержання результатів, що співпадають між собою з точністю ± 0,2 см3. Результати титрування занести в табл. 1.1. За середнім значенням об’єму розчину лугу, витраченого на титрування, розрахувати концентрацію вихідного розчину кислоти.
Таблиця 1.1. Дані для розрахунку концентрації вихідного розчину кислоти
|
Назва кислоти |
Об’єм
розчину лугу, витраченого на титрування,
| |||
|
|
1 проба |
2 проба |
3 проба |
Середнє значення
|
|
|
|
|
| |
|
Концентрація кислоти у вихідному розчині, кмоль/м3:
| ||||
Приготувати п’ять розчинів кислоти різних концентрацій об’ємом 60 см3 кожний, відміряючи бюреткою в п’ять окремих колб зазначені в табл. 1.2 об’єми вихідного розчину кислоти (Vк-ти) та дистильованої води (Vводи). Розрахувати початкові концентрації кислоти
 (кмоль/м3)
у п’яти отриманих розчинах за рівнянням:
(кмоль/м3)
у п’яти отриманих розчинах за рівнянням:
![]() ,
,
де Vк-ти – об’єм вихідного розчину кислоти (см3) із концентрацією ск-ти, взятого для приготування розчину за табл. 1.2. Результати розрахунків записати у табл. 1.4.
Таблиця 1.2. Дані для приготування розчинів кислоти
|
Номер колби |
1 |
2 |
3 |
4 |
5 |
|
Vк-ти , см3 |
50 |
35 |
20 |
10 |
6 |
|
Vводи, см3 |
10 |
25 |
40 |
50 |
54 |
Зважити на технічних терезах з точністю до 0,01 г 5 наважок активованого вугілля масою 1 г (або іншою масою за вказівкою викладача).
Висипати зважені наважки активованого вугілля в колби з приготованими розчинами. Процес адсорбції повинен тривати не менше 20 хвилин до встановлення адсорбційної рівноваги. Протягом цього часу вміст колб необхідно періодично (з інтервалом у півтори – дві хвилини) збовтувати.
Після встановлення рівноваги профільтрувати розчини у пронумеровані чисті колби в два етапи:
– спочатку через сухі! складані паперові фільтри пропустити перші порції розчинів (~ 1/10 всього об’єму кожного з розчинів, тобто 57 см3), змочуючи таким чином фільтри. Ці перші частини фільтратів необхідно вилити, оскільки концентрація кислоти в них занижена внаслідок її адсорбції на фільтрувальному папері;
– після цього профільтрувати залишки розчинів.
Відтитрувати отримані фільтрати, відбираючи піпеткою з кожної колби об’єми проб, які зазначено в табл. 1.3 (для забезпечення однакової точності титрування об’єми аліквот для фільтратів із різним вмістом кислоти повинні бути різними). Титрування, як і в попередніх випадках, проводити 0,1 М розчином лугу в присутності фенолфталеїну 2 рази до одержання співпадаючих з точністю ± 0,2 см3 результатів. Об’єми витраченого на титрування розчину лугу записати в табл. 1.3.
Таблиця 1.3. Результати титрування розчинів кислоти
|
Номер колби |
1 |
2 |
3 |
4 |
5 |
|
Vпроби, см3 |
5 |
5 |
10 |
20 |
20 |
|
Vлугу, см3 |
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
Визначити рівноважні концентрації кислоти с у розчинах за формулою:
![]() ,
,
де ![]() – концентрація розчину лугу, кмоль/м3;
Vлугу
– об’єм розчину лугу, який витрачено
на титрування об’єму Vпроби,
см3.
Розраховані значення рівноважних
концентрацій кислоти у фільтратах
занести у табл. 1.4.
– концентрація розчину лугу, кмоль/м3;
Vлугу
– об’єм розчину лугу, який витрачено
на титрування об’єму Vпроби,
см3.
Розраховані значення рівноважних
концентрацій кислоти у фільтратах
занести у табл. 1.4.
Використовуючи дані табл. 1.4, обчислити експериментальні значення питомої адсорбції aексп. (кмоль/кг):
![]() ,
,
де
![]() –
початкова концентрація кислоти у
розчині, кмоль/м3;
с – рівноважна
концентрація кислоти після встановлення
адсорбційної рівноваги, кмоль/м3;
V
– об’єм розчину кислоти (в нашому
випадку V =
60 см3
= 60·10–6
м3);
m
– маса наважки активованого вугілля,
кг. Записати обчислені експериментальні
значення питомої адсорбції у табл. 1.4.
–
початкова концентрація кислоти у
розчині, кмоль/м3;
с – рівноважна
концентрація кислоти після встановлення
адсорбційної рівноваги, кмоль/м3;
V
– об’єм розчину кислоти (в нашому
випадку V =
60 см3
= 60·10–6
м3);
m
– маса наважки активованого вугілля,
кг. Записати обчислені експериментальні
значення питомої адсорбції у табл. 1.4.
Апроксимувати експериментально отримані значення величини адсорбції
 за допомогою рівняння Фрейндліха (1.2),
користуючись для визначення його
констант логарифмічною формою у вигляді:
за допомогою рівняння Фрейндліха (1.2),
користуючись для визначення його
констант логарифмічною формою у вигляді:
![]() .
.
Для цього розрахувати
значення логарифмів рівноважних
концентрацій і логарифмів величин
експериментальної адсорбції, записати
їх у табл. 1.4 та побудувати графік в
координатах
![]() (рис. 2).
(рис. 2).
В зазначених
координатах рівняння Фрейндліха є
прямою, тангенс кута нахилу якої дорівнює
![]() ,авідрізок,
який лінія відтинає на осі ординат,
відповідає
,авідрізок,
який лінія відтинає на осі ординат,
відповідає ![]() .
.
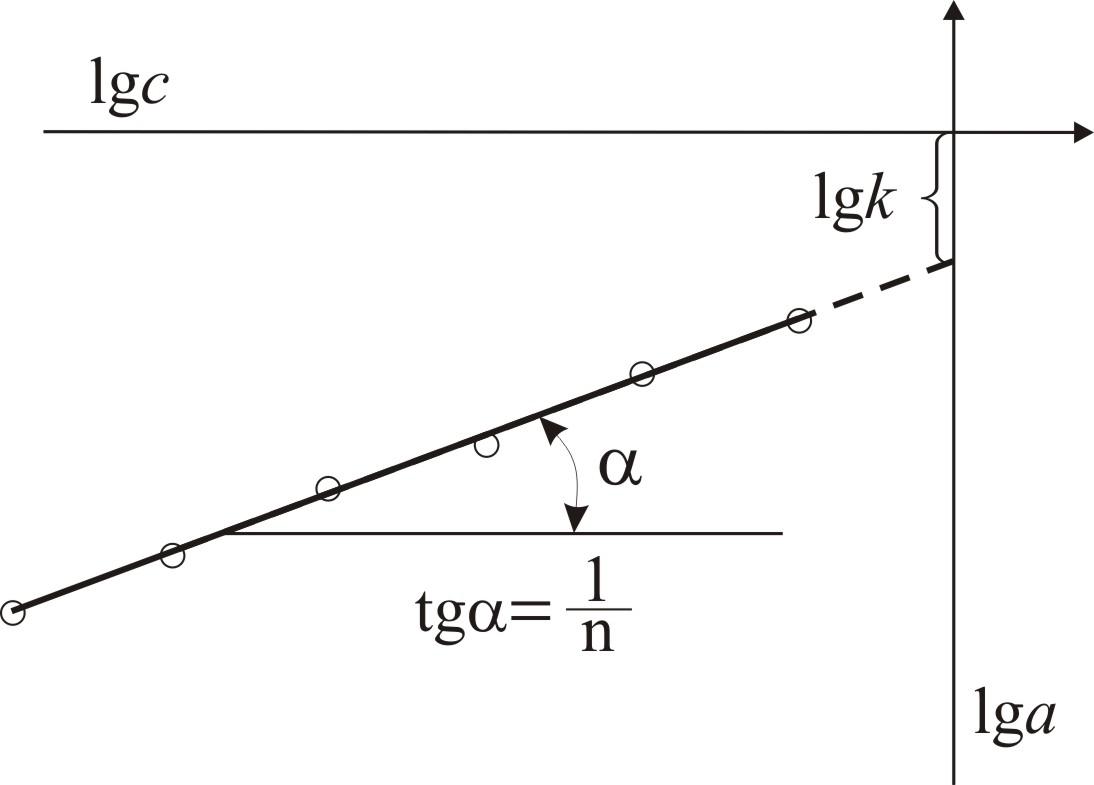
Рис. 2. Графік для визначення констант рівняння Фрейндліха
Користуючись отриманими значеннями констант k та n, обчислити за рівнянням (1.2) для кожної рівноважної концентрації с апроксимовані величини питомої адсорбції aапр.. Розраховані апроксимовані значення записати у табл. 1.4, побудувати графік
 і визначити за ним максимальне
експериментальне значення величини
адсорбції
amax.
і визначити за ним максимальне
експериментальне значення величини
адсорбції
amax.
Таблиця 1.4. Експериментальні та розрахункові дані адсорбції кислоти на вугіллі
|
Номер колби |
|
с, кмоль/м3 |
аексп., кмоль/кг |
|
|
аапр., кмоль/кг |
|
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
Визначити константи
 і
і рівняння Ленгмюра (1.1), використовуючи
його лінеаризовану форму
рівняння Ленгмюра (1.1), використовуючи
його лінеаризовану форму
![]() .
.
Для цього розрахувати
значення величин ![]() та побудувати лінійну залежність
та побудувати лінійну залежність ![]() (рис. 3). За графіком
обчислити величину граничної адсорбції
a,
яка є оберненою до тангенса кута нахилу
прямої. За величиною граничної адсорбції
та за відрізком, який пряма відтинає на
осі ординат, розрахувати константу
(рис. 3). За графіком
обчислити величину граничної адсорбції
a,
яка є оберненою до тангенса кута нахилу
прямої. За величиною граничної адсорбції
та за відрізком, який пряма відтинає на
осі ординат, розрахувати константу
![]() рівняння Ленгмюра.
рівняння Ленгмюра.
Визначити ефективність процесу адсорбції за формулою:
![]() ,
,
де аmах – максимальне експериментальне значення величини адсорбції.

Рис. 3. Графік для визначення граничної адсорбції та константи рівноваги процесу
Розрахувати значення питомої поверхні адсорбенту за величиною граничної адсорбції, скориставшись рівнянням
![]() ,
,
де a – величина граничної адсорбції; NA – число Авогадро; S0 – площа, яку займає молекула кислоти на поверхні адсорбенту. Ця площа визначається розміром гідрофільної частини молекули, тому для молекул одного гомологічного ряду вона є однаковою. У випадку одноосновних карбонових кислот S0 = 2210–20 м2 = 22 Å2.
Звіт
Таблиці 1.1, 1.3 та 1.4.
Графіки
![]() ;
;![]() ;
;![]() .
.
Константи рівняння Фрейндліха k = та n = .
Величина граничної адсорбції a = кмоль/кг.
Константа рівняння Ленгмюра K = м3/кмоль.
Ефективність адсорбції = %.
Питома поверхня активованого вугілля Sпит. = м2/кг.
Висновок.
