
- •Высокоэластическое состояние полимеров
- •Вязко-текучее (пластическое) состояние полимеров
- •Кристаллические полимеры
- •Кристаллизация полимеров и их кристаллическая структура.
- •Свойства кристаллических полимеров
- •Системы полимер - низкомолекулярная жидкость. Истинные растворы полимеров
- •Истинные растворы высокомолекулярных соединений
- •Образование истинных растворов полимеров.
- •Свойства растворов полимеров а. Разбавленные растворы
- •Б. Концентрированные растворы
- •В.Растворы полиэлектролитов
Б. Концентрированные растворы
Концентрированные растворы полимеров – это растворы, в которых, в отличие от разбавленных растворов, проявляется заметное взаимодействие между растворенными макромолекулами. Можно считать, что в этих растворах макромолекулы как бы сцеплены в отдельных местах, и в растворе образуетсяпространственная сетка зацеплений. Свойства концентрированных растворов начинают проявляться для жесткоцепных полимеров уже при концентрациях менее 1%, для гибкоцепных – при концентрациях порядка 5%.
Существование сетки зацеплений приводит к тому, что вязкость концентрированных растворов намного выше вязкости разбавленных; вязкость растворов растет намного быстрее, чем концентрация. Если представить зависимость вязкости от концентрации как η ~ сn, то для разбавленных растворовn= 1, а для концентрированныхn= 10-20.
Концентрированные растворы полимеров не являются ньютоновскими жидкостями: при увеличении скорости течения вязкость уменьшаетсявследствие разрушения сетки зацеплений; после прекращения течения сетка зацеплений образуется снова, и вязкость принимает первоначальное значение. Такое обратимое уменьшение вязкости носит названиетиксотропии.
В концентрированных растворах жесткоцепныхполимеров при определенной концентрации возникаетжидкокристаллическая структура: макромолекулы ориентируются друг относительно друга. Приближенной аналогией этого явления можно считать укладку жестких палочек (например, спичек) в коробку, стенки которой постепенно сдвигаются; в конце концов, палочки вынуждены укладываться параллельно. Поскольку жесткие макромолекулы в растворах имеют в первом приближении форму палочек, аналогия представляется оправданной. Обычно образование жидкокристаллических структур сопровождается расслаиванием раствора на две фазы: более концентрированную жидкокристаллическую (мезофазу) и более разбавленную с изотропным расположением макромолекул. Образование жидкокристаллических структур сопровождается характерным изменением вязкости раствора (рис. 45):
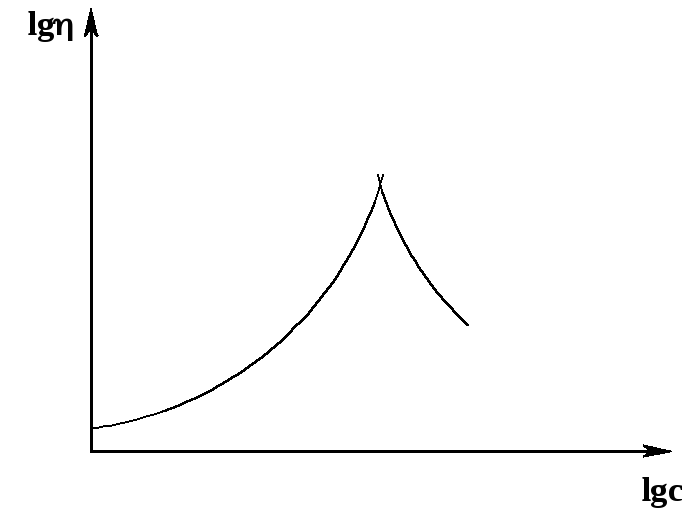 Рис. 45. Зависимость
вязкости от концентрации раствора
полимера при образовании жидкокристаллической
структуры.
Рис. 45. Зависимость
вязкости от концентрации раствора
полимера при образовании жидкокристаллической
структуры.
Перед образованием жидкокристаллической структуры вязкость резко возрастает, а в момент расслоения на две фазы начинает резко падать – за счет образования фазы разбавленного раствора.
Жидкокристаллические растворы используют для получения особо высокопрочных волокон; прочность обусловлена высокой степенью ориентации жесткоцепных макромолекул полимера. Пример – получение высокопрочных волокон на основе ароматических полиамидов ~OC-Ar1-CO-NH-Ar2-NH~, в частности, кевлара, используемого для изготовления бронежилетов.
В.Растворы полиэлектролитов
Особыми свойствами обладают растворы специфических полимеров – полиэлектролитов. Это – полимеры, в макромолекулах которых содержатся заряженные (ионизированные) или ионогенные (способные к ионизации) группы. Наиболее характерны три типа полиэлектролитов:поликислоты, полиоснования иполиамфолиты.
Первые содержат в макромолекулах кислотные группы, способные ионизироваться при растворении и при добавлении к их растворам оснований (увеличении рН). В зависимости от степени диссоциации в растворе различают сильные и слабые поликислоты. К сильным можно отнести полистиролсульфокислоту:
П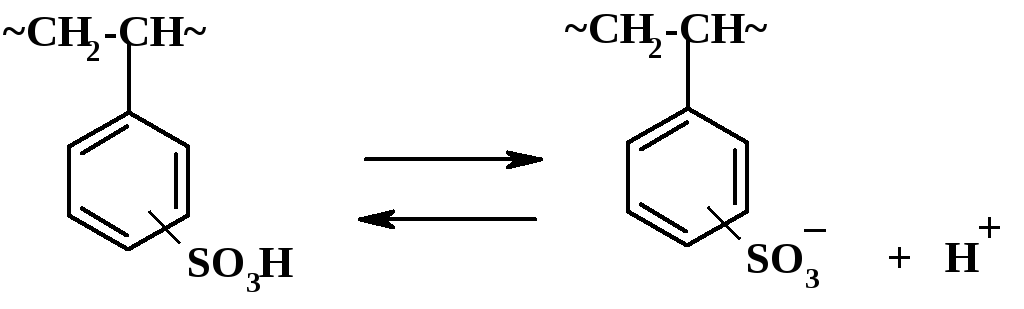 ри
ее растворении в воде ионизируется
большинство сульфогрупп.
ри
ее растворении в воде ионизируется
большинство сульфогрупп.
Пример слабой поликислоты – полиакриловая кислота:
П![]() ри
ее растворении ионизируется малая часть
карбоксильных групп; при добавлении
основания могут, в конечном счете,
ионизироваться все группы. К природным
поликислотам относятся: 1) некоторые
полисахариды, включающие звенья уроновых
кислот (например, альгиновые кислоты);
это слабые поликислоты; 2) нуклеиновые
кислоты; это сильные поликислоты, в
биологических условиях практически
все фосфатные фрагменты в них
ионизированы.(стр. 88).
ри
ее растворении ионизируется малая часть
карбоксильных групп; при добавлении
основания могут, в конечном счете,
ионизироваться все группы. К природным
поликислотам относятся: 1) некоторые
полисахариды, включающие звенья уроновых
кислот (например, альгиновые кислоты);
это слабые поликислоты; 2) нуклеиновые
кислоты; это сильные поликислоты, в
биологических условиях практически
все фосфатные фрагменты в них
ионизированы.(стр. 88).
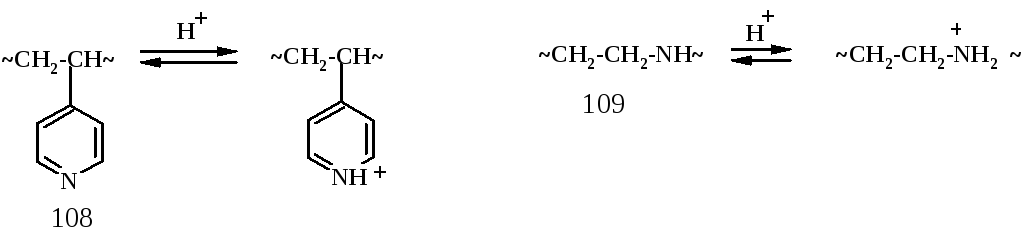 Полиоснования
обычно содержат аминогруппы и относятся
к слабым основаниям или основаниям
средней силы. В качестве примеров можно
привести поливинилпиридин (108) (более
слабое) и полиэтиленимин (109) – несколько
более сильное основание:
Полиоснования
обычно содержат аминогруппы и относятся
к слабым основаниям или основаниям
средней силы. В качестве примеров можно
привести поливинилпиридин (108) (более
слабое) и полиэтиленимин (109) – несколько
более сильное основание:
Ионизация этих полимеров происходит при добавлении протонных кислот.
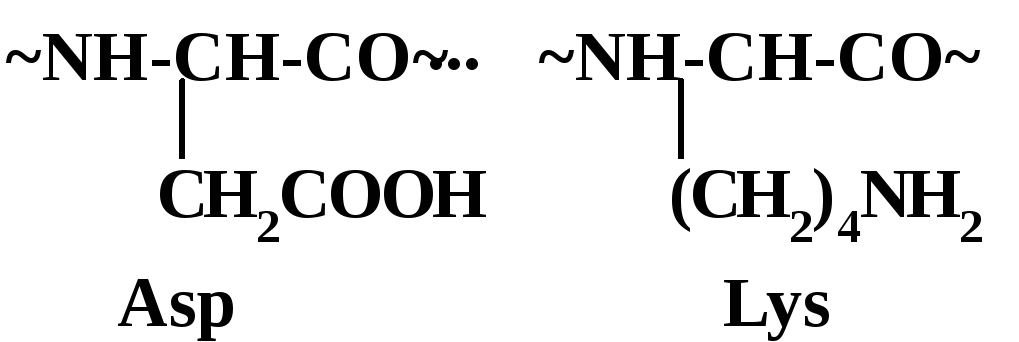 Полиамфолиты
содержат как кислотные, так и основные
группы и могут ионизироваться как в
кислых, так и в основных средах. Наиболее
известный пример – белки; они содержат
как кислотные звенья [например,
аспарагиновой кислоты (Asp)],
так и основные [например, лизиновые
(Lys)]:
Полиамфолиты
содержат как кислотные, так и основные
группы и могут ионизироваться как в
кислых, так и в основных средах. Наиболее
известный пример – белки; они содержат
как кислотные звенья [например,
аспарагиновой кислоты (Asp)],
так и основные [например, лизиновые
(Lys)]:
Свойства растворов полиэлектролитов в очень большой степени зависят от электростатического взаимодействия заряженных частиц. Такими частицами являются заряженные фрагменты макромолекул и их противоионы. Электростатические взаимодействия влияют на конформации макромолекул, причем тем сильнее, чем больше содержание заряженных групп в полимере (т.е. чем сильнее полиэлектролит).
Внутримолекулярное взаимодействие одноименныхзарядов в полимерных кислотах и основаниях – это отталкивание, оно приводит краспрямлениюполимерной цепи, т.е. к формированию вытянутых конформаций. Взаимодействие заряженных групп с противоионами, напротив, является притяжением и препятствует распрямлению цепей. Вразбавленныхрастворах полиэлектролитов противоионы, как правило, имеющие малые размеры, диффундируют по всему объёму раствора и, следовательно, значительная их часть отходит от макромолекул. В результате доминирует внутримолекулярное отталкивание, и макромолекулы имеют вытянутые конформации. С увеличением концентрации раствора противоионы приближаются к макромолекулам, внутримолекулярное взаимодействие ослабевает, и макромолекулы приобретают конформации клубка.
Электростатическое взаимодействие в значительной степени зависит также от характера растворителя. В «хороших» растворителях противоионы имеют гораздо больше степеней свободы, их взаимодействие с заряженными группами полимера менее интенсивное, и клубки рыхлые. Напротив, в «плохих» растворителях противоионы «прилипают» к макромолекулам и сильно взаимодействуют с их заряженными фрагментами; это приводит к сильному сжатию (коллапсу) клубков. Переход происходит в θ-условиях. Картина вполне аналогична переходу клубок-глобула (стр. 156), но изменения здесь еще более резкие.
Вязкость растворов полиэлектролитов
Особенности растворов полиэлектролитов хорошо прослеживаются при определении их вязкости. А. Зависимость вязкости от концентрации. В то время как приведенная вязкость «обычных» электронейтральных полимеров с увеличением концентрациирастет, для полиэлектролитов картина обратная – оназаметно падаетс увеличением концентрации (рис. 46):
Р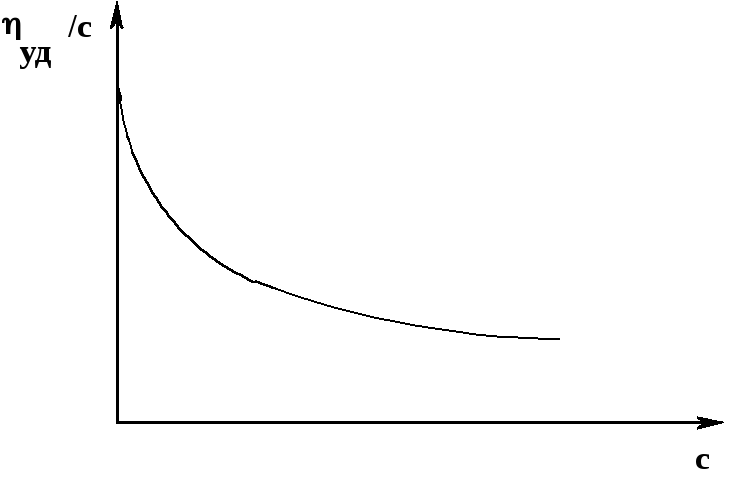 ис.
46. Зависимость приведенной вязкости от
концентрации раствора полиэлектролита.
ис.
46. Зависимость приведенной вязкости от
концентрации раствора полиэлектролита.
Это объясняется тем, что в разбавленных растворах взаимодействие полимерного иона с противоионами минимально, макромолекулы имеют вытянутые конформации, и приведенная вязкость велика; при увеличении концентрации противоионы приближаются к полиионам, макромолекулы сворачиваются, и приведенная вязкость уменьшается.
Б. Зависимость вязкости от рН. Вразбавленныхрастворах слабых поликислот (таких, например, как полиакриловая кислота) при добавлении основания (т.е. при увеличении рН) вязкость растет. Причина очевидна: при этом возрастает количество ионизированных групп (например, групп СОО‾) и вследствие отталкивания между ними макромолекулы приобретают вытянутые конформации. Для таких растворов очень резко выражена зависимость вязкости от молекулярной массы: коэффициентав уравнении Куна-Марка-Хаувинка имеет величину около 2, в то время как для недиссоциированной поликислотыa~0,5(стр. 157).
Наиболее характерную картину дает рассмотрение зависимости вязкости от рН для растворов полиамфолитов(белков) (рис. 47):
Р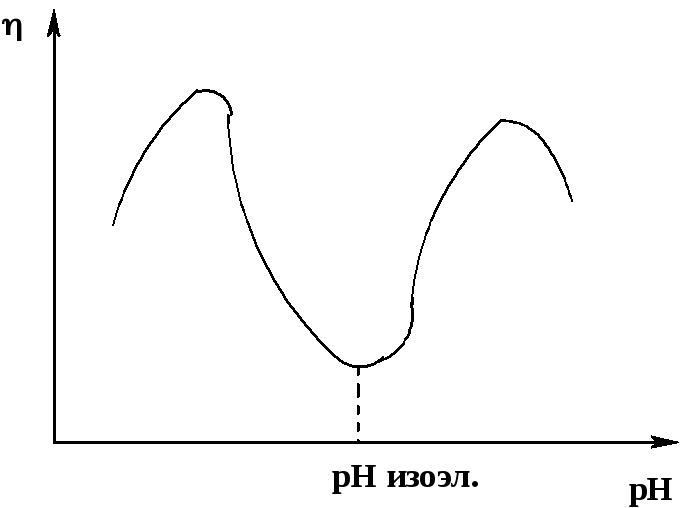 ис.
47. Зависимость вязкости раствора
полиамфолита от рН.
ис.
47. Зависимость вязкости раствора
полиамфолита от рН.
Минимальная вязкость раствора наблюдается в изоэлектрической точке(например, для раствора желатины при рН = 4,7); в этой точке число положительно и отрицательно заряженных групп минимально иодинаково, макромолекулы в сумме электронейтральны, поэтому разворачивания не происходит. При уменьшении рН (добавлении кислоты) происходит ионизация (протонирование) основных групп (например, аминогрупп лизина), положительные заряды доминируют, происходит отталкивание и «распрямление» макромолекул и увеличение вязкости. При увеличении рН (добавлении основания) ионизируются группы СООН, доминируют отрицательные заряды, что приводит к тем же последствиям. Как видно из графика, кривая имеет не только минимум, но и максимумы, т.е. вязкость после возрастания снова начинает падать. Это происходит потому, что при дальнейшем добавлении кислоты или основания увеличивается концентрация противоионов, и вследствие взаимодействия с ними макромолекулы частично сворачиваются.
Мембранное равновесие в растворах полиэлектролитов
Важное значение имеют системы, к которых раствор полиэлектролита и раствор низкомолекулярного электролита разделены полупроницаемой перегородкой (мембраной). Как частный случай таких систем можно рассматривать клеточные мембраны, разделяющие растворы полиэлектролитов (белков) внутри клетки и низкомолекулярных электролитов вне клетки (хотя, вообще говоря, процессы транспорта через биомембраны весьма многообразны). Через полупроницаемую перегородку могут проникать малыезаряженные частицы, но не могут проникать заряженныемакромолекулы.
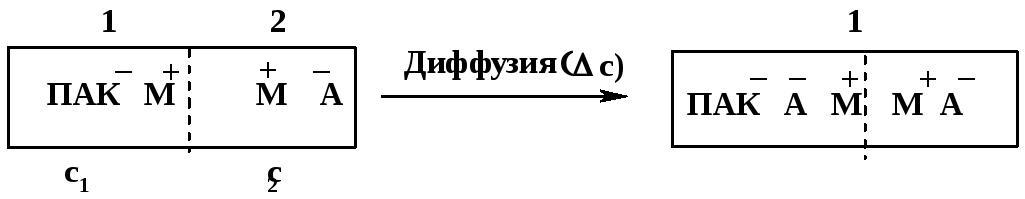 Рассмотрим в
качестве примера систему, в которой
соль полиакриловой кислоты [-CH2-CH(COO‾M+)-]n(обозначим ее ПАК‾ М+) отделена
мембраной от раствора низкомолекулярного
электролита (соли), обозначенной как М+А‾.Первоначальнуюконцентрацию
раствора полиэлектролита обозначим
как с1; первоначальную концентрацию
раствора соли – как с2. Через
мембрану могут проникать ионы М+ и
А‾, но не полиионы ПАК‾. Поэтому после
помещения растворов в отсеки, разделенные
мембраной, часть раствора соли
(концентрации Δс) диффундирует через
мембрану из отсека 2 в отсек 1 (рис. 48):
Рассмотрим в
качестве примера систему, в которой
соль полиакриловой кислоты [-CH2-CH(COO‾M+)-]n(обозначим ее ПАК‾ М+) отделена
мембраной от раствора низкомолекулярного
электролита (соли), обозначенной как М+А‾.Первоначальнуюконцентрацию
раствора полиэлектролита обозначим
как с1; первоначальную концентрацию
раствора соли – как с2. Через
мембрану могут проникать ионы М+ и
А‾, но не полиионы ПАК‾. Поэтому после
помещения растворов в отсеки, разделенные
мембраной, часть раствора соли
(концентрации Δс) диффундирует через
мембрану из отсека 2 в отсек 1 (рис. 48):
Рис. 48. Установление мембранного равновесия между растворами полиэлектролита и низкомолекулярного электролита.
Диффузия происходит до тех пор, пока не установится равновесие Доннана (мембранное равновесие). Согласно этому равновесию активности (а для разбавленных растворов –концентрации)низкомолекулярногоэлектролита по обе стороны мембраныодинаковы: [М+]1·[А‾]1= [М+]2·[А‾]2. К моменту достижения равновесия [M+]1=c1+ Δс; [A‾]1= Δс; [M+]2= [A‾]2=c2– Δс. Следовательно
(c1+ Δс)·Δс = (c2– Δс)2, отсюдаΔс = (с2)2/(с1 + 2с2)
Это уравнение позволяет прогнозировать степень диффузии (Δс) в зависимости от соотношения концентраций растворов полиэлектролита (с1) и низкомолекулярного электролита (с2) по разные стороны мембраны. В частности:
А. с1 >>c2; тогда Δс → 0, т.е. диффузия практически не происходит;
Б. с1<< c2; тогда Δс = с2/2;
В с1= с2; тогда Δс = с2/3
В случае клеточных мембран реализуется вариант А: концентрация полиэлектролитов (в основном, белков) внутри клетки намного выше концентрации низкомолекулярных электролитов вне клетки. Поэтому «внешние» ионы диффундируют внутрь клетки в малой степени, что позволяет поддерживать солевой состав клетки на практически постоянном уровне. Еще раз напомним, что это касается диффузии, т.е. пассивноготранспорта через биомембраны; кроме этого, весьма важную роль играют процессыактивного(против градиента концентрации) транспорта (например, действиеNa+,K+АТФ – азы).
Резюме
Полимеры, как и низкомолекулярные вещества, могут образовывать истинные растворы (наряду с коллоидными растворами и гелями).
Процессу растворения полимера предшествует набухание, которое сначала не затрагивает надмолекулярных структур (межструктурное набухание), а затем разрыхляет надмолекулярные структуры (внутриструктурное набухание). Процесс может ограничиться набуханием, если растворитель «плохой» (ограниченное набухание). Пространственные полимеры не могут растворяться и способны лишь к ограниченному набуханию. Образование истинных растворов полимеров может быть экзотермическим, атермическим и эндотермическим, но возможно только при уменьшении энергии Гиббса. Растворимость полимеров зависит от природы полимера и растворителя, молекулярной массы полимера, его фазового состояния и от температуры. Форма макромолекул в растворах зависит от взаимодействия полимера с растворителем и может быть клубкообразной или глобулярной.
Вязкость даже разбавленных растворов полимеров заметно превосходит вязкость растворов низкомолекулярных соединений и увеличивается с ростом молекулярной массы полимера. полимерные растворы могут быть как ньютоновскими жидкостями, так и менять вязкость в процессе течения. Для растворов полиэлектролитов характерны «обратная» зависимость вязкости от концентрации раствора, а также весьма значительные изменения вязкости при изменении рН.
Свойства растворов полимеров используется для определения их молекулярных масс и для фракционирования полидисперсных полимеров.
