
- •Высокоэластическое состояние полимеров
- •Вязко-текучее (пластическое) состояние полимеров
- •Кристаллические полимеры
- •Кристаллизация полимеров и их кристаллическая структура.
- •Свойства кристаллических полимеров
- •Системы полимер - низкомолекулярная жидкость. Истинные растворы полимеров
- •Истинные растворы высокомолекулярных соединений
- •Образование истинных растворов полимеров.
- •Свойства растворов полимеров а. Разбавленные растворы
- •Б. Концентрированные растворы
- •В.Растворы полиэлектролитов
Образование истинных растворов полимеров.
Двухстадийный характер растворения ВМС. Набухание и растворение. При контакте полимера в конденсированной фазе и низкомолекулярной жидкости начинается взаимное проникновение молекул полимера и жидкости. Поскольку подвижность малых молекул жидкости намного выше подвижности макромолекул полимера, вначале происходит одностороннее проникновение молекул растворителя в полимерную фазу. Происходит поглощение (сорбция) низкомолекулярной жидкости полимером; этот процесс называют набуханием. Молекулы жидкости вначале проникают между агрегатами макромолекул (надмолекулярными структурами); это – межструктурное набухание; далее они могут проникать внутрь этих структур, раздвигая макромолекулы; это – внутриструктурное набухание. В процессе набухания увеличивается объем полимера, его структура становится более рыхлой. Набухание – это своеобразное «зеркальное» растворение, при котором растворителем является полимер, а растворенным веществом – низкомолекулярная жидкость. Набухание – достаточно универсальный процесс: оно в той или иной степени происходит при контакте полимера с самыми различными жидкостями, в том числе и с теми, которые имеют малое сродство к полимеру; в этом последнем случае набухание будет, разумеется, происходить в меньшей степени. Набухание происходит и при контакте полимера с парами растворителей.
Далее возможны два варианта: 1. Макромолекулы полимера постепенно начинают проникать в фазу растворителя, отделяясь друг от друга; этому способствует то, что при набухании молекулы полимера раздвигаются, и силы взаимодействия между макромолекулами ослабевают. Происходит постепенное растворение полимера (вторая стадия процесса растворения). Таким образом, в этом случае набухание постепенно переходит в растворение; такое набухание называют неограниченным. 2. Макромолекулы полимера не отделяются друг от друга, процесс ограничивается набуханием; такое набухание называют ограниченным. Ограниченное набухание может быть обусловлено: А. Малым сродством растворителя и полимера («плохой» растворитель); в этом случае остается возможность все же добиться растворения при изменении условий (например, температуры). Б. Сшитым (сетчатым) строением полимера; разумеется, полимерные цепи, сшитые ковалентными связями, не могут отделяться друг от друга. Сшитые (пространственные) полимеры не могут растворяться. Набухание же таких полимеров происходит, т.к. молекулы растворителя проникают между сшивками и раздвигают участки цепей.
Способность полимеров к ограниченному набуханию оценивается по степени набухания – отношению количества поглощенной жидкости к единице массы или объёма полимера. Например, весовая степень набухания () определяется по формуле:
![]() где
m
– масса набухшего полимера; m0
– масса полимера до набухания.
где
m
– масса набухшего полимера; m0
– масса полимера до набухания.
![]() Аналогично
можно определить объёмную степень
набухания:
Аналогично
можно определить объёмную степень
набухания:
где V – объём набухшего полимера; V0 – объём полимера до набухания.
Поскольку набухание происходит постепенно, наиболее корректно пользоваться максимальной (равновесной) степенью набухания, когда количество поглощенного растворителя уже не зависит от времени его контакта с полимером.
Как набухание, так и последующее растворение – достаточно медленные процессы, значительно более медленные, чем процессы растворения низкомолекулярных соединений.
Термодинамика растворения полимеров.
Возможность или невозможность растворения любых веществ – и низкомолекулярных и полимеров – в первую очередь определяется термодинамическим критерием. Истинный раствор может самопроизвольно образоваться только в том случае, если при этом уменьшается энергия Гиббса:
ΔG= ΔH–TΔS< 0
Растворение в большинстве случаев сопровождается увеличением энтропии; это связано с тем, что частицы растворенного вещества гораздо более подвижны, чем в конденсированной фазе и, следовательно, имеют больше степеней свободы. При так называемом идеальном смешении изменение энтропии подчиняется уравнению
ΔS = - RlnN
где N – молярная доля растворенного вещества.
Для растворов полимеров выигрыш в энтропии обычно выше, чем при идеальном смешении, т.к. при растворении становятся подвижными сегменты и, следовательно, увеличивается число частиц, способных к самостоятельному перемещению. Особенно это ощутимо для полимеров с гибкими макромолекулами, где число сегментов велико.
Таким образом, энтропийный фактор, как правило, благоприятствует растворению. Встречаются, однако, и иные случаи, когда в растворах образуются высокоупорядоченные ансамбли молекул растворителя вокруг растворенных части; в этом случае выигрыш в энтропии падает, и может произойти даже уменьшение энтропии (см. гидрофобные взаимодействия в полипептидах, стр. 104).
Что же касается изменения энтальпии, то оно определяется, прежде всего, соотношением сил взаимодействия: а) между молекулами полимера в конденсированной фазе и б) между молекулами полимера и молекулами растворителя. Здесь возможны все варианты: 1) ΔН < 0 [a) < б)]; в этом случае растворение экзотермическое. 2) ΔН = 0 [a) = б)] – атермическое растворение. 3) ΔН > 0 [a) > б)] – эндотермическое растворение.
При экзотермическом растворении оба фактора – и энтропийный и энтальпийный – благоприятствуют растворению, поэтому полимер растворяется неограниченно (если он, конечно, не сшитый). При атермическом растворении также, как правило, растворение не встречает затруднений – за счет благоприятного энтропийного фактора. Если же растворение эндотермическое, то все решает соотношение энтальпийного и энтропийного факторов; растворение происходит только при |TΔS| > |ΔH|. В связи с этим возникает необходимость оценить изменение энтальпии при эндотермическом растворении.
При эндотермическом смешении малополярных веществ, когда нет заметных электростатических взаимодействий и не образуются водородные связи, растворение обусловлено только силами Ван-дер-Ваальса. В этом случае энтальпия смешения напрямую связана с энергиями испарения компонентов и подчиняется уравнению Гильдебрандта-Скотта:
ΔHc = Vc[(ΔE1/V1)0,5 – (ΔE2/V2)0,5]2 φ1∙ φ2
где Нс - теплота смешения; Vc – суммарный объем обоих компонентов;
Е1 и Е2 – энергии испарения каждого из компонентов; V1 и V2 – мольные объёмы каждого из компонентов; φ1и φ2 – объемные доли каждого из компонентов.
Член данного уравнения ΔEi/Vi - энергия, необходимая для испарения единицы объёма соответствующего компонента; эта величина называется плотностью энергии когезии (ПЭК), т.к. испарение – преодоление сил когезии, удерживающих молекулы вместе.
Величину, равную корню квадратному из ПЭК называют параметром растворимости (δ):
(ΔEi/Vi)0,5 = (ПЭКi) 0,5 = δi
При этом уравнение Гильдебрандта-Скотта приобретает вид:
ΔHc = Vc (δ1 – δ2)2 φ1∙ φ2
Из уравнения ясно видно, что чем больше разница между параметрами растворимости компонентов, чем выше положительная (т.е. неблагоприятная) энтальпия смешения. Отсюда: при эндотермическом смешении шансы на растворение имеют те системы, для которых параметры растворимости близки по величине.
Данное уравнение применимо к растворению малополярных полимеров в малополярных растворителях (индексы 1 и 2 можно произвольно приписать полимеру или растворителю). Следовательно, эндотермическое растворение возможно для систем, у которых параметры растворимости полимера и растворителя близки по величине. Разумеется, параметр растворимости полимера напрямую определить нельзя (энергию испарения полимера нельзя определить, поскольку полимер не испаряется); однако, существуют косвенные методы, позволяющие все-таки определить этот параметр.
При растворении полярных полимеров столь простой подход уже невозможен, т.к. сильные взаимодействия (диполь-дипольные, водородные связи) полимер-полимер и полимер-растворитель вносят весьма существенный, если не определяющий, вклад в растворимость. Следует также отметить, что и для неполярных полимеров использование параметров растворимости применимо только к аморфной, но не к кристаллической фазе.
Эндотермическое растворение, в отличие от экзотермического, часто бывает ограниченным: после достижения равенства |TΔS| = |ΔH| наступает равновесие, и растворение прекращается.
Ограниченная и неограниченная растворимость. Фазовые диаграммы систем полимер-растворитель.
Как следует из рассмотренного выше, в зависимости от соотношения энтальпийного и энтропийного факторов, растворимость может быть как неограниченной, так и ограниченной. В первом случае система однофазна, во втором - двухфазна: она включает фазу раствора и фазу набухшего полимера. При изменении температуры меняется соотношение энтальпийного и энтропийного факторов (т.к. меняется TΔS); при этом меняется соотношение фаз и, наконец, ограниченная растворимость может переходить в неограниченную. Все эти моменты хорошо прослеживаются при построении фазовых диаграмм (диаграмм состояния, диаграмм фазового равновесия). Такие диаграммы корректны для равновесных систем, а именно равновесные системы, в конечном счете, и образуются при образовании истинных растворов полимеров. Наиболее характерные фазовые диаграммы систем полимер- растворитель приведены на рис. 39:
Р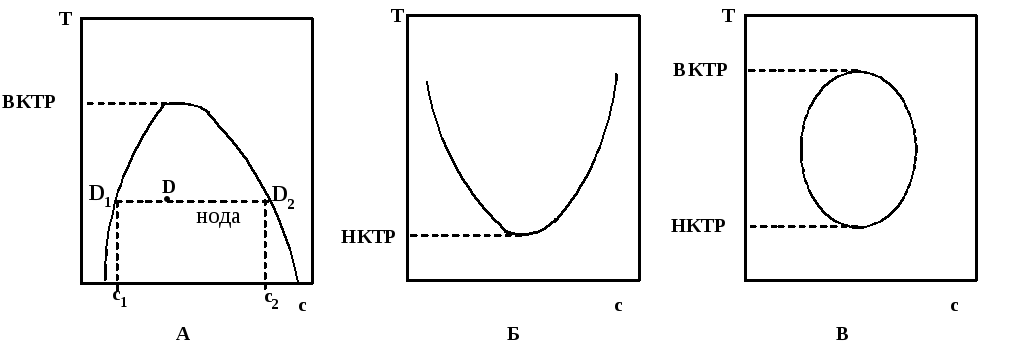 ис.
39. Фазовые диаграммы систем
полимер-растворитель (с – содержание
полимера в фазе)
ис.
39. Фазовые диаграммы систем
полимер-растворитель (с – содержание
полимера в фазе)
На каждой из диаграмм кривая разграничивает области одно- и двухфазных составов; эта кривая называется бинодалью. Область внутри бинодали соответствует двухфазной системе, область вне бинодали – однофазной. Любой точке внутри бинодали отвечают две фазы; их состав определяется точками пересечения бинодали с прямой (нодой), проходящей через эту точку и параллельной оси абсцисс. Например, на рис. 39 А точке D отвечает двухфазная система: одна фаза – раствор полимера; его концентрация (с1) отвечает точке пересечения бинодали с нодой (D1); вторая фаза – набухший полимер; здесь концентрация полимера (с2) отвечает другой точке пересечения (D2).
Наиболее распространенный вариант приведен на рис. 39 А; здесь растворимость полимера увеличивается с ростом температуры. По мере увеличения температуры состав фаз сближается и, наконец, при определенной температуре система становится однофазной – весь полимер растворяется. Эта температура называется верхней критической температурой растворения (ВКТР). Это как раз тот случай, когда ΔH > 0 и ΔS > 0; пример – система ацетилцеллюлоза – хлороформ.
Менее распространен вариант, представленный на рис. 39 Б; здесь растворимость полимера уменьшается с ростом температуры, поэтому двухфазный раствор становится однофазным при охлаждении; температура, при которой это происходит называется нижней критической температурой растворения (НКТР). Этот вариант характерен для систем, для которых происходит заметная ассоциация между молекулами растворителя и полимера, например, образование водородных связей (ΔH < 0); при нагревании эти связи разрушаются, что неблагоприятно сказывается на энтальпийном факторе. Пример – система нитроцеллюлоза – этанол.
Наконец, возможен и вариант, когда имеются и ВКТР и НКТР (рис. 39 В); здесь при нагревании однофазная система вначале расслаивается (выше НКТР и ниже ВКТР), а потом снова становится однофазной (при ВКТР). Расслаивание происходит из-за разрыва водородных связей и ухудшения энтальпийного фактора, а дальнейшее полное смешение – за счет роста энтропийного фактора при повышении температуры. Пример – система полипропиленоксид – вода.
Кроме термодинамических факторов, немалую роль играют и кинетические: как уже отмечалось, растворение полимеров – медленный процесс, и в ряде случаев он может быть очень медленным.
Зависимость растворения и набухания полимеров от различных факторов. «Хорошие» и «плохие» растворители.
Взаимоотношения полимера и растворителя зависят от целого ряда факторов: 1. От химического строения полимера и растворителя; 2. От молекулярной массы полимера; 3. От плотности упаковки макромолекул полимера, в частности от степени развития надмолекулярных структур и степени их организации; 4. От гибкости (жесткости) макромолекулярных цепей; 5. От температуры. Различные комбинации этих факторов могут приводить к широкому спектру результатов – от почти неограниченного растворения до весьма ограниченного набухания.
Первый фактор – соотношение химического строения полимера и растворителя – имеет чрезвычайно важное значение. Здесь в первом приближении можно руководствоваться старинным наблюдением: «подобное растворяется в подобном»; согласно этому принципу хорошо совместимы вещества близкие по химическому строению. В частности, хорошими растворителями для гомополимеров на основе винильных мономеров являются гидрированные мономеры, например, этилбензол СН3СН2С6Н5 - для полистирола [-CH2-CH(C6Н5)-]n. Для таких неполярных систем параметры растворимости полимера и гидрированного мономера близки. Обычно неполярные полимеры лучше растворяются в неполярных растворителях и хуже – в полярных; для полярных полимеров картина обратная. Например, неполярные полимеры - полибутадиен или полиизопрен (натуральный каучук) – растворимы в бензине (смесь углеводородов) и не растворимы в ацетоне и тем более в спиртах или воде. Напротив, полиакрилонитрил нерастворим в углеводородах, но растворим в диметилформамиде; поливиниловый спирт хорошо растворим в воде. В случае сополимеров результат определяется не только природой звеньев и их количеством, но и типом сополимера.
2. Молекулярная масса полимера. Повышение молекулярной массы уменьшает растворимость (при прочих равных условиях). В основном, это связано с кинетическими факторами: более крупные макромолекулы переходят в раствор медленнее. Если растворение экзотермическое, то, в конце концов, после длительной экспозиции, переходят в раствор и очень большие макромолекулы. Если же растворение эндотермическое, то растворение часто ограничено (см. выше). В этих случаях при растворении полидисперсных полимеров в точке равновесия возникает двухфазная система: 1) раствор («золь»), в котором находятся меньшие по размеру макромолекулы, которые успели перейти в раствор и 2) набухший полимер («гель»), содержащий бòльшие по размеру макромолекулы, которые перейти в раствор не успели. Такие двухфазные системы называют «гель-золь» системами; они находятся внутри бинодали (рис. 39). Добавляя в такую систему «хороший» растворитель, можно добиться растворения всего полимера, добавляя «плохой» - осаждения растворенной части полимера. Это используется для разделения полидисперсных полимеров на фракции с меньшей степенью полидисперсности (фракционирования полимеров).
Но, в общем, для полимеров с чрезмерно высокой молекулярной массой возникают проблемы с растворением, а значит и с практическим использованием (клеи, покрытия, волокна)
3. Высокая плотность упаковки макромолекул, наличие высокоразвитых надмолекулярных структур в значительной степени препятствует растворению; это неблагоприятно сказывается на энтальпии растворения и на его скорости; контакт с растворителем может ограничиться межструктурным набуханием. В еще большей степени это относится к кристаллическим полимерам: кристаллическая фаза имеет весьма малую энтальпию, что делает растворение сильно эндотермическим. Кристаллические полимеры, как правило, ниже температуры плавления не растворяются в большинстве растворителей. Примером может служить исключительно трудная растворимость целлюлозы даже в «подобных» полярных протонных растворителях. Растворимость целлюлозы можно повысить, обрабатывая ее водным раствором медь-аммиачного комплекса; объёмные катионы [Cu(NH3)4]++ внедряются между параллельно ориентированными макромолекулами, образуя комплексы; при этом разрушаются кристаллические области (вместо аммиака можно использовать некоторые амины).
4. Полимеры с гибкими макромолекулами растворяются, как правило, лучше жесткоцепных; во-первых, потому, что силы межмолекулярного взаимодействия в гибкоцепных макромолекулах меньше, а во-вторых, потому, что при растворении гибкоцепных макромолекул энтропия увеличивается в значительно большей степени, чем для жесткоцепных; при растворении последних энтропия может и не увеличиться.
5. Зависимость растворимости полимеров от температуры неоднозначна, как и при растворении низкомолекулярных соединений: возможно и повышение и уменьшение растворимости с ростом температуры; все же в большинстве случаев при увеличении температуры растворимость полимеров растет.
Фракционирование полимеров.
Как уже неоднократно упоминалось, абсолютное большинство синтетических полимеров полидисперсно. При этом чем выше степень полидисперсности, тем более «расплывчаты» их свойства. Часто возникает необходимость разделения полимера с высокой степенью полидисперсности на несколько фракций, каждая из которых имеет меньшую степень полидисперсности. Такое разделение называют фракционированием. Естественно, фракции различаются по средним молекулярным массам – от самой «низкомолекулярной» до самой «высокомолекулярной». Существует несколько способов фракционирования и почти все они (кроме гель-хроматографии) основаны на разной растворимости полимеров с разными молекулярными массами. Здесь будут коротко рассмотрены все важнейшие способы фракционирования полимеров (включая и гель-хроматографию).
1. Дробное осаждение. Суть метода: к раствору исходного полидисперсного полимера в не очень хорошем растворителе последовательно добавляют осадитель (жидкость, в которой полимер нерастворим). [Если исходный растворитель просто хороший, то придется добавлять слишком много осадителя]. После добавления первой (обычно небольшой) порции осадителя выпадает наиболее высокомолекулярная фракция. Эту фракцию отделяют и добавляют новую порцию осадителя, высаждая фракцию с меньшей средней молекулярной массой. Повторяя операцию n раз, получаем n фракций с уменьшающейся молекулярной массой; самую низкомолекулярную фракцию получают, полностью упаривая растворитель. Дробное осаждение следует проводить при постоянной температуре (термостат), т.к. растворимость полимеров сильно зависит от температуры.
2. Дробное растворение (экстракция). Эта операция в известной степени обратна предыдущей. Твердый исходный полидисперсный полимер последовательно обрабатывают смесями растворителя и осадителя с возрастающей долей растворителя. Смесь с наибольшим содержанием осадителя обладает наименьшей растворяющей способностью и растворяет самую низкомолекулярную фракцию. По мере увеличения доли растворителя растворяются все более высокомолекулярные фракции. Разумеется, обработку каждой смесью следует проводить достаточно длительное время, т.к. растворение полимеров – медленный процесс. Как и в предыдущем случае, температура должна быть постоянной.
3. Изменение температуры растворения. В этом варианте повышают или понижают температуру раствора исходного полимера или растворения твердого полимера. Если растворимость растет с увеличением температуры, то при наиболее низкой температуре в растворе остаются (или в раствор переходят) самые низкомолекулярные фракции, при более высокой - –более высокомолекулярные и т.д. Если растворимость понижается с ростом температуры (такие варианты встречаются, см. ниже), то картина обратная.
4. Гель-проникающая хроматография. Этот метод более быстрый, чем предыдущие, и не менее эффективный. Этот метод, в отличие от предыдущих, не основан на зависимости растворимости от молекулярной массы полимера, но и здесь используются растворы полимеров.
Хроматографическая колонка заполняется специальным пористым носителем – «гелем»; этот материал состоит из малых (~100 мкм) сферических частиц, каждая из которых содержит множество микропор (в зависимости от природы геля размер микропор меняется в диапазоне 5-100 нм). В качестве гелей используют сшитый сополимер стирола с дивинилбензолом, а для разделения биополимеров – сшитый полимер углеводной природы – сефадекс. Колонку наполняют растворителем, при этом растворитель заполняет не только пространство между частицами, но и поры внутри частиц.
В верхнюю часть колонки помещают разбавленный раствор полидисперсного полимера (или смеси монодисперсных полимеров при разделении белков) и начинают элюировать растворителем. При движении раствора сверху вниз макромолекулы меньшего размера диффундируют в поры (просто по градиенту концентрации, поскольку в порах – чистый растворитель). При этом чем меньше частицы, тем быстрее они диффундируют и тем глубже проникают в поры. Крупные макромолекулы не помещаются в поры; они проходят между частицами геля и вымываются из колонки в первую очередь. Объём растворителя, который элюирует эту высокомолекулярную фракцию, равен суммарному объёму пустот между частицами.
После выхода высокомолекулярной фракции элюирование продолжают. Теперь при прохождении чистого растворителя через колонку в него диффундируют макромолекулы из пор (опять же по градиенту концентрации). При этом вначале диффундируют более крупные молекулы, расположенные наименее «глубоко» в порах, а затем – более мелкие. Таким образом, каждая последующая фракция имеет меньшую молекулярную массу. Элюирование заканчивается, когда общий объём элюэнта равен сумме объёмов пор и пространства между частицами.
