
- •Высокоэластическое состояние полимеров
- •Вязко-текучее (пластическое) состояние полимеров
- •Кристаллические полимеры
- •Кристаллизация полимеров и их кристаллическая структура.
- •Свойства кристаллических полимеров
- •Системы полимер - низкомолекулярная жидкость. Истинные растворы полимеров
- •Истинные растворы высокомолекулярных соединений
- •Образование истинных растворов полимеров.
- •Свойства растворов полимеров а. Разбавленные растворы
- •Б. Концентрированные растворы
- •В.Растворы полиэлектролитов
Свойства растворов полимеров а. Разбавленные растворы
Осмотическое давление растворов полимеров. Вириальные коэффициенты и -условия.
Осмотическое давление характеризует с одной стороны число растворенных частиц, а с другой – степень взаимодействия частиц растворителя и растворенного вещества.
В идеальном растворе взаимодействие между частицами растворителя и растворенного вещества такое же, как и между частицами растворенного вещества; растворитель в этом случае не «хороший» и не «плохой», а «идеальный». Осмотическое давление идеального раствора подчиняется уравнению:
π = сRT или π/с = RT
где с – концентрация раствора
Растворы полимеров в большинстве случаев не являются идеальными, и их осмотическое давление подчиняется иному уравнению, в котором концентрационная зависимость разложена в ряд Тейлора:
π = RT (A1c + A2c2 + A3c3 + ···)
Для разбавленных растворов полимеров (обычно 0.5 – 1%) величина с мала и можно ограничиться первыми двумя членами ряда:
π/с = RT(A1 + A2c)
Коэффициенты А1 и А2 называют вириальными коэффициентами; А1 – первый, А2 – второй.
Наиболее важным из них является второй вириальный коэффициент А2; именно он определяет характер раствора. Если А2 = 0, то π/с = RTA1, т.е. раствор является идеальным. При А2 > 0 осмотическое давление растет быстрее, чем концентрация – растворитель «хороший»; при А2 < 0 - «плохой» (рис. 40):
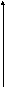
π/с
 А2
> 0
А2
> 0
2
1

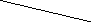 A2
= 0
A2
= 0
3
A2 < 0
 с
с
Рис. 40. Зависимость осмотического давления раствора полимера от концентрации (1 – «идеальный» растворитель, 2 – «хороший», 3 – «плохой»)
Второй вириальный коэффициент А2 зависит от температуры. Во многих случаях при определенной температуре он становится равным нулю, т.е. раствор становится идеальным. Эта температура носит название θ-температуры. Для разных растворителей эта температура, естественно, разная. Растворитель, для которого достигается θ-температура, называется θ-растворителем; соответственно условия, при которых раствор становится идеальным (растворитель, температура) называют θ-условиями. Эти условия можно создавать, не только меняя температуру растворителя, но и меняя соотношение «плохого» и «хорошего» растворителей при постоянной температуре. Именно в θ-условиях исследуют характеристики растворенных макромолекул полимера, т.к. именно в этих условиях можно не учитывать взаимодействие полимер-растворитель. θ-Условия – та граница, при переходе через которую меняются формы макромолекул в растворе (см. ниже).
Формы макромолекул в растворах. Переходы клубок-глобула.
Разбавленные растворы полимеров являются наиболее удобной системой для изучения пространственной организации макромолекул, поскольку в них макромолекулу можно считать изолированной от других макромолекул (разумеется, с известной степенью приближения). В этом случае форма макромолекулы будут определяться с одной стороны силами внутримолекулярного взаимодействия в макромолекуле, а с другой – температурой и взаимодействием полимера с растворителем.
Возьмем более простой случай, когда между звеньями цепи нет специфических достаточно сильных взаимодействий (водородных связей, ионных связей); тогда внутримолекулярное взаимодействие сводится к «объёмному взаимодействию», которое происходит при сближении не соседних звеньев. Это взаимодействие может быть притяжением или отталкиванием. Энергия взаимодействия звеньев (U) при их сближении зависит от расстояния между ними (r) и может быть выражена графиком (рис. 41):
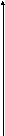
 U
U
r0 r


 U0
U0
Рис 41. Зависимость энергии взаимодействия между звеньями макромолекулы от расстояния между ними.
При очень малых величинах r наблюдается сильное отталкивание (U0), поскольку каждое звено имеет собственный объём и это пространство исключено для нахождения других звеньев (исключенный объём). При несколько больших расстояниях наблюдается притяжение (U < 0); притяжение максимально (U0) при расстоянии r0 – это расстояние того же порядка, что и размер звена, т.е. около 1 нм.
Если энергия притяжения больше энергии теплового движения (U0>kT), то доминирует притяжение; макромолекула при этом сжимается по сравнению с размерами идеального клубка (т.е. формы, которая определяется только энтропией). В альтернативном случае, при U0<kT притяжение звеньев не играет главной роли; доминирует отталкивание на малых расстояниях, и макромолекулярный клубок увеличивается в размерах (разбухает).
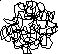
В разбавленных растворах полимеров форма макромолекул определяется характером взаимодействия полимер- растворитель. Если растворитель «хороший» (А2 > 0), то силы взаимодействия полимер-растворитель больше, чем силы внутримолекулярного взаимодействия в полимере; поэтому взаимное притяжение звеньев не играет существенной роли, и макромолекула имеет форму рыхлого «клубка»; для гибких макромолекул это «энтропийный» статистический клубок (рис. 42 А). Если растворитель «плохой» (А2 < 0), то доминируют внутримолекулярные силы, т.е. притяжение, и макромолекула сжимается (схлопывается) в более плотное образование – глобулу (рис. 42 Б):

А Б
Рис. 42. Макромолекула полимера в конформациях клубка (А) и глобулы (Б)
Естественно, взаимный переход между этими конформациями происходит в θ-условиях (А2 = 0). Переход клубок <=> глобула происходит достаточно резко и напоминает фазовый переход (испарение – конденсация). Такие переходы исследовались на ряде примеров, например, для растворов полиакриламида в смеси ацетон-вода. При избытке «плохого» растворителя (ацетона) макромолекулы полимера имеют форму глобулы, при добавлении «хорошего» (воды) после прохождения через θ-условия макромолекулы разворачиваются в клубки.
Как было указано выше, все эти соображения справедливы прежде всего для относительно гибких макромолекул, где отсутствуют сильные специфические взаимодействия типа водородных связей. Однако нечто подобное можно наблюдать и для жестких макромолекул. Наиболее характерный случай - денатурация и ренатурация глобулярных белков. Действительно, в определенных условиях (в том числе и при смене растворителя) плотные глобулы белков разворачиваются, переходя в более рыхлые формы (денатурация); при воссоздании исходных условий во многих случаях происходит сворачивание этих образований обратно в глобулярную форму (ренатурация). Тем не менее, имеется заметное отличие этих переходов от переходов для гибких макромолекул. Переходы клубок-глобула для гибких макромолекул идут по закону случая: клубки имеют случайную форму, определяемую, в основном, энтропией; при коллапсе они сворачиваются в глобулы случайным образом. Напротив, при денатурации белков, образуются рыхлые образования, имеющие не столько случайную форму, сколько сохраняющие «память» о тех глобулах, из которых они образовались. Для этих образований используют термин «расплавленная глобула». При ренатурации сворачивание в глобулы идет отнюдь не случайным образом: образуются глобулы, идентичные исходным, т.е. расплавленные глобулы «вспоминают» форму исходных глобул. Разумеется, все это возможно только для «жестких» монодисперсных полимеров с четко заданной первичной структурой.
Вязкость растворов полимеров
Вязкость растворов полимеров на много порядков превосходит вязкость растворов низкомолекулярных соединений; это относится даже к сильно разбавленным растворам (менее 1%). Это связано с большими размерами макромолекул, перемещение которых в растворе идет намного труднее, чем «обычных» малых молекул. Для растворов полимеров определяют относительную вязкость
ηотн = η/η0, где η – вязкость раствора, η0 – вязкость растворителя; удельную вязкость ηуд = (η - η0)/η0 = ηотн –1; приведенную вязкость ηпр = ηуд/с и характеристическую вязкость [η] = (ηпр)с→0 (вычисляемую экстраполяцией).
Вязкость разбавленных растворов полимеров зависит от молекулярной массы полимера, от формы макромолекул в растворе, а также от возможности свободного проникновения растворителя внутрь полимерного кубка («протекаемости» полимерного клубка).
Зависимость характеристической вязкости от молекулярной массы выражается уравнением Куна-Марка-Хаувинка:
[η] = КМа
где К и а – коэффициенты.
Коэффициент К зависит от природы растворителя, полимера и температуры; коэффициент а определяется прежде всего конформациями макромолекул в растворе; величина этого коэффициента приближенно может служить мерой свернутости макромолекул. Для гибких макромолекул величина коэффициента а обычно имеет величину 0,5 – 0,8; для жестких сферических частиц глобулярных белков она близка к нулю; для сферических, но более рыхлых дендримеров (стр. 64) а ~ 0,1; напротив, для жесткоцепных полимеров, у которых макромолекулы находятся в вытянутых конформациях, величина а приближается к 2.
Что касается «протекаемости», то здесь возможны два варианта: 1) «Свободно протекаемый» клубок; молекулы растворителя свободно проникают в макромолекулярный клубок и выходят из него. В процессе течения макромолекулы полимера не увлекают за собой молекулы растворителя. Такие растворы представляют собой ньютоновские жидкости (их вязкость не меняется в процессе течения). 2) «Непротекаемый клубок»; молекулы растворителя не проникают внутрь клубка, поэтому клубок вместе с удерживаемым внутри него растворителем перемещается как единое целое. Если допустить, что между собой эти клубки не взаимодействуют, то к таким растворам можно применить уравнение Эйнштейна для вязкости суспензий. сферических частиц:
ηуд = 1 + 2,5φ
где φ – объёмная доля растворенного вещества.
В ходе течения «непротекаемых клубков» происходит трение между этим клубками и окружающим их растворителем, и клубки вовлекают в движение молекулы растворителя; при этом вязкость возрастает. С увеличением скорости течения клубки могут разворачиваться, что уменьшает силу их трения с молекулами растворителя и снижает вязкость, Таким образом, эти растворы не являются ньютоновскими жидкостями.
Вариант «непротекаемых клубков» считается более распространенным; именно для них коэффициент а в уравнении Куна-Марка-Хаувинка имеет порядок 0,5; для «свободно протекаемых» клубков а ~ 1.
Определение молекулярных масс полимеров
с использованием свойств их растворов
Определение молекулярных масс полимеров – весьма важная и в теоретическом и в прикладном отношении задача. Как уже упоминалось, большинство полимеров (кроме белков, нуклеиновых кислот и дендримеров) полидисперсны; молекулярная масса является средней величиной. При этом можно выбрать разные критерии усреднения и в зависимости от этого получить разные по значению средние величины; иными словами, для полидисперсных полимеров можно получить более одного значения молекулярной массы, и все они будут корректными. Наиболее характерны два варианта усреднения: по числу макромолекул и по их массе. В первом случае получают значение среднечисловой молекулярной массы; она определяется по формуле:
г![]() деNi
– число макромолекул с молекулярной
массой mi
деNi
– число макромолекул с молекулярной
массой mi
Во втором случае получают среднемассовую (иногда можно встретить старый термин «средневесовую») молекулярную массу; она определяется по формуле:
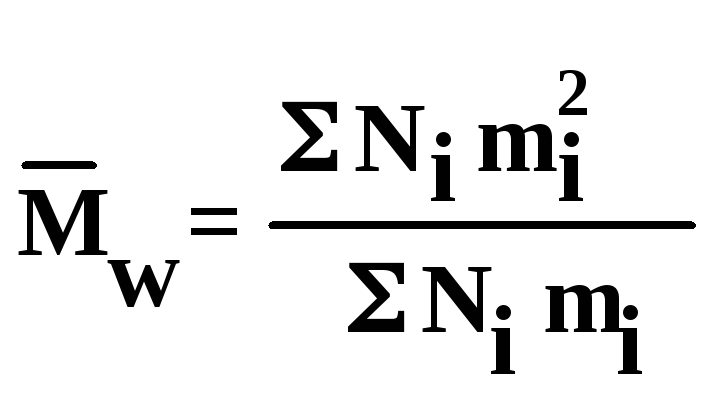 Среднемассовая
молекулярная масса больше
среднечисловой;
это понятно, т.к. «тяжелые» частицы
вносят больший вклад в среднемассовое
значение, чем «легкие» [достаточно
вспомнить численное и массовое
распределение по Флори(стр. 74-76, рис.7-8)].
Разница между этими массами тем больше,
чем больше степень полидисперсности
полимера.
Среднемассовая
молекулярная масса больше
среднечисловой;
это понятно, т.к. «тяжелые» частицы
вносят больший вклад в среднемассовое
значение, чем «легкие» [достаточно
вспомнить численное и массовое
распределение по Флори(стр. 74-76, рис.7-8)].
Разница между этими массами тем больше,
чем больше степень полидисперсности
полимера.
Кроме этого, проводят усреднение по гидродинамическим параметрам макромолекул и получают средневязкостную (средневискозиметрическую) молекулярную массу (гидродинамические свойства растворенных частиц определяют вязкость растворов). Усреднять можно и по седиментационным свойствам растворов и получать среднеседиментационную молекулярную массу. Значения обеих этих величин заметно ближе к среднемассовой, чем к среднечисловой молекулярной массе.
Для полимеров, в основном, неприменимо большинство обычных методов определения молекулярных масс низкомолекулярных соединений – как классических (химические методы, криоскопия), так и современных (масс-спектрометрия); в особенности это касается полидисперсных полимеров с достаточно высокими молекулярными массами. Для определения молекулярных масс полимеров, как правило, используют измерение определенных параметров их растворов.
1. Определение по осмотическому давлению растворов. Для разбавленных растворов осмотическое давление связано с молекулярной массой соотношением: (π/с)с→0 = (1/Мn)RT (c- концентрация). Молекулярная масса здесь среднечисловая, т.к. осмотическое давление зависит от числа растворенных частиц.
Осмотическое давление определяют в осмометрах – приборах, состоящих из двух отсеков, разделенных мембраной, проницаемой для молекул растворителя, но непроницаемой для макромолекул полимера. В один отсек помещают разбавленный раствор полимера, в другой – чистый растворитель. В процессе осмоса чистый растворитель проникает через мембрану в раствор, что повышает его уровень; это повышение точно измеряют тем или иным способом (в про- стейшем случае – в капилляре, присоединенном к отсеку с раствором). Измерив осмотической давление нескольких разбавленных, в том числе очень разбавленных, растворов, строят график зависимости π/с от с и экстраполируют эту зависимость на с = 0 (рис. 43); на оси ординат отсекается отрезок, соответствующий отношению RT/M:
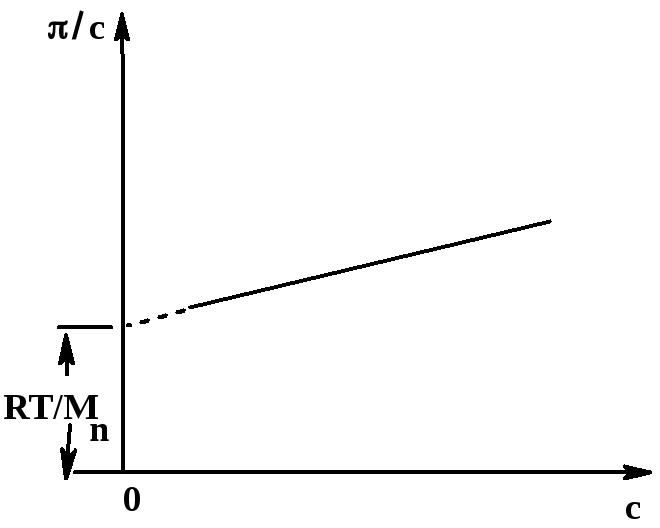 Рис. 43.
Зависимость величины π/с от концентрации
раствора полимера
Рис. 43.
Зависимость величины π/с от концентрации
раствора полимера
Осмометрический способ определения молекулярных масс может применяться и для определения молекулярных масс низкомолекулярных соединений.
2. Определение по вязкости растворов. Как было сказано выше, молекулярную массу полимеров и вязкость их растворов связывает уравнение Куна-Марка-Хаувинка [η] = КМа. Следовательно, если известны коэфициенты К и а, то, измерив характеристическую вязкость раствора полимера, можно определить его средневискозиметрическую молекулярную массу. Для этого определяют вязкость нескольких разбавленных растворов исследуемого полимера ( в хорошо известном вискозиметре). Далее строят зависимость приведенной вязкости растворов от их концентрации и, экстраполируя на нуль, определяют [η] (картина сходна с изображенной на рис. 42).
Если коэффициенты К и а неизвестны, то предварительно их нужно определить. Для этого полимер фракционируют, для каждой фракции определяют среднюю молекулярную массу каким-либо другим способом [осмометрически или по светорассеянию (см. ниже)] и измеряют характеристическую вязкость. Из соотношения молекулярных масс и характеристической вязкости определяют коэффициенты К и а.
3. Определение по седиментации растворов (путем ультрацентрифугирования). В отличие от типично коллоидных систем - суспензий, – в истинных растворах полимеров в обычных условиях не происходит осаждения (седиментации) даже самых больших макромолекул. Причина в том, что в растворах гравитационные силы, вызывающие осаждение, уравновешиваются диффузионными силами, стремящимися равномерно распределить растворенные частицы по всему объёму раствора. Однако, если увеличить гравитацию, то она превзойдет силы диффузии, и макромолекулы начнут осаждаться, причем тем быстрее, чем они больше. На этом и основано определение среднеседиментационной молекулярной массы полимеров.
Наиболее эффективный способ увеличения гравитационных сил – ультрацентрифугирование растворов полимеров. Раствор полимера помещают в ультрацентрифугу, которая вращает его со скоростью выше 60000 об/мин. Под действием мощной гравитационной (центробежной) силы макромолекулы полимера начинают постепенно оседать (перемещаться в направлении ко дну пробирки). В пробирке появляется граница раздела между чистым растворителем и раствором оседающих частиц; это граница с течением времени смещается по направлению от оси вращения (рис. 43):



 х
х


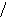
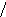
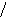
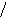
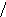
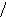
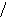
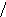
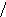
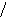
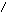 t1
t1


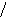

 t2
t2



 t3
t3

ось вращения
Рис.
44. Смещение границы раздела между
раствором (заштрихованный сектор) и
чистым растворителем  (незаштрихованный
сектор) в процессе ультрацентрифугирования
(t1<
t2<
t3).
(незаштрихованный
сектор) в процессе ультрацентрифугирования
(t1<
t2<
t3).
Измеряя (обычно после фотографирования) положение границы раздела в разное время, определяют коэффициент седиментации Sпо формуле:
dx/dt
S =
=
ω2x
где х – расстояние от границы раздела до оси вращения; ω – угловая скорость вращения, t– время
Определив величину Sдля нескольких концентраций разбавленного раствора, определяют зависимостьSот концентрации и, экстраполируя на нуль аналогично предыдущим примерам, получаем значениеS0= (S)c→0. КоэффициентS0связан с молекулярной массой полимера соотношением:
М = S0RT/D0(1-ρV)
где D0– коэффициент диффузии, экстраполированный на нулевую концентрацию (определяется специальным экспериментом);ρ– плотность растворителя;V– удельный объём полимера в растворе.
4. Определение по светорассеянию растворов (нефелометрический метод). В этом варианте определяют величину рассеяния света разбавленными растворами полимеров. Рассеяние света обусловлено флуктуациями плотности раствора и его показателя преломления из-за образования флуктуационных групп (роев) молекул растворенного вещества. Интенсивность рассеяния света определяется массой частиц, поэтому здесь можно определитьсреднемассовуюмолекулярную массу.
Характеристикой интенсивности светорассеяния является величина мутности (τ), которая определяется по уравнению:
Iθ/I0=e–τx
где Iθ– интенсивность рассеянного света;I0 – интенсивность падающего света, х – толщина слоя раствора.
Величина мутности связана с молекулярной массой полимера соотношением:
Hc/τ = 1/Mw+ 2A2c/RT
где А2– второй вириальный коэффициент; с – концентрация раствора; Нс– константа, зависящая от длины волны рассеиваемого света и изменения показателя преломления (n) от концентрации раствора (dn/dt).
Для определения молекулярной массы определяют величину Нс(специальным экспериментом). Далее измеряют светорассеяние (определяют величину τ) нескольких разбавленных растворов полимера, строят график зависимости Нс/τ от концентрации и экстраполируют его на нулевую концентрацию (картина аналогична представленной на рис. 42. На оси ординат отсекается отрезок, равный 1/М.
Измерения светорассеяния проводят на специальных приборах – нефелометрах, где луч падающего света проходит через раствор, помещенный в кювету. Раствор должен быть свободным от пыли; даже небольшое ее содержание сильно искажает картину светорассеяния.
