
- •1.Актуальность
- •2.Цель занятия
- •3.Целевые уровни
- •4.Необходимый исходный уровень знаний и умений:
- •5.Учебный материал для решения целевых задач.
- •6. Требования программы по изучаемому разделу
- •7. Контрольно- учебная карта внеаудиторной подготовки студента к занятию
- •Обучающая задача
- •Тренирующие задачи
- •Контролирующие задачи
- •Приложение 1.
Обучающая задача
Решение
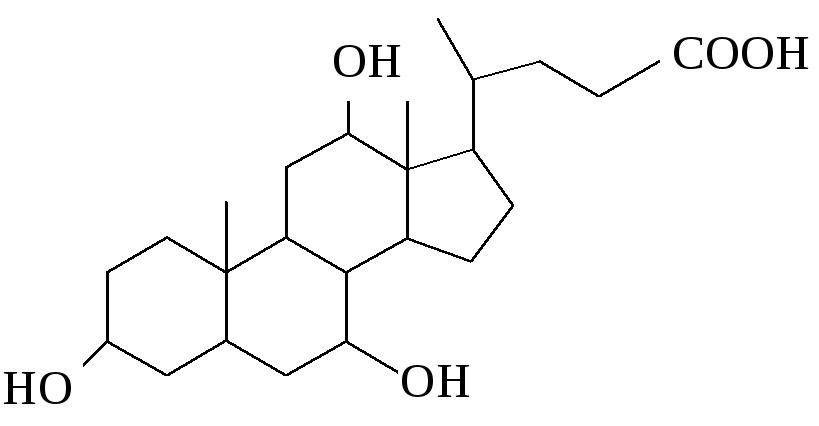
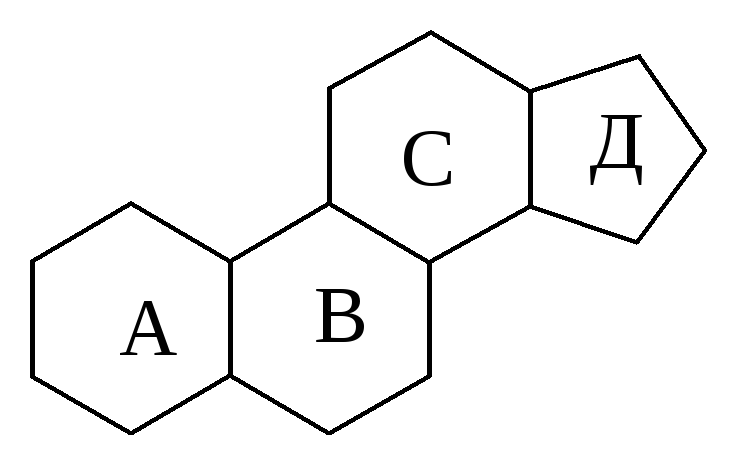
1.Наличие в соединении четырех циклов, составляющих стерановую группу, позволяет отнести его к классу стероидов:
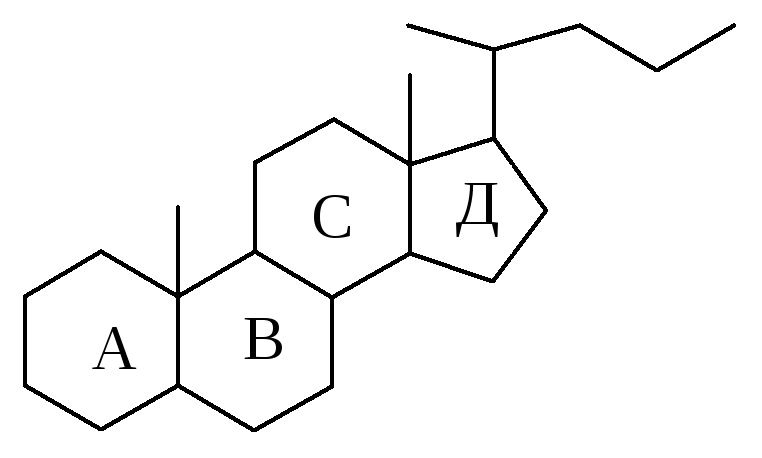
2.Наличие в 17 положении углеродной цепочки из пяти атомов, а в положении 10 и 13 – метильных групп позволяет отнести соединение к производным холана:
3.Присутствие в радикале в 17 позиции карбоксильной группы позволяет отнести соединение к классу кислот:
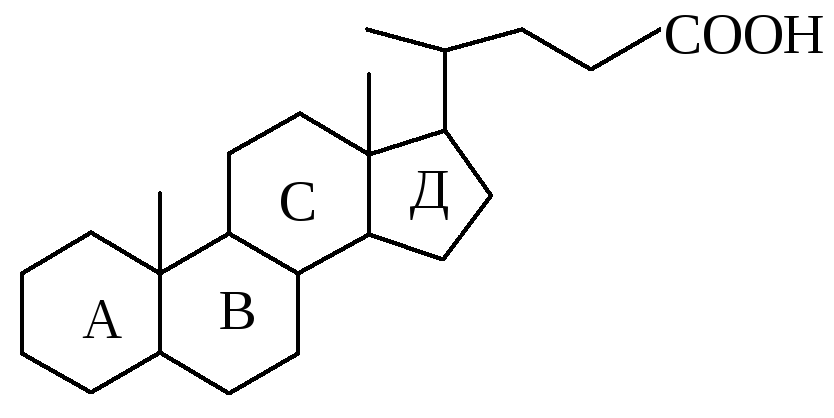
Таким образом, предложенное соединение относится к классу желчных кислот и является холевой кислотой.
Тренирующие задачи
1. Напишите реакцию гидрогенизации линоленоилолеоил-пальмитоилглицерина. Какова консистенция исходного и конечного продуктов?
2. Напишите строение фосфатидилэтаноламина, включающего пальмитиновую и линоленовую кислоты. Обозначьте полярную и неполярную части молекул.
3. Напишите реакцию гидролитического расщепления в кислой и щелочной средах дипальмитоилстеароилглицерина. По какому механизму осуществляется реакция в кислой среде?
4. Напишите уравнения реакций пероксидного окисления олеиновой и линолевой кислот. Где встречаются такие реакции и какие последствия они вызывают?
Контролирующие задачи
1. Линетол, применяемый для профилактики и лечения атеросклероза, представляет собой смесь этиловых эфиров олеиновой (15%), линолевой (15%) и линоленовой (57%) кислот с содержанием свободных насыщенных кислот до 13%. Рассчитайте, исходя из этого состава, йодное число для линетола. Напишите схему реакции, лежащей в основе определения йодного числа, на примере этиллиноленоата.
2. Гидролиз триацилглицеринов осуществляют, как и в кислой, так и щелочной средах. Принимая во внимание гетерогенность среды в процессе гидролиза, а также свойства образующихся при гидролизе продуктов, предскажите, какой гидролиз предпочтительнее – кислотный или щелочной? Почему щелочной гидролиз сложных эфиров называется омылением?
3. Рассчитайте число омыления для одного из компонентов оливкового масла – 1,2-диолеоил-3-пальмитоилглицерина. От какого фактора в большей степени зависит число омыления – степени ненасыщенности или длины углеродной цепи кислот, входящих в состав триацилглицеринов?
4. Триацилглицерины оливкового, подсолнечного и льняного масел содержат практически одинаковое количество насыщенных (8-14%) и ненасыщенных (86-92%) жирных кислот, однако их йодные числа заметно различаются: 75-94, 110-144 и 174-184 соответственно. В том же ряду снижается и температура застывания названных масел. Объясните эти факты.
5. Рассчитайте объем водорода при нормальных условиях, необходимого для превращения 1 кг подсолнечного масла (йодное число 130) в смесь полностью насыщенных триацилглицеринов. Какими химическими реакциями можно проконтролировать полноту гидрирования?
6. Образец соевого масла содержит в составе триацилглицеринов 15 % насыщенных кислот, 25 % олеиновой, 50 % линолевой и 10 % линоленовой кислот. Какую консистенцию будет иметь продукт, если при гидрировании 100 г этого масла поглотилось 2 л водорода при нормальных условиях? Примите усредненную молекулярную массу триацилглицеринов, равную 870, а йодное число – 130. Напишите схему реакции неполного гидрирования 1,2-дилиноленоил-3-олеоилглицерина 2 моль водорода.
ТЕМА: Биологически активные высокомолекулярные соединения. Реакции образования полипептидов из α-аминокислот. Биуретовая реакция. Качественные реакции на белки.
Тема: Биологически активные высокомолекулярные соединения. Реакции образования полипептидов из α-аминокислот. Биуретовая реакция. Качественные реакции на белки.
Актуальность темы.
Белки – это макромолекулярные соединения, имеющиеся во всех живых клетках. Они играют ключевую роль в клетке, присутствуют в виде главных компонентов в любых формах живой материи. Без белков невозможно представить себе жизнь; и именно в этом смысле сохраняет свое значение определение Фридриха Энгельса: «Жизнь есть способ существования белковых тел». В настоящее время трудно оценить общее число белков, следует признать существование многих миллиардов химически индивидуальных белков. Белки чрезвычайно разнообразны по структуре и выполняют многочисленные биологические функции. Они служат важнейшим строительным материалом в тканях животных, являются главной составной частью кожи, хрящей, ногтей и мышц. К белкам относятся и ферменты – биологические катализаторы биохимических реакций, протекающих во всех живых организмах, в живой клетке и составляющих основу ее метаболизма. Белки осуществляют перенос жизненно важных веществ, ионов в организме (транспортные белки). К ним относятся цитохром С, участвующий в транспорте электронов, гемоглобин, миоглобин, переносящие кислород, а также сывороточный альбумин (транспорт жирных кислот в крови) и др. антитела, выполняющие в организме защитную функцию (защищают от вредных веществ), тоже состоят из белков. Значительное число известных гормонов являются пептидами – окситоцин, вазопрессин, адренокортикотропный гормон (гипофиз), глюкогон (поджелудочная железа), гастрин, секретин и холецистокинин (желудочно-кишечный тракт), кальцитонин (щитовидная железа), тканевые гормоны брадикинин и ангиотензин, вещества гормонального характера – глютатион и др. Самые разнообразные белки построены из 20 α-аминокислот. Они входят в состав белкового сополимера, многократно повторяясь и сочетаясь друг с другом различным образом. Последовательность во многом определяет и индивидуальную особенность макромолекулы полимера. Большую роль играет и способность полимерной цепи в целом принимать и сохранять определенную конфигурацию.
Потребности организма человека и животных в различных аминокислотах не одинакова. Некоторые из аминокислот незаменимы. Они должны быть обязательно введены с пищей. Организм не способен их синтезировать полностью. К ним относятся: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, трионин, триптофан, валин, аргенин. При некоторых заболеваниях список незаменимых аминокислот увеличится.
α-аминокислоты занимают ключевое положение в азотном обмене. Многие из них используются в медицине в качестве лекарственных средств, влияющих на тканевой обмен. Например, глютаминовая кислота применяется для лечения заболеваний центральной нервной системы, метионин и гистидин – в лечении и предупреждении заболеваний печени, цистеин – глазных болезней.
Белки важнейшая составная часть пищи человека и корма животных. Человеку необходимо в день в среднем 70 грамм белка. Главным источником пищевого белка являются сельскохозяйственные продукты – мясо, молоко, пшеница, рожь, кукуруза, рис, соя, горох, фасоль, различные овощи и фрукты, значительное количество белка содержат продукты моря. В настоящее время на Земном шаре ощущается острый белковый дефицит, связанный с недостаточным производством продуктов питания, быстрым ростом народонаселения. Белку и его компонентам – аминокислотам – отводится центральное место и в проблеме создания искусственной пищи.
Качественные (цветные) реакции на белки широко используются для аналитических целей. Среди них широко известная нингидриновая реакция, позволяющая проводить количественное определение аминогрупп в белках, пептидах и аминокислотах, а также биуретовая реакция, применяемая для качественного и количественного определения белков и пептидов и др.
Знание строения и физико-химических свойств α-аминокислот in vitro позволяет при последующем изучении биохимии и других медико-биологических дисциплин научно обоснованно интерпретировать их метаболитические превращения в организме, механизмы биосинтеза аминокислоты и белков, искать пути к познанию молекулярных механизмов медико-биологических процессов
Цель занятия.
Сформировать знания о классификации, строении и свойствах α-аминокислот как основы для последующего изучения динамической биохимии в частности аминокислот. Составить представление о пептидах, образовании амидной (пептидной связи) между аминокислотными остатками, биологической роли пептидов. Систематизировать знания о строении, структурной организации белков, роли аминокислот, определяющих индивидуальное строение, конформацию, характер связи в макромолекуле и свойство каждого белка, многообразие белков в природе для дальнейшего изучения биологической функции белков на молекулярном уровне.
Необходимый исходный уровень знаний и умений.
- стереоизометрия;
- кислотность и основность органических соединений;
- водородная связь;
- реакции нуклеофильного замещения в карбоксильной группе. Получение амидов кислот и их гидролиз;
- химические свойства аминогруппы;
- окисление тиолов и восстановление дисульфидов;
- кислотно-основные (амфотерные) свойства аминокислот;
- химические свойства аминокислот;
- изоэлектрическую точку.
Студент должен иметь представление:
- о биотрансформации органических веществ;
- о превращениях аминокислот в организме.
Студент должен знать:
- классификацию аминокислот по различным признакам;
- стереохимию биологически важных аминокислот;
- кислотно-основные свойства α-аминокислот;
- химические свойства аминокислот как гетерофункциональных соединений;
- специфические свойства аминокислот, обусловленные наличием в их составе двух функциональных групп;
- реакции превращения аминокислот в организме;
- реакции поликонденсации аминокислот;
- реакции гидролиза белков.
Студент должен уметь:
- различать D и L-аминокислоты;
- характеризовать химические свойства аминокислот с помощью уравнений химических реакций;
- составить схемы реакций дезаминирования, декарбоксилирования, гидроксилирования, трансаминирования, расщепления;
проводить идентификацию аминокислот экспериментальным путем;
- составлять уравнения качественных реакций аминокислот;
- записывать уравнения образования и гидролиза ди-, три-, тетра- и т.д. пептидов
Требования рабочей программы по изучаемому разделу.
Аминокислоты, входящие в состав белков. Строение. Номенклатура. Стереоизометрия. Кислотно-основные свойства, биполярная структура
Классификация аминокислот с учетом различных признаков: по химической природе радикала и содержащихся в нем заместителей, по кислотно-основным свойствам.
Биосинтетические пути образования α-аминокислот из кетонокислот: реакции восстановительного аминирования и реакции трансаминирования. Пиридоксалевый катализ.
Химические свойства α-аминокислот как гетерофункциональных соединений. Образование внутрикомплексных солей. Реакции этерификации, ацилирования, алкилирования, образования иминов.
Биологически важные реакции α-аминокислот. Реакции дезаминирования (неокислительного и окислительного). Реакции гидроксилирования.
Декарбоксилирование α-аминокислот – путь к образованию биогенных аминов и биорегуляторов (коламин, гистамин, триптамин, серотонин, кадаверин, β-аланин, γ-аминомасляная кислота).
Пептиды. Строение пептидной группы. Гидролиз пептидов.
Установление аминокислотного состава с помощью современных физико-химических методов. Установление первичной структуры пептидов. Определение аминокислотной последовательности.
Первичная структура белков. Частичный и полный гидролиз.
Понятие о сложных белках. Гликопротеины, липопротеины, нуклеопротеины, фосфопротеины.
Учебный материал для решения целевых задач
Биоорганическая химия. Учебник. (Тюкавкина Н.А., Бауков Ю.И.). 7 изд., Дрофа. 2008 – 543 с.
Руководство к лабораторным занятиям по биоорганической химии, под ред. Н.А. Тюкавкиной, Дрофа, 2009 г., 5 изд. – 318 с.
- Агапов А.И., Кириллова В.Я., Кривопалова М.А. Методические разработки. Учебные карты самостоятельной подготовки для студентов по биоорганической химии для лечебного, профилактического, педиатрического и стоматологического факультета. Кафедра общей, бионеорганической и биоорганической химии СамГМУ, - Самара, 2000.
- Лекции по биоорганической химии.
Контрольно-учебная карта внеаудиторной подготовки студента к занятию
|
Вопросы для самоподготовки |
Вопросы для самоконтроля |
|
1.Строение, классификация, изометрия и номенклатура аминокислот. |
1. Основные функции белков. 2. Элементарный состав белков. 3. Классификация аминокислот. 4.Физические свойства аминокислот. Понятие стереоспецифичности аминокислот. 5. Кислотно-основные свойства аминокислот. 6. Кривые титрования аминокислот. Понятие изоэлектрической точки (pI).
|
|
2.Химические свойства аминокислот. |
3.Написать биполярные ионы аминокислот: метионин, , лизин, триптофан. 4.Составьте схемы реакций, используемых при синтезе пептидов: а) защита аминогруппы: фенилаланин+уксусный ангидрид; б) получение смешанного ангидрида: N-защищенная аминокислота+этилхлорформиат. |
|
3.Цветные реакции на белки |
1. Как с помощью цветных реакций обнаружить в белке аргинин? 2. Как обнаружить в белке цистеин? 3. Способ связи аминокислот в белках. |
Место проведения занятия: кафедра общей, бионеорганической и биоорганической химии
Обучающие задачи:
Напишите схему получения аланилглицина.
Решение:
Для того, чтобы соединить две аминокислоты пептидной связью,например получить аланилглицин, необходимо:
закрыть (защитить) карбоксильную группу глицина и аминогруппу аланина, чтобы не произошло нежелательных реакций по этим групамм;
образовать пептидную связь;
снять защитные группы.
Защитные группы должны надежно закрывать аминную и карбоксильную группы в процессе синтеза и потом легко сниматься без разрушения пептидной связи.
Защита аминогруппы наиболее просто проводится ацилированием:
-HCl
R-COCl+H2N-CH(CH3)-COOH → R-CO-NH-CH(CH3)-COOH
Карбоксильную группу для защиты превращают в сложноэфирную:
-HOH
H2N-CH2-COOH+HOR → H2N-CH2-COOR
Для образования пептидной связи или активируют карбоксильную группу N-ацилаланина, превращая его в хлорангидрид, или проводят конденсацию в присутствии сильных водоотнимающих веществ:
-H2O
R-CO-NH-CH(CH3)-COOH+HNHCH2-COOR → R-CO-NH-CH(CH3)-CO- HN-CH2-COOR
гидролиз
→ H2N-CH(CH3)-CO-HN-CH2-COOH
Затем снимают защитные группы в таких условиях, чтобы не затрагивалась пептидная связь.
