
Agadzhanyan T
.1.pdfнии глубокого расслабления (например во время сна) снижается.
Регулярные физические нагрузки приводят к развитию мышечной силы, что обусловлено структурными и функциональными изменениями организма. Структурные изменения проявляются в укреплении костей, суставов, связок, гипертрофии мышц (увеличении диаметра мышечных волокон, количества сократительных белков и миофибрилл). Функциональные изменения состоят в повышении возбудимости нервно-мышечного аппарата, улучшения внутри- и межмышечной координации, а также в увеличении согласованности двигательных и вегетативных функций.
Бездеятельность мышц приводит к их гипотрофии. При старении гипотрофия быстрых волокон в мышцах происходит раньше, чем медленных. Это объясняется уменьшением физических нагрузок большой интенсивности и снижением общей двигательной активности пожилых людей.
Мышцы сердца
Сердечная мышца состоит из вытянутых одноядерных мышечных клеток (кардиомиоцитов), обладающих поперечной исчерченностью. Кардиомиоциты связаны между собой электрическими контактами – нексусами. Поэтому все кардиомиоциты в конечном счете образуют одну функциональную единицу (функциональный синцитий), и электрическое раздражение любой точки сердца вызывает возбуждение и сократительную реакцию всех мышечных клеток. Поэтому сердце (в отличие от скелетной мышцы, включающей много независимых двигательных единиц) отвечает на раздражение как единая структура по правилу «все или ничего», что является необходимым условием для выполнения сердцем функции насоса.
Сердечная мышца, в отличие от скелетной, способна работать автоматически, т.е. без импульсов, приходящих из ЦНС. В естественных условиях стимул (ПД), вызывающий
79
сокращение сердца, возникает в нем самом (свойство автоматии), точнее – в специфических мышечных клетках синусного узла, расположенного в правом предсердии. В этих клетках периодически происходит спонтанная деполяризация мембраны (из-за ритмического роста проницаемости для Na+), приводящая к развитию ПД. Из этого узла ПД распространяется по мышечным элементам предсердий, вызывая их возбуждение, и далее через клетки предсердно-желудоч- кового узла, пучка Гиса и волокна Пуркинье к кардиомиоцитам желудочков.
Потенциал действия кардиомиоцитов предсердий имеет бóльшую длительность, чем в скелетно-мышечных волокнах. Но особенно длительны ПД в кардиомиоцитах желудочков сердца. У этих ПД наблюдается обычный крутой подъем с овершутом, а затем возникает плато (на уровне, близком к пику ПД). Длительность этого плато составляет около 250– 300 мс. Затем начинается нисходящая фаза ПД.
Ионный механизм ПД кардиомиоцитов состоит в быстрой активации стимулом ПД натриевых и натрий-кальцие- вых каналов при одновременной инактивации части калиевых каналов (это особое свойство К-каналов кардиомиоцитов). Последующая инактивация каналов входящих токов (Na-Ca-каналов) происходит медленно. И поэтому активация части К-каналов задерживается на многие десятки (сотни) миллисекунд деполяризацией мембраны. Лишь при достижении определенного уровня мембранного потенциала начинается открытие К-каналов и спад (завершение) ПД. Такая организация ПД клеток желудочка сердца обеспечивает их относительно длительное сокращение (250–300 мс), определяет длительную абсолютную рефракторную фазу сердца, что необходимо для выполнения сердцем функции насоса.
Электромеханическая связь в мышечных элементах сердца подобна связи в скелетных мышцах. Особенность состоит в том, что источником ионов Са2+ лишь отчасти является саркоплазматический ретикулум (развитый относительно слабо), много Са2+ поступает в возбужденные кардиомиоциты из внеклеточной среды. Сократительный механизм сер-
80
дечных мышечных волокон подобен скелетно-мышечному сокращению.
Зависимость силы напряжения мышцы сердца от исходной длины ее волокон имеет тот же характер, что и в скелетной мышце. Предварительное растяжение желудочков сердца поступающей кровью (венозный возврат) усиливает общее напряжение при активном сокращении. Это обеспечивает саморегуляцию работы сердца (гетерометрическая регуляция) – усиление выброса крови при усилении ее притока (закон Старлинга).
Гладкие мышцы
Гладкие мышцы образуют мышечные слои стенок желудка, кишечника, мочеточников, бронхов, кожи, кровеносных и лимфатических сосудов, а также других внутренних органов. Они отличаются от скелетных и сердечной мышц отсутствием поперечной исчерченности. Гладкие мышцы построены из веретенообразных одноядерных мышечных клеток (длиной от 20 до 500 мкм и толщиной 5–20 мкм), которые содержат актиновые и миозиновые нити, расположенные менее упорядоченно, чем в волокнах скелетных и сердечной мышц. Саркомеры и типичные концевые пластинки отсутствуют, гладкий эндоплазматический ретикулум слабо развит. Гладкомышечные клетки укорачиваются в результате скольжения актиновых и миозиновых нитей, скорость скольжения и быстрота расщепления АТФ в 100–1000 раз меньше, чем в попе- речно-полосатых мышцах. Благодаря этому гладкие мышцы хорошо приспособлены для длительного стойкого сокращения без утомления и с небольшой затратой энергии.
Гладкие мышцы разделяются на две основные группы (в зависимости от плотности их двигательной иннервации): мультиунитарные и унитарные (висцеральные). Мультиунитарные функционируют независимо друг от друга, и каждое волокно может иннервироваться отдельным нервным окончанием. Такие волокна обнаружены в ресничной мышце глаза, мигательной перепонке и мышечных слоях некоторых
81
крупных сосудов к ним относятся мышцы, поднимающие волосы.
Вунитарные мышцах двигательные аксоны оканчиваются на небольшом числе волокон, которые настолько тесно переплетены, что их мембраны могут сливаться, образуя электрические контакты (нексусы). Благодаря нексусам возбуждение с аксонов передается на все гладкие клетки пучка. При раздражении одного волокна за счет этих контактов ПД быстро распространяются на соседние волокна. Поэтому, несмотря на то, что двигательные нервные окончания расположены на небольшом числе мышечных волокон, в реакцию вовлекается вся мышца. Такие гладкие мышцы представляют собой функциональный синцитий и имеются в большинстве внутренних органов: пищеварительном тракте, матке, в мочеточниках.
Электрическая активность. Для гладких мышц ха-
рактерен нестабильный мембранный потенциал. Спонтанные изменения МП происходят независимо от нервных влияний и вызывают нерегулярные сокращения отдельных волокон, которые поддерживают всю мышцу в состоянии постоянного частичного сокращения – тонуса. Тонус хорошо выражен в гладких мышцах мелких артерий и артериол, в сфинктерах полых органов (желчном и мочевом пузырях, в месте перехода желудка в двенадцатиперстную кишку и тонкой кишки
втолстую).
Впериоды покоя средняя величина МП составляет примерно -50 мВ. Величина ПД варьирует в широких пределах, а длительность ПД составляет 50–250 мс. В гладких мышцах разных органов форма ПД неодинакова. В мышцах мочеточника, желудка и лимфатических сосудов ПД имеют продолжительное плато, возникновение которого обусловлено по-
ступлением в цитоплазму миоцитов значительного количества внеклеточного Са2+, который обеспечивает активацию взаимодействия сократительных белков. Блокирование кальциевых каналов фармакологическими препаратами используется для коррекции моторики пищеварительного тракта и снижения тонуса сосудов при лечении гипертонической болезни.
82
Свойства гладких мышц. Особенностью гладких мышц является их способность осуществлять медленные и длительные тонические сокращения. Длительные тонические сокращения гладких мышц обеспечивают функционирование сфинктеров полых органов, которые препятствуют выходу их содержимого. Ритмические сокращения гладких мышц желудка, кишечника, мочеточников и других органов обеспечивают перемещение содержимого этих органов.
Гладкие мышцы стенок кровеносных сосудов, особенно артерий и артериол, находятся в состоянии постоянного тонического сокращения. Изменение тонуса мышц стенок артериальных сосудов влияет на величину их просвета и, следовательно, на уровень кровяного давления и кровоснабжения органов.
Важным свойством гладких мышц является их пластичность, т.е. способность сохранять приданную им при растяжении длину. Если растянуть гладкую мышцу, то ее напряжение сначала будет увеличиваться, но если ее долго удерживать в этом состоянии, то напряжение будет постепенно уменьшаться (до уровня, существовавшего до растяжения или даже ниже). Скелетная мышца в норме почти не обладает пластичностью. При удалении растягивающего груза скелетная мышца быстро укорачивается, а гладкая остается растянутой. Высокая пластичность гладких мышц имеет большое значение для нормального функционирования полых органов. Например, пластичность мышц мочевого пузыря по мере его наполнения предотвращает избыточное повышение давления мочи.
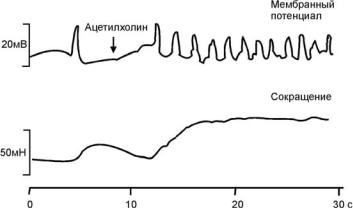
Автоматия. Многие гладкие клетки (желудка, кишечника, мочеточника, матки) способны спонтанно генерировать ПД (миогенные). Такие ПД имеют авторитмический (пейсмекерный) характер, подобно ПД проводящей системы сердца. Мембраны этих клеток способны ритмически деполяризоваться до критического уровня деполяризации, при котором генерируется ПД (рис. 2.25). Пейсмекерные потенциалы регистрируются в различных волокнах гладких мышц, т.е. любые клетки этих мышц способны к самопроизвольной ав-
83
томатической активности. Автоматия присуща гладким мышцам сосудов и многих внутренних органов.
Рис. 2.25. Сокращение гладкой мышцы
Спонтанный потенциал действия (верхняя запись) вызывает в мышце толстой кишки одиночное сокращение. Обработка ацетилхолином (стрелка) повышает частоту потенциалов действия, так что одиночные сокращения сливаются в тетанус. Нижняя запись – ход мышечного сокращения (Р. Шмидт, Г. Тевс, 1985)
Гладкие мышцы, не обладающие спонтанной ак-
тивностью. Гладкие мышцы артерий, семенных протоков, радужки обладают либо очень слабой способностью генерировать спонтанные ПД, либо вообще ее не проявляют. Их активность обычно имеет не миогенную, а нейрогенную природу, т.е. обусловлена импульсами, которые поступают к ним по вегетативным мышцам.
Реакция на растяжение. Резкое растяжение гладких мышц вызывает их сильное сокращение, что обусловлено увеличивающейся при механическом растяжении деполяризацией клеток, обеспечивающих автоматию гладкой мышцы. Такое сокращение играет важную роль в авторегуляции тонуса кровеносных сосудов, а также обеспечивает непроизвольное опорожнение переполненного мочевого пузыря в тех случаях, когда нервная регуляция отсутствует в результате повреждения спинного мозга.
84
Способность к тетанусу. В гладких мышцах тетаническое сокращение возникает при низкой частоте стимуляции. В отличие от скелетных, гладкие мышцы способны развивать спонтанные тетанообразные сокращения в условиях денервации даже после блокады интрамуральных ганглиев. Такие сокращения возникают вследствие активности клеток, обладающих автоматией (пейсмекерных клеток), которые отличаются по электрофизиологическим свойствам от других мышечных клеток. В них возникают пейсмекерные потенциалы, деполяризующие мембрану до критического уровня, что вызывает возникновение потенциала действия.
Возбуждение гладкомышечных клеток обусловливает повышение концентрации кальция в саркоплазме, что активирует сократительные структуры. Так же как сердечная и скелетная мышцы, гладкая мышца расслабляется при снижении концентрации ионов кальция. Расслабление гладких мышц происходит более медленно, так как удаление ионов кальция замедлено.
Связь возбуждения с сокращением. В основе сокра-
щения гладких мышц, так же как и поперечно-полосатых, лежит скольжение нитей актина относительно миозина, которое инициируется увеличением концентрации Са2+ в цитоплазме. Однако в механизме сокращения гладких мышц имеется отличительная особенность – прежде чем миозин гладкой мышцы сможет проявить свою АТФ-азную активность, он обязательно должен быть фосфорилирован. Фосфорилирование и дефосфорилирование происходит и в скелетных мышцах, но в них процесс фосфорилирования не является обязательным для активации АТФ-азной активности.
Для гладких мышц (таких, как мышцы сосудов, матка), а также для некоторых форм немышечной подвижности (изменение формы тромбоцитов) характерен так называемый миозиновый тип регуляции. Он связан с изменением структуры легких цепей миозина. С миозиновыми филаментами гладких мышц соединен фермент (киназа легких цепей миозина), способный переносить остаток фосфата АТФ на оксигруппы остатков серина или треонина белка. В состоянии
85
покоя при низкой концентрации Са2+ в цитоплазме киназа легких цепей миозина неактивна. Это обусловлено тем, что в ее структуре есть специальный блокирующий активность участок. Ингибиторный участок попадает в активный центр фермента и не дает возможности взаимодействовать с истинным субстратом.
В цитоплазме гладких мышц есть белок кальмодулин, содержащий в своей структуре четыре связывающих Са2+ центра. Связывание Са2+ вызывает изменения в структуре кальмодулина. Насыщенный Са2+ кальмодулин оказывается способным взаимодействовать с киназой легких цепей миозина. Посадка кальмодулина приводит к удалению ингибиторного участка из активного центра, и фермент начинает узнавать свой субстрат. Фосфорилирование легкой цепи миозина приводит к изменениям структуры как самой легкой цепи, так и тяжелой цепи миозина в области ее контакта с легкой цепью. Только после фосфорилирования легкой цепи начинается мышечное сокращение.
Понижение концентрации кальция в клетке вызывает выход ионов Са2+ из связывающих центров кальмодулина. Кальмодулин отходит от киназы легких цепей миозина, которая тут же теряет свою активность. Но пока легкие цепи миозина находятся в фосфорилированном состоянии, он продолжает осуществлять циклическое протягивание нитей актина.
Для того чтобы остановить циклические движения головок, надо удалить остаток фосфата с легкой цепи миозина. Этот процесс осуществляется под действием фермента (фосфатазы легких цепей миозина). Дефосфорилированный миозин не способен осуществлять циклические движения своей головкой и подтягивать нити актина, поэтому и происходит расслабление.
Нервная регуляция гладких мышц. Унитарные мышцы имеют двойную вегетативную иннервацию (симпатическую и парасимпатическую). Раздражение одного из вегетативных нервов обычно увеличивает активность гладкой мышцы, а стимуляция другого – снижает ее. Строение нерв-
86
ных окончаний в гладких мышцах отличается от строения нервно-мышечных синапсов скелетных мышц. В гладких мышцах нет концевых пластинок, по всей длине вегетативных аксонов имеются утолщения (варикозы), которые содержат везикулы с медиатором. Поэтому по ходу следования вегетативного волокна могут возбуждаться или тормозиться многие гладкие мышечные клетки. Скорость проведения возбуждения в гладких мышцах составляет несколько сантиметров в секунду.
Возбуждающее действие вегетативных (адренергических или холинергических) нервов при их однократной стимуляции проявляется в виде отдельных волн деполяризации (локальных ответов). При повторной стимуляции эти потенциалы суммируются, и при достижении пороговой величины деполяризации возникает ПД.
Тормозящее влияние адренергических или холинергических нервов проявляется в виде тормозных постсинаптических потенциалов (гиперполяризации мембраны гладких клеток), которые способны суммироваться. Возбуждающие и тормозные потенциалы возникают не только в мышечных клетках, непосредственно контактирующих с варикозами, но и на некотором расстоянии от них. Это происходит за счет передачи потенциалов через нексусы и посредством диффузии медиатора к другим волокнам.
Гуморальная регуляция. Особенностью гладких мышц является их высокая чувствительность к медиаторам, которые оказывают на спонтанную активность пейсмекеров модулирующие влияния, и другим биологически активным веществам. Это обусловлено наличием специфических рецепторов к этим веществам на мембране гладкомышечных клеток.
При нанесении ацетилхолина на препарат мышцы толстой кишки величина МП снижается, частота ПД возрастает. Вызываемые ими сокращения сливаются, возникает почти гладкий тетанус. Чем выше частота ПД, тем сильнее сокращение. Ацетилхолин увеличивает проницаемость мембраны для ионов Na+ и Са2+, что вызывает ее деполяризацию.
87
Норадреналин, напротив, гиперполяризует мембрану, снижая частоту ПД и величину тетануса. Он действует на α- и β-адренорецепторы мембраны гладкомышечных клеток. Взаимодействие адреналина и норадреналина с α-рецепто- рами тормозит сокращение мышцы за счет увеличения выхода Са2+ из гладкомышечных клеток, а с β-адренорецептора- ми – уменьшает тонус мышцы в результате активации аденилатциклазы, образования циклического АМФ и последующего увеличения связывания внутриклеточного Са2+. Оба механизма реализуются в конечном счете через снижение концентрации Са2+ внутри клетки.
Гладкие мышцы ряда органов реагируют на гормоны. Например, мышцы матки в период между овуляциями (или после удаления яичников) мало возбудимы. Введение эстрогена вызывает увеличение их возбудимости.
Физиология железистой ткани
Классическими клеточными элементами возбудимых тканей (нервной и мышечной) являются нейроны и миоциты. Железистую ткань тоже относят к возбудимым тканям, но образующие ее гландулоциты обладают существенной морфологической и функциональной спецификой.
По своему происхождению одни железистые ткани являются эпителиальными, другие состоят из нейронов и относятся к нервной ткани как по происхождению, так и по своим свойствам, составляя часть центральной нервной системы. Отдельный тип железистой ткани в процессе эмбриогенеза образуется из нервных элементов, но не входит в состав ЦНС.
Эпителии, обладающие способностью вырабатывать секреты, называются железистыми. Они являются основным компонентом желез. Например, эпителии кожного типа дают производные в виде потовых, сальных, слюнных, слезных желез. Клетки эпителия желез – гландулоциты весьма разнообразны по размерам, форме и ультраструктуре.
88
