
Agadzhanyan T
.1.pdfМетод ЭЭГ широко используется в клинике и психофизиологии для изучения механизмов обработки информации и управления поведением человека, для выявления первых признаков эпилепсии, диффузных поражений головного мозга, скрытых травм и эндогенной интоксикации, опухолей мозга.
Психотропные препараты также влияют на ЭЭГ. Метод электроэнцефалографии используют для констатации «клинической» смерти («изоэлектрическая» или «плоская» ЭЭГ), а также для определения «предела реанимации» при ишемии мозга, который для коры составляет всего 3–8 мин.
ЭКоГ и ЭЭГ отражают постсинаптическую активность нейронов коры, но не их ПД и активность глиальных клеток.
Колебания потенциала, возникающие в коре и подкорковых структурах в ответ на раздражение рецепторов, периферических нервов, сенсорных трактов и ядер, называются
вызванными потенциалами (ВП). Они могут иметь короткий латентный период (6–8 мс), первое положительное отклонение и возникать в ограниченном участке коры (фокусе максимальной активности -ФМА). Эти потенциалы называются
первичными ответами (ПО) (рис. 3.19).
Второй вид потенциала – вторичный вызванный по-
тенциал (ВВП) имеет более длительный латентный период и может начинаться с отрицательного отклонения, охватывает обширную область коры. Регистрация ВП может служить для клинической диагностики сохранности периферических сенсорных и подкорковых путей (например, слуховых, зрительных).
Помимо вышеуказанных методов исследования центральной нервной системы, с давних времен существовал
метод экстирпации (или удаления) и перерезки мозга на разных уровнях. Метод экстирпации позволяет как в условиях острого, так и хронического эксперимента изучить те функции, которые сохранились или соответственно исчезли после удаления какого-либо отдела мозга.
179

Рис. 3.19. Регистрация вызванных потенциалов коры больших полушарий головного мозга кошки:
I – cхема вызванных потенциалов коры больших полушарий кошки:
а – первичный ответ (ПО): 1 – отметка раздражения, 2 – латентный период, 3 – положительная фаза, 4 – отрицательная фаза, 5 – следовой потенциал;
б– вторичный ответ (ранняя отрицательная реакция – РОР):
1– отметка раздражения, 2 – латентный период, 3 – отрицательная фаза, 4 – положительная фаза, 5 – отрицательная следовая фаза;
II – запись:
а– ПО, б – РОР (зарегистрированы в первой соматосенсорной зоне коры больших полушарий кошки при раздражении контрлатерального
седалищного нерва)
180
Методика перерезки мозга на разных уровнях дает воз-
можность получить сведения о функции, например, спинального животного, у которого перерезка произведена между спинным и вышележащими отделами мозга, а также изучить связь последних со спинным мозгом.
Кроме экстирпации обширных частей мозга для изучения функций определенных его участков, применяют метод
локального или ограниченного повреждения нервных цен-
тров, используя тонкие электроды, через которые пропускают постоянный электрический ток, вызывающий электролитическое разрушение тканей, которое можно вызвать также с помощью лучей лазера или введением с помощью микропипетки и ионофореза какого-либо вещества (растворы солей, алкоголь).
Метод раздражения различных участков мозга слабым электрическим током использовался еще на лягушках в лаборатории И.М. Сеченова в 1870 г. Если локально раздражать кору больших полушарий у высших животных или у человека во время нейрохирургических операций, которые проводятся под местной анестезией, то можно вызвать сокращения отдельных групп мышц и сообщения оперируемого о различных ощущениях в ответ на раздражения (тепла, холода, звука, света и т.д.).
Если использовать метод вживленных электродов в
различные подкорковые структуры мозга, то в условиях хронического эксперимента на животном можно в течение длительного времени, раздражая электрическим током небольшой силы через электроды тот или иной центр мозга, наблюдать за изменениями в поведении животного. Так, с помощью метода вживленных электродов с последующим раздражением подкорковых структур были обнаружены различные эмоциональные центры в гипоталамусе: страха, ярости, удовольствия и т.д. Для точного введения электродов, микропипеток, термопар в глубокорасположенные структуры мозга используется стереотаксическая техника (stereos –
объемный, taxis – расположение) (рис. 3.20).
181

Рис. 3.20. Стереотаксическая установка для проведения опытов на животных и нейрохирургических операций на мозге человека (по С.А. Чесноковой):
1 – электрод; 2 – ушные держатели; 3 – фиксаторы верхней челюсти; 4 – череп кошки и человека
Предварительно на многочисленных анатомических срезах изучалось пространственное расположение определенных структур мозга относительно к черепу, используя трехкоординатную систему и устройство для перемещения микроэлектрода во фронтальной, сагиттальной и вертикальной плоскостях, а также стереотаксические атласы для каждого вида животного и отдельно для человека (рис. 3.21). Этот метод позволяет раздражать заданную подкорковую структуру мозга, регистрировать ее электрическую активность, разрушать, вводить в нее химические вещества.
182

Рис. 3.21. Фронтальный срез мозга кошки с осями координат и буквенными обозначениями подкорковых структур мозга (из атласа Джаспера и Аймон-Марсана)
За последние десятилетия широкое распространение в изучении мозга получил метод культивирования нервной ткани и переживающих срезов мозга. Культура нервной тка-
ни и клеток – это модельная система, позволяющая в условиях in vitro (вне организма), при полной изоляции от влияний других структур мозга и организма в целом, в отсутствие афферентного входа изучать в течение длительного времени механизмы развития и созревания нейронов, их дифференцировку и поведение. Это перспективная модель для исследования проблем деления, регенерации и трансплантации нервных клеток, а также поиска и изучения биологически активных веществ, действующих непосредственно на нервную ткань. Культура нервной ткани находит все более широкое применение для изучения патогенеза различных заболе-
183
ваний нервной системы. Диссоциированная (суспензия отдельных нервных клеток) культура клеток мозга, вероятно, в дальнейшем будет использована для решения вопросов
клонирования линии клеток.
Другая нейрональная модель – переживающий срез мозга млекопитающих толщиной 300–500 мкм, взятый у взрослого животного (мыши, крысы) и помещенный на 40– 60 мин. в солевой, оксигенированный карбогеном (95% О2 и 5% СО2) раствор, идентичный по составу плазме крови, который способен оставаться функционально активным в течение нескольких часов. Это означает, что нейроны в срезе генерируют импульсную активность, идентичную по своим частотным и амплитудным характеристикам той, которая зарегистрирована в условиях in vivo (в организме). На этой модели с успехом изучаются механизмы влияния различных экстремальных факторов: холод, тепло, гипоксия, электромагнитное и лазерное излучение, а также биоритмы и действие биологически активных веществ на уровне изолированной нервной ткани и одного нейрона.
Гематоэнцефалический барьер
Термин «гематоэнцефалический барьер» (от греч. haima – кровь, encephalon – мозг) был предложен Л.С. Штерн и Р. Готье в 1921 г. Гематоэнцефалический барьер (ГЭБ) принадлежит к числу внутренних или гистогематических барьеров (гематоофтальмического, легочного, перикардиального, перитонеального и др.), которые отгораживают непосредственную питательную среду отдельных органов от универсальной внутренней среды – крови. Было показано, что если ввести витальную краску – трипановый синий в кровеносное русло, то при интенсивном окрашивании всех органов не окрашенной остается только центральная нервная система. Краска была обнаружена только в эпителиальных клетках сосудистых сплетений. Вещества оказываются эффективными лишь при введении их непосредственно в цереброспинальную жидкость.
184
Гематоэнцефалический барьер – это комплексный физиологический механизм, находящийся в центральной нервной системе на границе между кровью и нервной тканью и регулирующий поступление из крови в цереброспинальную жидкость и нервную ткань циркулирующих в крови веществ.
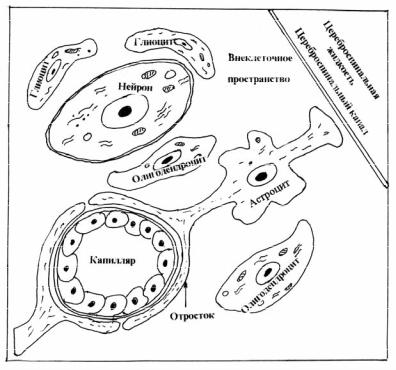
Морфологическое строение ГЭБ. Капилляры мозга отличаются тем, что эндотелиальные клетки не обладают ни порами, ни фенестрами. Соседние клетки черепицеобразно накладываются одна на другую. В области стыков клеток находятся замыкательные пластинки. Базальная мембрана имеет трехслойное строение и содержит мало перицитов. Главное отличие этой структуры – наличие глиальных элементов, расположенных между кровеносным сосудом и нейроном (рис. 3.22). Отростки астроцитов формируют своеобразный футляр вокруг капилляра, что исключает проникновение веществ в мозговую ткань, минуя глиальные элементы. Имеются перинейрональные глиоциты, находящиеся в тесном контакте с нейронами. В состав ГЭБ входит внеклеточное пространство, заполненное основным аморфным веществом углеводно-белковой природы (мукополисахариды и мукопротеины).
Функции гематоэнцефалического барьера:
1.Защитная – заключается в задержке доступа из крови в нервную ткань различных веществ, которые могут оказать повреждающее действие на мозг.
2.Регуляторная – регулирует состав и постоянство цереброспинальной жидкости. Даже при изменении состава крови константы цереброспинальной жидкости остаются стабильными.
ГЭБ работает как селективный фильтр, пропускающий
вцереброспинальную жидкость одни вещества и не пропускающий другие, которые могут циркулировать в крови, но чужды мозговой ткани.
Так, не проходят через ГЭБ адреналин, норадреналин, ацетилхолин, дофамин, серотонин, гамма-аминомасляная кислота (ГАМК), пенициллин, стрептомицин. Билирубин всегда находится в крови, но никогда, даже при желтухе, он
185
не проходит в мозг, оставляя неокрашенной лишь нервную ткань. Поэтому трудно получить эффективную концентрацию какого-либо лекарственного препарата, вводимого в
кровь, чтобы оно достигло паренхимы мозга. Проходят через ГЭБ морфий, атропин, бром, стрихнин, кофеин, эфир, уретан, алкоголь и гамма-оксимасляная кислота (ГОМК). При лечении, например, туберкулезного менингита стрептомицин вводят непосредственно в цереброспинальную жидкость, минуя барьер с помощью люмбальной пункции.
Рис. 3.22. Гематоэнцефалический барьер
Необходимо учесть необычность действия многих веществ, введенных непосредственно в цереброспинальную жидкость. Трипановый синий при введении в цереброспинальную жидкость вызывает судороги и смерть, аналогичное
186
действие оказывает желчь. Ацетилхолин, введенный непосредственно в мозг, действует как адреномиметик, наоборот, адреналин – как холиномиметик: артериальное давление понижается, возникает брадикардия, температура тела вначале снижается, а потом повышается. Он вызывает наркотический сон, заторможенность и аналгезию. Ионы К+ выступают в качестве симпатомиметика, а Са2+ – парасимпатомиметика. Лобелин – рефлекторный стимулятор дыхания, проникая через ГЭБ, вызывает ряд побочных реакций (головокружение, рвоту, судороги). Инсулин при внутримышечных инъекциях снижает содержание сахара крови, а при непосредственном введении в цереброспинальную жидкость вызывает его повышение.
Защитная функция ГЭБ менее развита к моменту рождения и в раннем возрасте, формируясь в постнатальном периоде. Поэтому у ребенка при различных заболеваниях часто появляются судороги и значительно повышается температура тела, что указывает на легкое проникновение в цереброспинальную жидкость токсических веществ, которые у взрослого человека не проникают.
Факторы, повышающие проницаемость гематоэнцефалического барьера:
1.Нарушение анатомической структуры мозга.
2.Введение некоторых лекарственных препаратов (например антибиотиков) вместе с гиалуронидазой или гистамином.
3.Длительная бессонница и голодание, усиленная мышечная работа (переутомление).
4. Низкая (34о С) или высокая температура тела (42– 43о С).
5.Алкалоз (рН до 7,7) и ацидоз (рН до 6,6).
6.Введение гипер- и гипотонических растворов в кровь.
7.Наркоз (эфир, уретан, хлоралгидрат) нарушает проницаемость ГЭБ для сахара, поэтому после наркоза его много
вцереброспинальной жидкости.
Цереброспинальная жидкость (ЦСЖ). Цереброспи-
нальная жидкость образуется сосудистым сплетением, эле-
187
ментами мягкой мозговой оболочки, эпендимой желудочков, клетками паренхимы мозга, в ее продукции принимают участие нейроны и глия.
Ток ЦСЖ: из желудочков мозга (боковые желудочки, III желудочек) жидкость через отверстие Мажанди и Лушка поступает в IV желудочек и в подмозжечковые цистерны, затем в цистерны основания мозга на его выпуклую поверхность, подпаутинное пространство и в центральный канал спинного мозга, после чего через венозный синус она оттекает в кровь.
Количество ЦСЖ составляет от 100 до 150 мл, суточное количество может достигать 600 мл, при травмах черепа – до 1000 мл. Состав ЦСЖ обновляется до 5–10 раз в сутки. Давление ЦСЖ в горизонтальном положении – 100–200 мм вод. ст. Оно может увеличиваться при нарушении ГЭБ, при опухолях, отеке мозга и заболеваниях сердечно-сосудистой системы.
Удельный вес ЦСЖ – от 1001 до 1012, рН – 7,35–7,8. Количество воды – 90%, сухой остаток – 10%.
Из органических веществ большое значение имеет белок – 15–30 мг%. Обычно определяют коэффициент Кафки – отношение между глобулинами и альбуминами. В норме он равен 0,2–0,3, но может изменяться при менингитах, прогрессивном параличе и других заболеваниях мозга. Остаточный азот – 12–18 мг%, глюкоза– 38–70 мг%, холестерин – 0,1–0,4 мг%. Кроме того, в ЦСЖ содержатся аминокислоты, мочевина, мочевая кислота.
Из неорганических веществ диагностическое значение в клинике имеют хлориды (норма 720–740 мг%), их количество снижается при менингитах (до 600 мг%) и алкалозе (до 240 мг%). В ЦСЖ содержатся железо, калий, кальций, магний и др.
ВЦСЖ могут находиться некоторые гормоны: АКТГ, гонадотропин, меланофорный гормон, окситоцин, вазопрессин и медиатор ацетилхолин.
Внорме в ликворе от 0 до 5 форменных элементов (в основном лимфоциты) в 1 мм3, свыше 10 – патология.
188
