
- •Глава 1. Основы теоретических представлений в органической химии
- •1.1. Учение а.М. Бутлерова
- •1.2. Теория гибридизации атомных орбиталей
- •1.3. Ковалентная связь
- •1.3.3. Водородные связи
- •1.4. Теория электронных смещений
- •1.5. Классификация и номенклатура органических соединений
- •1.5.1. Заместительная номенклатура
- •1.5.2. Радикало-функциональная номенклатура
- •1.5.4. Рациональная Номенклатура
- •1.6. Представление о Кислотно-оснÓвных свойствах органических соединений
- •1.7. Основы стереохимии
- •1.7.1. Оптическая изомерия
- •1.7.2. Геометрическая изомерия
- •1.7.3. Конформационная изомерия
- •1.8. Классификация органических реакций. Понятие о механизме реакций. Растворители и катализаторы
- •1.9. Методы идентификации органических соединений. Основные физические константы
- •1.10. Методы разделения и очистки органических веществ
- •1.10.1. Разделение твёрдых смесей и очистка твёрдых веществ
- •1.10.2. Разделение жидких смесей и очистка жидкостей
- •1.11. Представление о биологическом действии и метаболизме органических соединений
- •Глава 2. Алканы
- •2.1. Номенклатура. Изомерия
- •2.2. Строение
- •2.3. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Реакции радикального замещения
- •2.4.2. Реакции дегидрирования и разложения
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •2.6. Применение и физиологическая роль
- •Глава 3. Функциональные производные алканов
- •3.1. ОбщноСть Химических свойств
- •3.1.1. Реакции нуклеофильного замещения
- •3.1.2. Реакции отщепления (элиминирования)
- •3.2. Галогеналканы
- •3.2.1. Классификация, номенклатура, изомерия
- •3.2.2. Строение и свойства
- •3.2.3. Способы получения
- •3.2.4. Полигалогеналканы
- •3.2.5. Физиологическая роль и Важнейшие представители
- •3.3. Насыщенные спирты
- •3.3.1. Классификация, номенклатура, изомерия
- •3.3.2. Строение и физические свойства
- •3.3.3. Химические свойства
- •3.3.4. Способы получения
- •3.3.5. Многоатомные спирты
- •3.3.6. Физиологическое действие
- •3.3.7. Важнейшие представители
- •3.4. Простые насыщенные эфиры
- •3.4.1. Номенклатура и изомерия
- •3.4.2. Физические и химические свойства
- •3.4.3. Способы получения
- •3.4.4. Циклические простые эфиры
- •3.4.5. Физиологическая роль и Важнейшие представители
- •3.5. Эфиры минеральных кислот
- •3.5.1. Эфиры серной кислоты
- •3.5.2. Эфиры фосфорной кислоты
- •3.6. Тиоспирты и тиоэфиры
- •3.7. Насыщенные амины
- •3.7.1. Классификация, номенклатура, изомерия
- •3.7.2. Физические свойства
- •3.7.3. Строение и химические свойства
- •3.7.4. Способы получения
- •3.7.5. Физиологическая роль и Важнейшие представители
- •3.8. Нитроалканы
- •3.8.1. Строение
- •3.8.2. Свойства
- •3.8.3. Способы получения
- •3.8.4. Физиологическое действие и Важнейшие представители
- •3.9. Кремний-, фосфор- и мышьякорганические соединения
- •3.9.1. Кремнийорганические соединения
- •3.9.2. Фосфорорганические соединения
- •3.9.3. Мышьякорганические соединения
- •Глава 4. Непредельные углеводороды
- •4.1. ОБщность строения и химических свойств
- •4.1.1. Реакции электрофильного присоединения
- •4.1.2. Реакции радикального присоединения
- •4.1.3. Реакции радикального замещения
- •4.1.4. Другие реакции
- •4.2. Этиленовые углеводороды
- •4.2.1. Номенклатура, изомерия
- •4.2.2. Физические свойства
- •4.2.3. Химические свойства
- •4.2.4. Способы получения
- •4.2.5. Физиологическое действие и Важнейшие представители
- •4.3. Диеновые (и полиеновые) углеводороды
- •4.3.1. Классификация, номенклатура
- •4.3.5. Способы получения
- •4.3.6. Важнейшие представители
- •4.4. Ацетиленовые углеводороды
- •4.4.1. Номенклатура, изомерия
- •4.4.2. Особенности строения и свойств
- •4.4.3. Способы получения
- •4.4.4. Физиологическое действие и Важнейшие представители
- •Глава 5. Функциональные производные непредельнЫх углеводороДов
- •5.1. ОБщность строения и химических свойств
- •5.1.1. Классификация
- •5.1.2. Субстраты винильного типа
- •5.1.3. Субстраты аллильного типа
- •5.2. Галогеналкены
- •5.2.1. Винилгалогениды
- •5.2.2. Аллилгалогениды
- •5.2.3. Способы получения
- •5.2.4. Важнейшие представители
- •5.3. Непредельные спирты и эфиры
- •5.3.1. Виниловый спирт и его эфиры
- •5.3.2. Аллиловый и пропаргиловый спирты
- •5.3.3. Способы получения
- •5.3.4. Важнейшие представители
- •Глава 6. Алифатические альдегиды, кетоны и карбоновые кислоты
- •6.1. Насыщенные альдегиды и кетоны
- •6.1.1. Изомерия, номенклатура
- •6.1.2. Строение карбонильной группы
- •6.1.3. Физические свойства
- •6.1.4. Химические свойства
- •6.1.5. Способы получения
- •6.1.6. Физиологическая роль
- •6.1.7. Важнейшие представители
- •6.2. Непредельные альдегиды и кетоны
- •6.2.1. Кетен
- •6.2.2. Непредельные карбонильные соединения
- •Примерами соединений с сопряжёнными -связями являются
- •6.2.3. Важнейшие представители
- •6.3. Дикарбонильные соединения
- •6.3.3. Важнейшие представители
- •6.4. Насыщенные монокарбоновые кислоты и их производные
- •6.4.1. Номенклатура
- •6.4.2. Строение функциональной группы
- •6.4.3. Физические свойства
- •6.4.4. Химические свойства
- •6.4.5. Способы получения
- •6.4.6. Пероксикарбоновые кислоты и ацилпероксиды
- •6.4.7. Физиологическая роль и Важнейшие представители
- •6.5. Непредельные монокарбоновые кислоты
- •6.5.1. Номенклатура, изомерия
- •6.5.2. Строение
- •6.5.3. Химические свойства
- •6.5.4. Способы получения
- •6.5.5. Физиологическая роль и Важнейшие представители
- •6.5.6. Омыляемые липиды
- •6.6. Дикарбоновые кислоты и их производные
- •6.6.1. Особенности химического поведения
- •6.6.2. Малоновый эфир и синтезы на его основе
- •2 H5c2ooc-ch2-cooc2h5
- •2 H5c2ooc-ch2-cooc2h5
- •6.6.3. Способы получения
- •2 Rooc-(ch2)n-сoo¯ 2 rooc-(ch2)n-сoo rooc-(ch2)2n-coor hooc-(ch2)2n-cooh
- •6.6.4. Важнейшие представители
- •6.7. Гидроксикислоты
- •6.7.1. Классификация, номенклатура, изомерия
- •6.7.2. Химические свойства
- •6.7.3. Способы получения
- •6.7.4. Физиологическая роль и Важнейшие представители
- •6.8. Оксокислоты
- •6.8.1. Особенности химического поведения
- •6.8.2. Ацетоуксусный эфир и синтезы на его основе
- •6.8.3. Способы получения
- •6.8.4. Важнейшие представители
- •6.9. Аминокарбоновые кислоты. Пептиды
- •6.9.1. Классификация, номенклатура, изомерия аминокислот
- •6.9.2. Строение, физические и Химические свойства
- •6.9.3. Способы получения аминокислот
- •6.9.4. Важнейшие представители аминокислот
- •6.9.5. Пептиды
- •Глава 7. Углеводы
- •7.1. Моносахариды
- •7.1.1. Изомерия, номенклатура
- •7.1.2. Химические свойства
- •7.1.3. Важнейшие представители моносахаридов и их производных
- •7.2. Олигосахариды
- •7.2.1. Классификация и номенклатура дисахаридов
- •7.2.2. Химические свойства дисахаридов
- •7.2.3. Важнейшие представители дисахаридов
- •7.3. Полисахариды
- •7.3.1. Целлюлоза
- •7.3.2. Амилоза и амилопектин
- •7.3.3. Гликоген
- •7.3.4. Декстраны
- •7.3.5. Хитин
- •7.3.6. Пектовая кислота
- •7.3.7. Гетерополисахариды
- •Глава 8. Алициклические углеводороды и их производные
- •8.1. Номенклатура моно- и бициклических соединений
- •8.2. Пространственное строение и изомерия циклоалканов
- •8.2.1. Циклопропан
- •8.2.2. Циклобутан
- •8.2.3. Циклопентан
- •8.2.4. Циклогексан
- •8.3. Химические свойства
- •8.3.1. Реакции циклопропана, циклопропена и их производных
- •8.3.2. Реакции циклобутана и его производных
- •8.3.3. Реакции средних циклов
- •8.3.4. Реакции изомеризации цикла
- •8.4. Способы получения циклоалканов
- •8.5. Терпены и терпеноиды. Каротиноиды
- •8.5.1. Ациклические терпены и терпеноиды
- •8.5.2. Моноциклические терпены и терпеноиды
- •8.5.3. Бициклические терпены и терпеноиды
- •8.5.4. Каротиноиды
- •8.6. Физиологическая роль и важнейшие представители
- •8.7. Стероиды
- •Глава 9. Бензол. Ароматичность. Углеводороды ряда бензола
- •9.1. Строение бензола
- •Тепловой эффект реакции гидрирования бензола составляет
- •9.2. Номенклатура и изомерия аренов
- •9.3. Строение аренов
- •9.3.1. Строение толуола
- •9.3.2. Строение винилбензола
- •9.4. Физические свойства
- •9.5. Химические Свойства
- •9.5.1. Химические свойства бензола
- •9.5.2. Химические свойства аренов
- •9.6. Способы получения
- •9.7. Физиологическое действие и важнейшие представители аренов
- •9.8. Небензоидные ароматические системы
- •Глава 10. Функциональные производные углеводородов ряда бензола
- •10.1. Общность строения и свойств монозамещённых бензолов
- •10.1.1. Электронные эффекты заместителей
- •10.1.2. Реакции электрофильного замещения
- •10.1.3. Реакции нуклеофильного замещения
- •10.2. Галогенарены
- •10.2.1. Классификация, номенклатура
- •10.2.2. Строение арилгалогенидов
- •10.2.3. Физические свойства
- •10.2.4. Химические свойства
- •10.2.5. Способы получения
- •10.2.6. Важнейшие представители
- •10.3. Ароматические сульфокислоты
- •10.3.1. Номенклатура
- •10.3.2. Строение
- •10.3.3. Физические и химические свойства
- •10.3.4. Способы получения
- •10.3.5. Производные сульфокислот
- •10.3.6. Медико-биологическое значение и Важнейшие представители
- •10.4. Ароматические нитросоединения
- •10.4.1. Строение нитробензола
- •10.4.2. Физические свойства
- •10.4.3. Химические свойства
- •10.4.4. Способы получения
- •10.4.5. Физиологическое действие и Важнейшие представители
- •10.5. Фенолы. Ароматические спирты. Хиноны
- •10.5.1. Классификация, номенклатура, изомерия фенолов и ароматических спиртов
- •10.5.2. Строение фенола и бензилового спирта
- •Ароматические амины и продукты неполного восстановления нитросоединений
- •10.6.1. Классификация, номенклатура, изомерия ароматических аминов
- •10.6.2. Строение анилина
- •10.6.3. Физические и химические свойства ароматических аминов
- •10.6.4. Способы получения ароматических аминов
- •10.6.5. Важнейшие представители ароматических аминов
- •10.6.6. Продукты неполного восстановления нитросоединений
- •10.7. Ароматические диазосоединения
- •10.7.2. Механизм образования солей арендиазония и строение катиона бензолдиазония
- •10.7.3. Амфотерность диазосоединений
- •10.7.4. Реакции солей арендиазония
- •10.8. Ароматические альдегиды и кетоны
- •10.9. Ароматические карбоновые кислоты и их производные
- •10.10. Физиологическая роль функциональных производных бензола
- •Глава 11. Полициклические ароматические углеводороды и их производные
- •11.1. Классификация углеводородов с конденсированными циклами
- •11.2. Нафталин
- •11.2.1. Строение, изомерия, номенклатура
- •11.2.2. Свойства
- •11.2.3. Способы получения
- •11.2.4. Важнейшие представители
- •11.3. Антрацен
- •11.3.1. Строение, изомерия, номенклатура
- •11.3.2. Свойства
- •Продукт исчерпывающего гидрирования (пергидроантрацен) можно получить, проводя реакцию в жёстких условиях с применением металлических катализаторов.
- •11.3.3. Способы получения
- •11.3.4. Важнейшие представители
- •11.4. Фенантрен
- •11.4.1. Строение, изомерия, номенклатура
- •11.4.2. Свойства
- •11.4.3. Способы получения
- •11.5. Физиологическое действие полициклических углеводородов
- •Глава 12. Гетероциклические соединения
- •12.1. Классификация и номенклатура
- •12.2. Пятичленные гетероциклические
- •12.2.1. Номенклатура пиррола, фурана и тиофена и их производных
- •12.2.2. Строение пиррола, фурана и тиофена
- •12.2.3. Физические и химические свойства пиррола, фурана и тиофена
- •12.2.4. Особенности индола
- •12.2.5. Способы получения пиррола, фурана, тиофена, индола
- •12.2.6. Важнейшие представители и медико-биологическое значение
- •12.3. Пятичленные гетероциклические
- •12.3.1. Номенклатура имидазола и пиразола
- •12.3.2. Строение имидазола и пиразола
- •12.3.3. Физические и химические свойства имидазола и пиразола
- •12.3.4. Способы получения
- •12.3.5. Важнейшие представители и медико-биологическое значение
- •12.4. Шестичленные гетероциклические
- •12.4.1. Номенклатура пиридина и его производных
- •12.4.2. Строение пиридина
- •12.4.3. Химические свойства пиридина
- •Но если оба -положения заняты, то замещается водород в-положении. При нагревании с избытком амида натрия можно получить 2,6-диаминопиридин.
- •12.4.4. Особенности химического поведения пиколинов и функциональных производных пиридина
- •12.4.5. Хинолин и изохинолин
- •12.4.7. Способы получения
- •Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
- •12.4.8. Важнейшие представители и медико-биологическое значение
- •12.5. Шестичленные гетероциклические
- •12.5.1. Строение и свойства диазинов
- •12.5.2. Пурин
- •12.5.3. Способы получения
- •12.5.4. Важнейшие представители и медико-биологическое значение
- •12.5.5. Нуклеозиды, нуклеотиды и нуклеиновые кислоты
- •12.6. Алкалоиды
4.2.2. Физические свойства
По физическим свойствам алкены близки к алканам, однако их температуры кипения несколько ниже, а плотности несколько выше, чем у соответствующих предельных углеводородов. Бóльшая плотность объясняется пространственным строением алкенов, у которых этиленовый фрагмент является плоским, а -связи sp2-гибридизованных углеродных атомов имеют меньшую длину, чем -связи атомов углерода в sp3-гибридизации алканов. Поэтому алкены имеют более плотную упаковку молекул, чем алканы. Но при такой плотной упаковке происходит сближение электронов -связей, и силы межмолекулярного отталкивания возрастают. Этим можно объяснить их более низкую температуру кипения, чем для алканов.
Первые три члена гомологического ряда — газы; углеводороды, имеющие от 5 до 15 атомов углерода, — жидкости; высшие — твёрдые вещества.
Газы и жидкости имеют характерный резкий запах, в воде растворимы плохо, но лучше, чем алканы (более поляризуемы).
4.2.3. Химические свойства
Химическое поведение алкенов во многом определяется наличием в их молекулах двойной связи, поэтому наиболее типичными для этих углеводородов являются рассмотренные в главе 4.1 реакции электрофильного и радикального присоединения, а также радикального замещения.
Однако особенности строения, отличающие эти углеводороды, например, от ацетиленовых (плоское расположение атомов углерода этиленового фрагмента), могут быть причиной некоторых свойств, не характерных для углеводородов с тройной связью.
4.2.3.1. Реакции электрофильного присоединения
1. Присоединение галогенов — это один из наиболее типичных случаев электрофильного присоединения. Бром и хлор присоединяются к алкенам по схеме:
R-CH=CH-R + X2 R-CHX-CHX-R
Эта реакция представляет собой ступенчатый процесс, и механизм её не противоречит общей схеме реакций электрофильного присоединения. Покажем это на реакции присоединения брома.
Молекула брома поляризуется в результате приближения к -электронному облаку двойной связи:

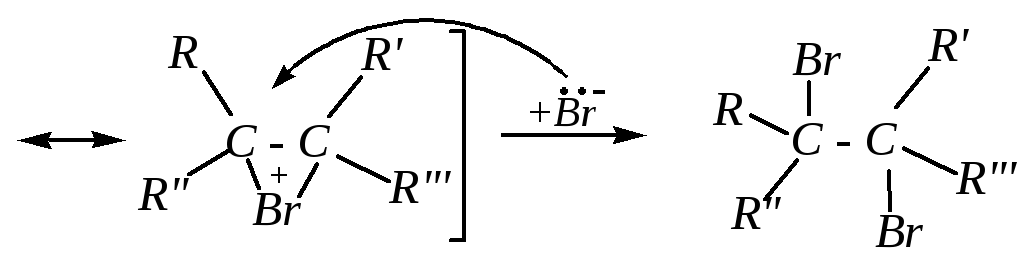
Как уже упоминалось, лимитирующей стадией AdЕ-реакций является образование карбокатиона, а последующая атака бромид-ионами осуществляется очень быстро (электростатическое взаимодействие). Поэтому при проведении реакции в присутствии других нуклеофилов возможно присоединение не только бромид-ионов, но и других анионов из реакционной среды и образование, таким образом, смеси продуктов:
 и
т.д.
и
т.д.
Присоединение хлора к разветвлённым алкенам имеет свои особенности. Так, реакция изобутилена с хлором не укладывается в общую схему. Карбокатион, образовавшийся на первой стадии, выбрасывает протон, и в результате преимущественно образуется непредельное соединение:
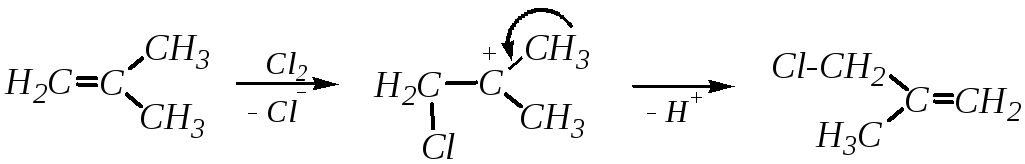
изобутилен (2-метилпропен) 3-хлор-2-метилпропен
2. Присоединение галогеноводородов — другой пример АdЕ-реакций. К двойным связям присоединяются все галогеноводороды. Электрофильный механизм этой реакции наблюдается только в отсутствие пероксидов. Чаще всего мостиковый интермедиат (см. выше) здесь не образуется, а реакция идёт только через образование открытого карбокатиона. Лёгкость взаимодействия алкенов с галогеноводородами возрастает в ряду: HF < HCl < HBr < HI (то есть по мере увеличения кислотных свойств).
Схему присоединения к углеводородам с концевым расположением двойной связи можно представить следующим образом:
R-CH=CH2 + НХ R-CHX-CH3
Здесь формально соблюдается правило Марковникова (гл. 4.1.1).
Если в исходном соединении присутствует электроноакцепторный заместитель (например, -CN, -COOH, -CF3), то происходит поляризация кратной связи в обратном направлении:
![]()
Но эти соединения относятся не к алкенам, а лишь к их производным, поэтому и правило Марковникова к таким соединениям неприменимо.
3. Присоединение воды к двойной углерод-углеродной связи алкенов протекает в присутствии кислотных катализаторов. Таким образом, первой стадией является электрофильная атака протона, и, значит, механизм этой реакции фактически тот же, что и для присоединения галогеноводородов; различия наблюдаются только на стадии взаимодействия карбокатиона с нуклеофильной частицей (в данном случае это молекула воды):
R-CH=CH2
+ Н+
R-CH+-CH3
![]() R-CHОН-CH3
+
Н+
R-CHОН-CH3
+
Н+
При промышленной гидратации этилена в качестве катализатора используют систему Н3PO4 / SiO2 при температуре около 570 К и давлении 7 МПа.
4. Гидроборирование — это реакция присоединения бороводорода. Она имеет препаративное значение, так как этим способом можно получать из алкенов первичные спирты. Бороводород существует в виде димера B2Н6, но схему реакции присоединения можно представить так:
R-CH=CH2 + BН3 R-CH2-CH2-BH2
алкилборан
Возможно дальнейшее превращение в избытке алкена с образованием триалкилборана, который легко окисляется и затем подвергается гидролизу:
R-CH2-CH2-BH2 + 2 R-CH=CH2 (R-CH2-CH2-)3B
(R-CH2-CH2-)3B
![]() (R-CH2-CH2-О-)3B
(R-CH2-CH2-О-)3B
(R-CH2-CH2-О-)3B
![]() R-CH2-CH2OH
+
Н3BО3
R-CH2-CH2OH
+
Н3BО3
Механизм взаимодействия алкена с бораном — типичное электрофильное присоединение, в котором электрофильной частью реагента (борана) является атом бора как более электроположительный по отношению и к водороду, и к углероду. При этом, вероятно, образуется четырёхцентровое переходное состояние:

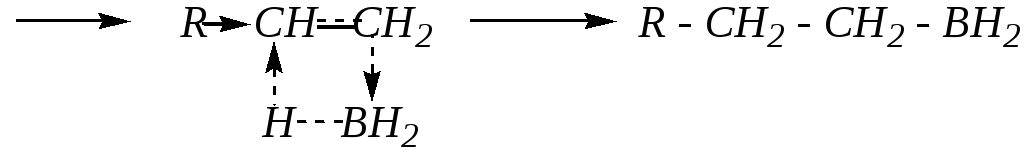
Взаимодействие алкилборана со следующей молекулой алкена осуществляется аналогично: в этой реакции электрофилом является молекула алкилборана:
![]()
Реакция гидроборирования ненасыщенных органических соединений была открыта в 1959 году Гербертом Чарльзом Брауном, за что он был удостоен Нобелевской премии по химии в 1979 году.
Аналогично рассмотренным примерам протекает кислотно-катализируемое присоединение спиртов (электрофилом является Н+) и присоединение хлорноватистой и бромноватистой кислот (реакция гипогалогенирования). В последних случаях электрофилами являются катионы галогенов Cl+ и Br+, образующиеся в присутствии сильной кислоты по схеме:
HOCl + Н+ H2O+-Cl Cl + + H2O
Реакции электрофильного присоединения нашли широкое применение в препаративной органической химии как способы получения из алкенов галогеналканов и спиртов (первичных, вторичных и третичных).
4.2.3.2. Реакции радикального присоединения
Наиболее распространённой из реакций радикального присоединения является взаимодействие алкенов с бромоводородом:
R-CH=CH2
+ HBr
![]() R-CH2-CH2-Br
R-CH2-CH2-Br
Эта реакция идёт по радикальному механизму только в присутствии пероксидов. На стадии инициирования данного радикального процесса образуется атом брома:
R-O-O-R 2 R-O
R-O + H:Br R-OH + Br ,
являющийся свободным радикалом и атакующий молекулу алкена с образованием -комплекса (см. механизм в гл. 4.1.2).
В результате при присоединении к несимметричным алкенам атом брома образует связь с менее замещённым атомом углерода, то есть присоединение идёт как бы «против правила Марковникова»:

Это направление присоединения объясняется влиянием нескольких факторов: образованием более стабильного радикала, доступностью менее замещённого атома углерода, большей величиной электронной плотности на этом атоме. При этом основное влияние, по-видимому, оказывает стерический фактор. Устойчивость радикальных интермедиатов обычно изменяется в том же порядке, что и катионных: третичный > вторичный > первичный, но этот фактор оказывает меньшее влияние на направление реакции, чем стерический.
Присоединение других галогеноводородов нехарактерно для алкенов. Эта реакция с галогеноводородами (кроме HBr) энергетически невыгодна. Присоединение хлороводорода протекает в редких случаях. При обычных температурах эта цепная реакция не выдерживает конкуренции с АdЕ-реакцией.
Радикальное присоединение HF и HI никогда не наблюдается. В случае фтороводорода для образования радикала F требуется слишком большое количество энергии на стадии взаимодействия радикального интермедиата с HF, а в случае присоединения йодоводорода, хотя радикал I образуется легко, однако он недостаточно реакционноспособен.
4.2.3.3. Реакции радикального замещения
В эти реакции могут вступать как пропен, так и другие гомологи этена, имеющие хотя бы один -водородный атом. Как рассматривалось в главе 4.1.3, замещение идёт только по -атому. Пример:

4.2.3.4. Изомеризация
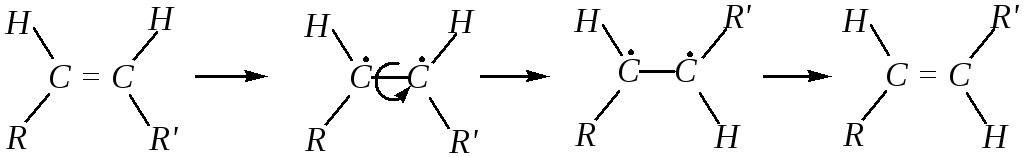
Реакция изомеризации, характерная только для углеводородов с двойной связью, — это цис-транс-изомеризация, то есть превращение одного геометрического изомера в другой. Данная реакция протекает при действии света, хотя не исключены какие-либо другие воздействия. При этом в молекулах алкенов разрываются -связи и образуются бирадикалы. Это создаёт возможность свободного вращения обеих частей молекулы вокруг -связи. После прекращения облучения -связь вновь образуется, однако в полученной смеси резко преобладают транс-изомеры:
4.2.3.5. Реакции нуклеофильного присоединения
Этиленовые углеводороды не вступают в реакции нуклеофильного присоединения из-за высокой электронной плотности -связи, однако соединения, содержащие этиленовый фрагмент и несколько сильных электроноакцепторных групп, например, -CN или -CF3, могут вступать во взаимодействие с нуклеофилами. При этом -электронная плотность сильно уменьшена как за счёт индуктивного, так и за счёт мезомерного эффектов заместителей (в случае трифторметильной группы это обратная гиперконъюгация):
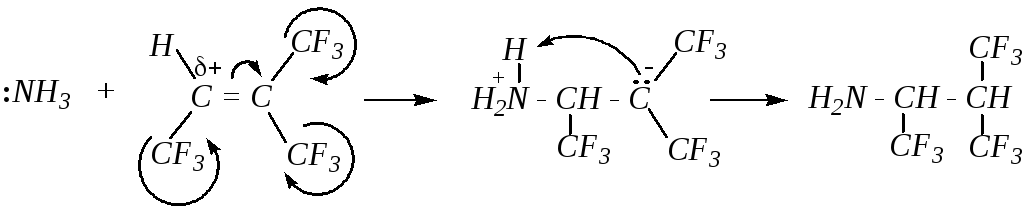
4.2.3.6. Теломеризация
Кроме рассмотренных в главе 4.1.4.2 реакций полимеризации, для алкенов получили распространение реакции теломеризации, которые протекают с участием веществ — переносчиков цепи, называемых телогенами, в результате образуется смесь низкомолекулярных гомологов — теломеров. Наиболее распространена радикальная теломеризация. Например, взаимодействие этилена с тетрахлоридом углерода протекает по схеме:
n CН2=CН2 + CCl4 Cl3C-(-CН2-CН2-)n-Cl
Здесь телогеном является тетрахлорметан, который на первой стадии распадается на радикалы:
CCl4 Cl + CCl3.
Образовавшийся трихлорметильный радикал является инициатором полимеризации, а обрыв цепи происходит за счёт отрыва атома хлора от новой молекулы тетрахлорметана:
CН2=CН2 + CCl3 Cl3C-CН2-ĊН2

4.2.3.7. Взаимодействие с солями платины
Как указывалось в главе 4.1.4.4, непредельные углеводороды способны к взаимодействию с катионами переходных металлов. Так, например, этилен легко взаимодействует с комплексными солями платины, как мягкое основание с мягкой кислотой (в соответствии с принципом Р. Пирсона), образуя устойчивую соль. Например:
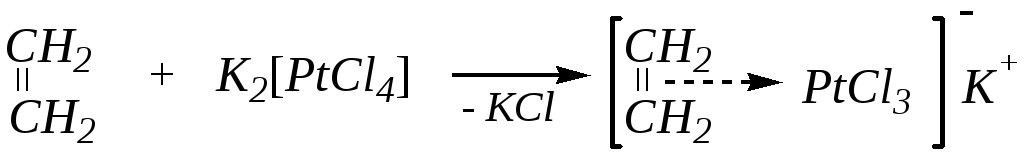
Таким образом, алкены могут быть охарактеризованы с помощью химических реакций. С тетранитрометаном они образуют окрашенные в жёлтый цвет комплексы с переносом заряда. Для доказательства строения алкенов можно использовать окисление до двухатомных спиртов с последующим расщеплением гликоля, а также озонолиз. Кроме того, как все непредельные углеводороды, они на холоду обесцвечивают щелочной раствор перманганата калия или раствор брома в хлороформе.
