
- •Программа курса
- •Тема 1. Моль. Эквиваленты простых и сложных веществ. Закон эквивалентов
- •Контрольные вопросы и задачи
- •Тема 2. Периодическая система элементов д.И. Менделеева
- •Контрольные вопросы и задачи
- •Тема 3. Химическая связь. Строение молекул Контрольные вопросы и задачи
- •Тема 4. Энергетика химических процессов. Внутренняя энергия. Энтальпия
- •Контрольные вопросы и задачи
- •Тема 5. Энтропия. Энергия Гиббса. Направленность химических реакций
- •Контрольные вопросы и задачи
- •Тема 6. Растворы
- •Контрольные вопросы и задачи
- •Тема 7. Окислитeльнo-вoccтaнoвитeльньIe реакции
- •Контрольные вопросы и задачи
- •Тема 8. Электрохимические системы. Электродные потенциалы. Электродвижущие силы. Химические источники тока
- •Контрольные вопросы и задачи.
- •Тема 9. Электролиз
- •Контрольные вопросы и задачи
- •Тема 10. Коррозия металлов
- •Контрольные вопросы и задачи.
- •Тема 11. Жесткость воды
- •Классификация воды по уровню жесткости
- •Решение.
- •Контрольные вопросы и задачи
- •Тема 12. Комплексные соединения
- •В соответствии с уравнением равновесия суммарной реакции диссоциации комплекса константу нестойкости можно выразить уравнением:
- •Контрольные вопросы и задачи
- •Приложение
- •Рекомендательный библиографический список
Тема 1. Моль. Эквиваленты простых и сложных веществ. Закон эквивалентов
В 1971году Генеральная конференция по мерам и весам утвердила в качестве единой из основных единиц Международной системы моль –единицу количества вещества. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится в углероде – 12массой0,012кг. При измерении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, эквивалентами, электронами и другими частицами или группами частиц. Один моль вещества содержит6,02∙1023структурных частиц (постоянная Авогадро). При применении понятия «моль» следует указывать какие структурные частицы имеются в виду, например, моль атомов ионов алюминия, моль эквивалентов гидроксида натрия, моль электронов и др. Масса моля атомов элемента, масса моля молекул вещества, масса моля ионов, масса моля эквивалентов называется мольной или молярной массой соответственно элементов, вещества, ионов, эквивалентов и выражается в граммах на моль килограммах на моль.
Пример1.
Выразите в молях: а) 6,02∙1022молекулH2O; б) 1,2∙1024атомов азота; в)2∙1023молекул СО. Чему равна мольная (молярная) массы названных веществ?
Решение.
Моль –это количество вещества, в котором содержится число частиц любого типа, равное постоянной Авогадро, т.е. 6,02∙1023, поэтому: а) 6,02∙1022молекул воды составят 0,1моля; б) 1,2∙1024атомов азота соответственно 2моля; в) 2∙1023молекул оксида углерода – 1/3моля. Мольная (молярная) масса вещества в граммах численно равна его относительной молярной массе, выраженной в атомных единицах массы (а.е.м.). В данном примере молекулярная масса воды – 18,азота – 28и оксида углерода – 28а.е.м. соответственно мольная масса воды –18 г/моль, азота –28 г/моль и оксида углерода –28 г/моль.
Пример 2.
Вычислить эквивалентную массу и мольную массу эквивалентов: натрия, кислорода, алюминия.
Решение.
Эквивалентом элемента (Э) называют такое его количество, которое соединяется с одним атомом (ионом) водорода или замещает его в реакциях. Массу одного эквивалента называют эквивалентной массой (mэ) и выражают в а.е.м., мольную массу эквивалентов (Мэ) выражают в граммах на моль. Эквивалентная масса элемента равна атомной массе элемента, деленной на его валентность:
mэ =А/В.
Мольная масса эквивалента элемента равна мольной массе элемента, деленной на валентность
Мэ =М/В.
Таким образом, эквивалентная масса натрия будет равна 23/1 = 23,кислорода 16/2 = 8и алюминия 27/3 = 9а.е.м. Соответственно мольная масса эквивалентов натрия 23 г/моль, кислорода 8 г/моль и алюминия 9 г/моль.
Пример 3.
Вычислить эквивалентную и мольную массы эквивалентов следующих веществ: а) Аl2О3; б) Н2SO4; в) Са(ОН)2.
Решение.
а) Эквивалентная масса оксида (mэ) равна его молекулярной массе (Мr), деленной на число атомов элемента и на валентность элемента, образующего оксид:
mэ =МrОкс/nВ;mэ(Al2О3) = 102/2∙3 = 17а.е.м.
Мольная масса эквивалента оксида равна его мольной (молярной) массе деленной на число атомов элемента, образующего оксид, и на валентность элемента:
Мэ(Аl2О3) = М(Аl203) / 2∙3 = 102/6 = 17г/моль.
б) Эквивалентная масса кислоты равна молекулярной массе кислоты, деленной на число атомов водорода, замещаемых в химической реакции:
mэ(H2SО4) =Мr/nB = 98/2 = 49а.е.м.
Мольная масса эквивалента серной кислоты будет равна соответственно Мэ(H2SО4) = 49г/моль.
в) Эквивалентная масса основания равна молекулярной массе основания, деленной на число гидроксидных групп, участвующих в реакции:
mэ(Са(ОН)2) =Мr/n(OH–) = 74/2 = 37а.е.м.
Мольная масса эквивалента гидроксида кальция Мэ(Са(ОН)2) = 37 г/моль.
Пример 4.
На восстановление 4 г оксида двухвалентного металла требуется 1,12 л водорода. Определить мольную массу эквивалентов оксида, мольнуюмассу эквивалентов металла, мольную и атомную массы металла.
Решение.
Согласно закону эквивалентов массы (или объемы) реагирующих друг с другом веществ пропорциональны их мольным массам (мольным объемам) эквивалентов:
m1/Mэ(1) =m2/Mэ(2),
где m1иm2 –массы взаимодействующих веществ;Mэ(1)иMэ(2) –мольные массы эквивалентов этих веществ.
Если одно из взаимодействующих веществ находится в газообразном состоянии, в расчетах используют единицы массы и единицы объема. В данном примере:
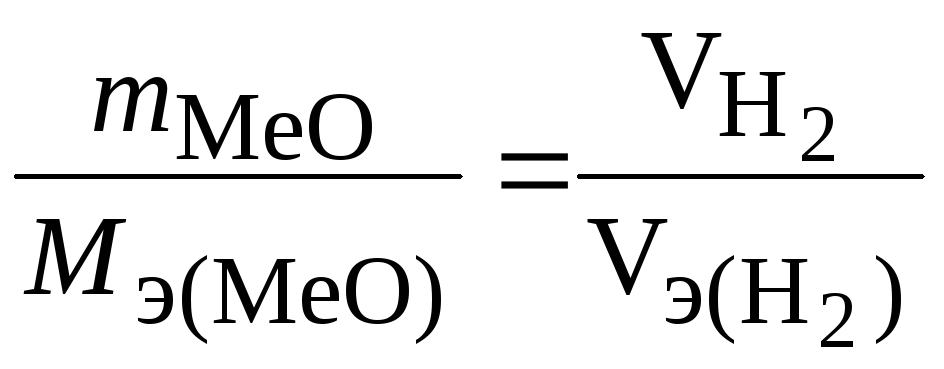 ,
,
где VH2 –объем водорода, вступившего в реакцию,Vэ(Н2)– мольный объем эквивалентов водорода (эквивалентный объем).
Объем газа, занимаемый одним молем любого газа, при нормальных условиях (мольный объем) равен 22,4 л.
Объем газа, занимаемый одним молем эквивалентов газа при нормальных условиях (н.у.) называют мольным объемом эквивалентов или эквивалентным объемом газа. Молекула водорода содержит два атома, поэтому в одном моле молекулярного водорода содержится два моля атомарного водорода. Таким образом, эквивалентный объем водорода будет равен:
Vэ(Н2) = 22,4 / 2 =11,2 л.
Найдем мольную массу эквивалентов оксида Мэ(MеO):
4 / Мэ(MеO) =1,12 / 11,2; Мэ(MеO) =40 г/моль.
В соответствии с законом эквивалентов моль эквивалентов оксида равен сумме молей эквивалентов металла и кислорода. Мольная масса эквивалентов кислорода равна мольной массе атомарного кислорода, деленной на его валентность:
Мэ(О2) =М /В = 16 / 2 = 8г/моль.
Отсюда мольная масса эквивалентов металла:
Мэ(Mе) =Мэ(MеO) –Мэ(О2)= 40 – 8 = 32г/моль.
Мольная масса атомов металла
М(Ме) =Мэ(Mе)∙В = 32∙2 = 64г/моль.
Атомная масса металла численно равна мольной и выражается в атомных единицах массы (а.е.м.)
А(Ме) = 64а.е.м.
