
5 курс / Госпитальная педиатрия / Синдром_внезапной_смерти_у_детей_грудного_и_раннего_возраста
.pdfпри глубоком сне, которые они назвали «синдромом русалки». Они считают, что глубокий сон действует подобно седативному средству и дыхание ребенка можно восстановить легким прикосновением. Полагают, что в состоянии бодрствования ды хание возврашается к норме с помощью сознательной его активации.
Основываясь на своем опыте, Guilleminault с сотр. [1973, 1975] рекомендуют всех грудных детей, страдающих даже слабовыраженным инфекционным заболеванием дыхательных путей, госпита лизировать.
В последние несколько лет стали обращать большее внимание на подробный анамнез в случаях СВСД. При ретроспективном исследовании Andersen-Huntington и Rosenblith [1976], а также Naeye [1974—1977] обнаружили в анамнезе при СВСД высокую частоту случаев аноксического состояния с тенденцией к судорогам и повы шенному мышечному тонусу.
Мы не можем согласиться с теорией, выдвинутой Kravitz и Scherz [1977], согласно которой из-за недостаточной иннервации язык, нижняя челюсть и мягкое небо во время сна западают и вызывают механическую блокаду глотки и последующую асфиксию. Подъем головы на 30° над грудной клеткой предупреждает это явление.
Систематическое обнаружение отека мозга в морфологической картине СВСД делает необходимым детальное объяснение природы функциональных расстройств центральной нервной системы, осо бенно регуляции дыхания. Как будет показано ниже, необходимо обсуждение не только расстройства центральной регуляции дыхания, как могущего иметь важное значение в патогенезе СВСД, но также и периферически обусловленных расстройств дыхания, что подтвер ждается данными патологоанатомических исследований дыхатель ных путей.
Следует подчеркнуть, что головной мозг ребенка нуждается в гораздо большем количестве кислорода и гораздо более чувствителен к недостатку кислорода, чем головной мозг взрослого. Даже мини мальные изменения характера дыхания, химического состава крови функций сердечно-сосудистой системы или обмена веществ воздей ствуют на структуру и функцию головного мозга [Pia, 1966; Herschkowitz, 1976]. Между этими механизмами существует тесное взаимодействие. Гипоксия представляет собой общий термин для различных состояний, при которых снижено или нарушено тканевое дыхание [Opitz, Schneider, 1950]. Считается, что недостаточно развитые области головного мозга более чувствительны к наруше нию, такому, как гипоксия, чем относительно более развитые ствол головного мозга и спинной мозг [Kiene, Kiilz, 1968].
Еще в нашей более ранней работе [Althoff, 1973] мы подчеркивали значение центральной нервной системы при СВСД. В более поздних исследованиях, уже упоминавшихся нами, эта концепция подтвер ждается. Головной мозг как незащищенное место реакции организма расположен в центре порочного круга в силу его возрастных анатомических и нейрофизиологических особенностей. Функцио нальные расстройства дыхания периферического и центрального происхождения ведут к отеку головного мозга, который быстро
71

усугубляется в результате типичных для этого возраста форм реакций. Конечным звеном цепи различных патогенетических факторов является так называемая мозговая смерть ребенка (рис. 15).
В тех немногих случаях, в которых родители действительно наблюдали наступление смерти у своих детей, их свидетельства подтверждают наличие терминального расстройства дыхания цен трального генеза. Конечно, нельзя предположить возможность рефлекторной смерти, которая происходила бы в течение считанных секунд. Морфологическое исследование внутренних органов свиде тельствует о более длительном «процессе», который, несомненно, длится несколько часов. Родители так описывали симптомы, которые они наблюдали в терминальной стадии: прогрессирующее снижение реакций на раздражители, ухудшение чувствительности, неподвижное выражение лица, широко раскрытые глаза, затем усиливающееся затруднение дыхания, продолжительные периоды апноэ, отдельные глубокие вдохи, появление цианоза, признаки судорог, странные немотивированные крики, которых родители никогда прежде не слышали, хрипение и, наконец, прекращение дыхания и полная атония. Эти симптомы также известны, как симптомы усиливающейся асфиксии.
3.2Емкость сердца, кровь и гемодинамика в грудном
ираннем детском возрасте и при СВСД
Нет ничего удивительного в том, что причину внезапной и неожиданной смерти пытаются искать в сердечной или сосудистой недостаточности.
Однако случаи смерти, связанной с сердечной недостаточностью,
Отек головного *~ мозга
могут быть установлены лишь при наличии доказанного заболева ния, такого как врожденный порок сердца, иногда очаговая или рецидивирующая форма миокардита [Noren, 1976; Thurner, 1977].
Как правило, патологические изменения в сердце при СВСД отсутствуют. Однако на некоторые результаты аутопсии нельзя не обратить внимания: более чем в Уз всех случаев под эпикардом можно наблюдать более или менее многочисленные, точечные или пятнистые геморрагии, особенно вдоль коронарных сосудов. Они обычно сочетаются с подобными субсерозными геморрагиями под плеврой и капсулой тимуса. Ранее они упоминались как «геморрагии удушения», что приводило к неправильному толкованию. При СВСД отмечается расширение и переполнение кровью правого отдела сердца и входящих в него сосудов. Образование кровяных сгустков наблюдается редко и фактически является исключением. Образова ние светлых кровяных сгустков по существу никогда не отмечается. Макроскопическая картина свидетельствует о недостаточности правого сердца. Предсердие и ушко предсердия также расширены, что Hort [1972] описывает как типичное явление, возникающее в раннем детстве в результате асфиксии и тахикардии.
Неопытные исследователи часто сообщают о «патологических находках» в области митрального клапана, так как на митральном клапане нередко наблюдаются небольшие точечные, иногда еди ничные, иногда множественные геморрагии округлой формы, которые «мерцают» под эндокардом и несколько приподнимают края клапана. Эти минимальные изменения легко не заметить или неправильно истолковать как начало воспалительного процесса. Фактически они представляют собой очень мелкие кровоизлияния, которые оказываются зажатыми между бороздками ткани [Scheibe, 1976] и наблюдаются только в этом возрасте, что, по-видимому, является результатом повышенного внутрижелудочкового давления. Они определенно не имеют отношения к заболеванию, что может быть подтверждено гистологическим исследованием.
Результаты гистологических исследований миокарда однотипны и дают очень мало информации. Мы, как правило, наблюдаем интерстициальный отек, сопровождающийся более или менее выраженной диссоциацией мышечных волокон и пучков волокон, которые в этом возрасте еще очень тонкие. С помощью гематокси лин-эозина и ШИК-реакции эти волокна окрашиваются слабее, чем у взрослых. Каких-либо признаков некроза, резорптивной реакции или воспалительных инфильтратов, жирового перерождения волокон или фиброза интерстиция либо эндокарда обнаружить не удается.
James [1968, 1970] описал гистологические изменения в атриовентрикулярном узле и пучке Гиса. Он назвал эти изменения резорптивной дегенерацией, с последующим фиброзом и на основании этого сделал вывод, что нарушение функции проводящей системы в грудном возрасте — наиболее уязвимой фазы жизни — может привести к внезапной смерти. Anderson [1970] отметил очаги воспаления в проводящей системе в 6 из 14 случаев СВСД. Ferris [1972], а также Valdes-Dapena [1973] провели подобные исследования
73
в типичных случаях СВСД и в подобранной по возрасту контрольной группе. Ferris не смог обнаружить какие-либо инфекционные процессы, a Valdes-Dapena не сумела подтвердить наличие признаков дегенерации, которые наблюдал James, в частности некроза клеток или фиброза. Ей удалось получить лишь данные, соответствующие возрастным особенностям детей. Вместе с тем Ferris в 11 из 50 случаев СВСД обнаружил небольшое количество петехиальных геморрагии вокруг синусового узла. Он интерпретировал это как признак терминальной гипоксии миокарда.
Мы попытались на материале 20 случаев СВСД подтвердить наличие изменений, сообщенных James. Мы не смогли этого сделать, даже используя самые тонкие методы исследования.
Для подобного исследования необходимо делать серийные срезы; при этом угол среза должен проходить продольно по отношению к оси сердца из области синусового узла через основание сердца и вблизи межжелудочковой перегородки к верхушке сердца. Это возможно только с использованием «техники большого сечения». В 20 исследованных нами случаях СВСД мы не смогли выявить признаков воспалительных или дегенеративных изменений. Проведе ние гистологических исследований специфических мышечных эле ментов проводящей системы сердца затруднительно ввиду необходи мости применения многочисленных методов окрашивания и сравне ния с контролем. Как и Ferris [1972, 1973], мы иногда наблюдали очень маленькие, свежие геморрагии, обычно в межуточной ткани, без какой-либо особой связи с определенными структурами. Эти интерстициальные геморрагии, которые обычно ограничены обла стью предсердия, по-видимому, можно отнести к уже описанным выше субэпикардиальным геморрагиям. Steinschneider [1978] провел систематические электрокардиографические исследования, которые показали несостоятельность предположения о том, что врожденное удлинение интервала QT может играть определенную роль в СВСД. Он доказал это, исследовав братьев, сестер и родителей внезапно погибших детей, а также контрольные случаи. Однако он признал, что интервал QT наиболее продолжителен в течение глубокого сна, а не во время фазы быстрого сна; к тому же в течение 4-й недели жизни он был в среднем более продолжительным, чем в течение первой недели.
Некоторые соображения, касающиеся физиологии развития
При нормальном развитии масса сердца возрастает с 20 г при рождении до 300 г в среднем у взрослого человека, что составляет увеличение в 15 раз [Rossle, Roulet, 1932]. У новорожденного правое сердце имеет большую массу, чем левое и мышечные волокна толще. После рождения в результате изменений кровообращения происходит «физиологическое структурное расширение» правого желудочка [Kyrieleis, 1971]. Оно имеет место при диссоциации мышечных волокон. К шестимесячному возрасту левый желудочек по величине становится равным правому, но в три раза массивнее. Масса правого сердца не увеличивается, несмотря на трехкратное увеличение его емко сти. Это возможно благодаря перегруппировке волокон: в то время как у новорожден ного мышечные волокна расположены в 5 слоев, у ребенка в первые месяцы жизни в сердце определяется только 3 слоя.
В то время как Linzbach [1947, 1960] и Adler [1971] полагают, что увеличение массы
74
миокарда обусловлено только увеличением объема волокон сердечной мышцы, Kyrieleis считает, что в первые 4 мес жизни увеличение массы левого желудочка обусловлено преимущественно увеличением числа и длины кардиомиоцитов и только позднее — утолщением волокон. Согласно последним электронно-микроскопическим исследова ниям Hort и Kraft [1971], предполагается, что увеличение длины миофибрилл происхо дит в окончаниях клеток. Kyrieleis [1971] установил, что в состоянии патологического стресса, такого, как Vitium cordis, в левом желудочке сердца развивается такое же рас ширение структуры, как в правом желудочке при «физиологических состояниях». В период усиленного развития и реорганизации сократительной мускулатуры сердца проводящая система не всегда четко различима [Kottgen, Bolt, 1954].
Сердечная деятельность и гемодинамика
У грудного ребенка эффективность работы сердца на грамм миокарда почти на 30%, а производительность сердца примерно на 21% меньше, чем у трехлетнего ребенка [Keuth, Peusquens, 1956]. Период изгнания, который в норме строго зависит от частоты сердечных сокращений, у грудного ребенка относительно увеличен, повышение давле ния также продолжительнее, чем у детей более старшего возраста Все это можно интер претировать как признак меньшей контрактильной способности и резистентности к стрессу, типичный для очень молодого сердца. Слабая мышечная сила сердца грудного ребенка может компенсироваться увеличением частоты сердечных сокращений. Следо вательно, производительность сердца относительно выше, чем его эффективность. Сердечный выброс очень невелик; у двухмесячного ребенка он составляет 3,5 мл, в конце первого года — 9,2 мл. Только в более позднем возрасте можно говорить о не ограниченной эффективности при 0,8—0,97 мл на кг массы тела. Даже в этом случае для детей старше одного года 1,3 мл на кг массы тела (значение, характерное для более старшего детского возраста) еще не реализуется.
Минутный объем сердца в первые месяцы жизни также очень невелик. В течение первого года жизни он увеличивается с 400 до 980 мл. По отношению к интенсивности основного обмена это гораздо меньше, чем в более позднем детском возрасте. Ввиду слабой мышечной силы сердца грудного ребенка особенно его левого желудочка, оно имеет низкие резервы и низкий порог переносимости стресса [Graser, 1953]; любое усиление работы обеспечивается только за счет увеличения частоты сердечных сокра щений и неэкономично. Такая форма адаптации неэффективна [Ewerbeck, 1962].
Для поддержания достаточной центральной оксигенации существуют важные регуляторные механизмы: например, высокий коэффициент эластичности и высокие зна чения объемных модулей упругости сосудов с соответствующей высокой частотой пульсовых ударов, сужение периферических кровеносных сосудов, более значительная артериовенозная разница по кислороду, достигающая 6,4 об.% (4,6 об. % у взрослого) и большее содержание фетального гемоглобина, который легче отдает кислород тка ням.
Пульс новорожденного составляет около 125 уд/мин, а в случае стрессорной си туации может возрастать до 160—200 уд/мин; к концу первого года жизни он урежается до 100—110 уд/мин. Нормальные значения колеблются в пределах от 80 до 160 уд/мин. После рождения артериальное давление быстро возрастает до среднего значения для систолического давления около 95 мм рт. ст. и диастолического — 55 мм рт. ст.
Состав крови
Биологические нормы в грудном возрасте отличаются от биологических норм в более позднем детском, школьном, подростковом и взрослом возрасте
В течение первых месяцев жизни, наряду с увеличением объема крови и содержания белка в сыворотке и несмотря на активацию эритропоэза, в результате быстрой дегра дации гемоглобина и снижения числа эритроцитов развивается так называемая анемия новорожденных. Это форма анемии обусловлена очень быстрым снижением феталь ного гемоглобина (HbF) в первые 8 нед жизни. Количество циркулирующего гемогло бина снижается почти на 50% [Schulman, Stern, 1954; Schulman, Smith, 1954]. Число эритроцитов после периода новорожденное™ постепенно падает и достигает своего самого низкого значения 3,8 млн. между 8-й и 12-й неделями [Kunzer, 1951]. Нормаль ное значение 4,5—5 млн. достигается только к концу первого года жизни. В то же время
75

в течение первых 3 мес жизни содержание гемоглобина снижается до 11,5 г% и в течение последующих месяцев остается фактически постоянным. В отдельных эритроцитах содержание гемоглобина падает с 38х10~1 2 г при рождении до 27х10"' 2 г к концу шестого месяца Средний диаметр эритроцитов изменяется с 8 до 7,1 мкм, а объем эри троцитов с 106 до 77 мкм3 . Данные факторы, ведущие к возникновению «анемии ново рожденных», суммированы Betke [1958] в виде графика (рис. 16).
Явление снижения числа эритроцитов в первые месяцы жизни при постоянной кон центрации гемоглобина Betke определяет как нормохромную анемию. За этой фазой следует гиперхромная анемия, которая тесно коррелирует с количеством поступающего в организм ребенка железа. В первые 3 мес жизни в организме ребенка используется железо, которое он получил через плаценту и в результате распада гемоглобина Начи ная с четвертого месяца полученное с пищей железо может уже использоваться в син тезе гемоглобина Считают, что к концу первого года жизни до 70% Hb-железа ребенок еще получает от матери [Smith et al., 1955]. При слишком низких концентрациях железа, поступающего в организм ребенка в первые 6 мес жизни, его запасы в организме ввиду усиления эритропоэза после его снижения в первые 3 мес жизни могут истощиться и привести к гипохромной железодефицитной анемии [Gekle et al., 1974}.
Следует, безусловно, возразить, что анемию нельзя диагностиро вать на трупе. Однако во многих случаях СВСД довольно характерно наличие немногочисленных трупных пятен, заметной бледности кожных покровов и преобладание характерной окраски внутренних органов, таких, как скелетные мышцы, миокард и почки. Данные, обнаруживаемые в костном мозге, варьируют. Обычно обнаружива ют заметное потемнение красного костного мозга, указывающее на усиление эритропоэза. Для дифференциальной диагностики важное
Момент |
2 |
4 |
6 |
8 |
10 |
12 |
рождения |
|
|
|
Месяцы |
|
|
Рис. 16. Кривая показателей крови в течение первого года жизни.
76
значение имеет терминальное или постмортальное перераспределе ние крови в организме.
Используя метод изоэлектрической фокусировки мы определяли содержание HbF и НЬА в 77 случаях СВСД и у 320 детей того же во зраста в контрольной группе.
Различий между этими двумя группами не выявлено. В первые 3 мес жизни отмечалось постепенное снижение концентрации HbF и впоследствии — быстрое; после шестого месяца удается выявить лишь незначительные количества. В случаях СВСД мы не смогли обнаружить патологических вариантов гемоглобина.
Хотя в первые 3 мес жизни происходит выделение большого количества гемоглобина, обнаружения соответствующих находок, таких, как «гемоглобинурийный нефроз», ни в литературе, ни в своей собственной практике мы не встречали. Почки относятся к таким органам, в которых при СВСД отмечаются наиболее слабые патологоанатомические изменения. Очаговое расширение капилля ров и избыточное количество крови указывают только на терми нальный стаз. Очень мало известно о механизмах регуляции центрального и периферического кровообращения. Мы полагаем, что вследствие указанных выше особенностей грудного возраста (т. е. лабильность водно-электролитного баланса, наличие анемии ново рожденных, ограниченная компенсаторная способность сердца и лег ких) при острой инфекции или энтеропатии, протекающей с рас стройством всасывания или нарушением пищеварения, возникают условия, которые способствуют быстрому развитию шокового состояния.
Ранее Rumler и Sitka [1972] обсуждали возможность развития во многих случаях СВСД «нейротоксикоза» с поражением центральных звеньев регуляции системы кровообращения. Можно было бы предположить, что развитие шокового состояния связано с высво бождением из тромбоцитов и лейкоцитов биогенных аминов [Haschek, 1976] либо с прямым действием вирусов или образованием эндотоксина. Отсутствие соответствующих компенсаторных меха низмов может затем быстро привести к смертельному исходу.
Stehr [1976] сделал наблюдение, что шоковое состояние у ребенка часто провоцируется грамотрицательными микроорганизмами после воздействия различных стимулов. Он определяет шок как порочный круг, который может быть обусловлен самыми различными факторами. Наибольшее значение из них имеют недостаточность микроциркуляции, ведущая к нарушению питания тканей и метабо лический лактатный ацидоз. Возникающие при этом опасные осложнения включают снижение минутного объема сердца, появле ние капиллярных геморрагии в венозной системе, типичные «шоко вые органы» и снижение проницаемости кишечной стенки.
Эндотоксины вызывают самые различные последствия: 1) суже ние сосудов; 2) нарушение целостности эндотелия сосудов; 3) прямое повреждение циркулирующих лейкоцитов и тромбоцитов с их
последующей агрегацией |
и тяжелым нарушением гемодинамики; |
4) воздействия на систему |
комплемента. |
77
В настоящее время многое известно о морфологической картине шока у новорожденного [Bleyl et al., 1969, 1970]. На состоявшемся в 1978 г. в Вене симпозиуме Немецкого общества патологоанатомов был сделан дальнейший вклад в развитие знаний в этой области [Gobel, 1978; Miintefering, 1978]. Однако немногое известно о последу ющих периодах раннего детского возраста.
Как правило, мы стараемся найти микротромбы в перифериче ских сосудах [Remmele et al., 1968, 1973] даже несмотря на то, что в клинически подтвержденных случаях шока при проведении последу ющей аутопсии и гистологического исследования микротромбы обнаруживают только в 2/з случаев, а при шоке, продолжающемся 4 ч — только в Уг случаев [Rani et al., 1977]. В 1971 г. Peters сообщил о некоторых случаях СВСД, которые он рассматривал как результат диссеминированного внутрисосудистого свертывания (ДВС).
В 75 случаях СВСД мы также провели подробные систематиче ские гистологические исследования всех органов, используя для выявления микротромбов различные специальные методы окраски. Результаты не оправдали наших ожиданий, поскольку классических признаков ДВС, а именно фибриновых тромбов, нам не удалось обнаружить. Однако несмотря на это мы считаем, что иногда диффузное, иногда очаговое расширение капилляров и гиперемия свидетельствуют о быстром нарушении периферического кровообра щения, которое, по-видимому, быстро приводит к смерти.
Морфологические признаки шока свидетельствовали о неполном шоке и были наиболее выражены в легких. Данные о распределении крови в легких при СВСД можно найти у Adebahr и Weiler [1978].
По-видимому, в начальной фазе шока происходят нарушения в системе микроциркуляции и только позднее наступает свертывание. Это согласуется с наблюдением, что в течение первых фаз шока мономеры и небольшие агрегаты фибрина фагоцитируются клетками ретикулоэндотелиальной системы, в особенности купферовскими клетками печени. При образовании микротромбов из плазмы крови удаляется фибриноген и другие факторы свертывания; образование новых факторов не может поддерживаться на прежнем уровне, что ведет к резкому снижению гемостаза. Гиперкоагуляция переходит в гипокоагуляцию, сопровождающуюся геморрагическим диатезом. В случаях СВСД, когда продолжительность шока составляет всего несколько часов, отсутствие диссеминированных внутрисосудистых микротромбов — явление довольно частое.
Мы попытались провести сравнение СВСД с синдромом Уотерхауза — Фридериксена. Данное заболевание наблюдается преимущественно в возрасте 2У2 лет и отмечается более часто в период с января по апрель. Хорошо известна высокая смертность при этом заболевании [Schutte, 1978].
Синдром Уотерхауза — Фридериксена рассматривается как случай септического шока [Beck et al., 1967]. Bohm [1978] и Schutte [1978] считают его следствием прямого воздействия эндотоксинов на сосудистую систему. Тяжелое шоковое состояние обычно рассматри вается как результат менингококковой инфекции, хотя менингококки
78
ине всегда могут быть обнаружены, а классические симптомы менингита могут отсутствовать. Pfister с сотр. [1978] описали возникновение синдрома Уотерхауза — Фридериксена после при вивки против натуральной оспы. Harms с сотр. [1973] расценивают синдром Уотерхауза — Фридериксена как эквивалент феномена Санарелли — Шварцмана. Bohm [1978] отметил типичные микротро мбы только в Уз исследованных им случаев, но почти во всех случаях он наблюдал признаки миокардита. Он подчеркнул, что клинические
иморфологические данные не всегда согласуются.
Висследованных нами случаях синдрома Уотерхауза — Фридериксена наряду с хорошо известными кожными геморрагиями
игеморрагическим некрозом надпочечников мы выявили необычно распространенный, в большинстве случаев некротизирующий назофарингит. Эти данные были получены с помощью разработанных нами методов исследования внутренней назофарингеальной области, которые будут подробно рассмотрены в соответствующей главе.
Примечательно, что подобный назофарингит, хотя и не всегда столь распространенный или выраженный, был выявлен во многих случаях СВСД. Это сходство привело нас к мысли сравнить эти два синдрома и предположить, что СВСД является, по-видимому, «мягкой формой» быстро развивающегося шокового состояния. Морфологическим субстратом являются: периферический стаз в те рминальных разветвлениях сосудистой системы, а также постоянные субсерозные геморрагии в эпикарде, капсуле тимуса и плевре. Часто обнаруживаемые случаи геморрагического отека альвеол и интерстициального отека легких можно также объяснить подобным образом.
Между синдромом Уотерхауза — Фридериксена и СВСД возможно дальнейшее сравнение. Синдром Уотерхауза — Фриде риксена обычно развивается очень быстро и смерть может наступить уже через несколько часов после появления первых признаков за болевания или даже внезапно. Данные гистологического исследо вания назофарингеальной области свидетельствуют о наличии инфекции некоторой продолжительности с некротизирующими и геморрагическими формами назофарингита. В изученных нами случаях синдрома Уотерхауза — Фридериксена с летальным исходом смерть наступала незаметно, по-видимому, тихо, во время сна. Это также подтвердил Bohm [1978]. Выраженная форма назофарингита при СВСД также указывает на более длительное течение заболева ния, чем это обычно предполагалось на основании сведений, сообщенных родителями. Как правило, смерть наступает незаметно и, по-видимому, во время сна.
Следует отметить другие общие моменты. При синдроме Уотерхауза — Фридериксена практически всегда обнаруживают геморрагический некроз надпочечников. При обычном исследовании случаев СВСД на наличие изменений в надпочечниках выявляются некоторые неожиданные данные, касающиеся мозгового слоя. В мозговом слое, а также в коре надпочечников происходит процесс созревания. Он происходит значительно позднее в мозговом слое, после завершения послеродовой инволюции коры надпочечников.
79
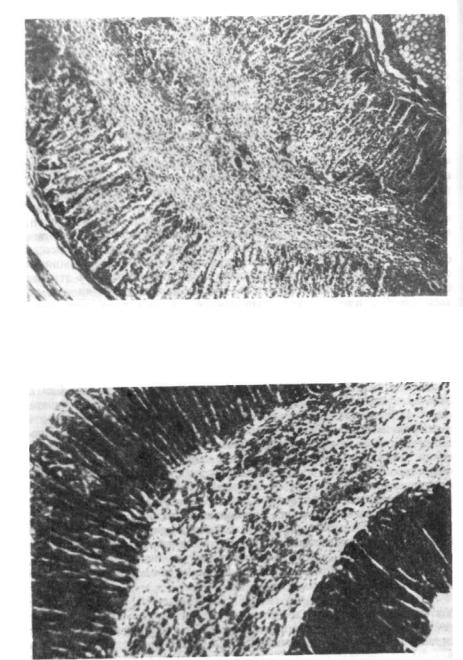
Рис. 77. ренциро Окраска
Надпочечник трехмесячного ребенка, умершего при явлениях СВСД: недиффе- ) а нный мозговой слой с очень низким содержанием медуллярных клеток, гематоксилин-эозином.
Рис 18 Мозговой слой надпочечника: медуллярные клетки почти полностью отсут ствуют. Следы инволюции при рождении, видны слои клеток, хорошо окрашиваемые Суданом. Окраска Суданом ///.
SO
