
3 курс / Патологическая физиология / Патофизиология_крови,_Фред_Дж_Шиффман
.pdf
220 |
Глава 6. Гемостаз и |
тромбоз |
|
родный индекс чувствительности, соотносящий активность тканевого фактор из животных источников со стандартом тканевого фактора у человека. Величин MHO используется для контроля за действием антикоагулянтов, вводимых перо-рально. Использование MHO рекомендовано Всемирной организацией здравоохранения с целью достижения более точного контроля при лечении антикоагуляв тами, а также для обеспечения сравнимости межлабораторных данных.
ПВ увеличено у лиц с наследственным дефицитом факторов VII, X, V, Ни или приобретенным комбинированным дефицитом факторов (дефицит витами на К или пероральное применение антикоагулянтов).
Интерпретация лабораторных тестов
Увеличение АЧТВ. С помощью скрининга и проб на свертываемость, проведи ных до операции, можно выявить увеличение АЧТВ. В дальнейшем рекомендуете! исследовать тромбоциты, ПВ и ВК (после тщательного анамнеза и общего осмот| больного). В ходе лабораторного обследования пациента с пролонгированным АЧТВ, нормальным количеством тромбоцитов, нормальным протромбиновыи временем и временем кровотечения необходимо последовательно выполнить рад) исследований, интерпретация результатов которых представлена на рис. 6-1Ш (также рис. 6-2, 6-16, 6-17). Особое значение при этом имеет клиническое опреде) ление геморрагического статуса пациента (есть у него кровоточивость или нет))
Если больной впервые обратился за медицинской помощью в связи с пр мой кровоточивости, необходимо провести подсчет тромбоцитов, определить) АЧТВ, ПВ, ВК после получения данных анамнеза и физикального обследовани
При кровоточивости и пролонгированном А ЧТВ, нормальном количестве тром-1
боцитов, нормальных ПВ и ВК тест на измерение АЧТВ выполняют в следующей! смеси: 1 объем нормальной плазмы + 1 объем плазмы больного — так называемый! 1:1 смешанный (микст) АЧТВ-тест. Если в таком варианте теста пролонгирован-] ное АЧТВ корригируется, можно подозревать дефицит факторов VIII, IX фактора XI, так как для нормального АЧТВ требуется лишь 30-50 % от их нор-1 мального уровня. И наоборот, если коррекции не происходит, подозревается на! личие ингибитора. Чащевсегоэто ингибиторы, нейтрализующие активность фак-1 торовVIII илиIX, но возможно также присутствие ингибитора активности) фактора XI.
При кровоточивости и пролонгированном АЧТВ, нормальных ПВ и количестве)
тромбоцитов, но пролонгированном ВК необходимо рассмотреть причины, влияю-) щие на состояние внутреннего пути, а также исследовать состояние функции) тромбоцитов (рис. 6-19).
Без кровоточивости с пролонгированным АЧТВ при нормальном количестве)
тромбоцитов и коррекции АЧТВ в тесте 1:1 имеет место дефицит одного из фак-1 торов свертывания крови контактной фазы (например, факторов XII, ПК или) ВМК). Без коррекции АЧТВ в тесте 1:1 у таких пациентов, по всей вероятности) присутствует в плазме волчаночноподобный ингибитор, который ассоциируется! с тромбозом без геморрагических осложнений (рис. 6-18).
Для рассмотрения представленных далее клинических ситуаций рекомендует-! ся пользоваться рисунками 6-2, 6-16 и 6-17, что облегчит понимание того, как ла-1 бораторные данные помогают выявить дефицит определенных факторов или их| ингибиторов.

Нарушения гемостаза |
|
221 |
Увеличение протромбинового времени (ПВ). При кровоточивости с пролонгиро-
ванным ПВ (нормальное АЧТВ, количество тромбоцитов и ВК) можно предполагать дефицит фактора VII.
Увеличение АЧТВ и ПВ. При кровоточивости с пролонгированными АЧТВ и ПВ
(нормальные тромбоциты и ВК) и с коррекцией в 1:1 микст-тесте вероятно наличие следующих состояний: 1) дефицит факторов X, V, II или I (факторы общего пути); 2) дефицит витамина К (недостаточность всех витамин К-зависимых факторов: X, IX, VII и II); 3) влияние терапии варфарином (также недостаточность витамин К-зависимых факторов); 4) болезнь печени (пониженный синтез факторов свертывания крови); 5) диссеминированное внутрисосудистое свертывание (см. далее); 6) активный фибринолиз (как вторичное явление после терапии или патологического процесса).
При кровоточивости с пролонгированными А ЧТВ и ПВ (нормальные тромбо-
циты и нормальное ВК), но без коррекции в 1:1 микст-тесте можно предполагать наличие ингибитора одного из факторов общего пути. Чаще всего это ингибитор фактора V, но возможны также ингибиторы факторов X или II.
Рис. 6-18. Оценка значения пролонгированного АЧТВ является как лабораторной, так и клинической процедурой. Первый этап — повторно определить АЧТВ и подтвердить, что оно действительно увеличено. Второй этап — установить, корригируется ли АЧТВ в 1 : 1 микст-тесте. Существенное значение для определения схемы дальнейшего обследования имеют такие факторы, как кровотечения в анамнезе и наличие или отсутствие кровоточивости в текущий момент (сокращениясм. втексте)

Рис. 6-19. При оценке значения пролонгированного ВК прежде всего необходимо подсчитать количество тромбоцитов и определить ПВ. Если они в пределах нормы, определяют АЧТВ. При пролон тированном АЧТВ коррекция в 1 : 1 микст-тесте может свидетельствовать о дефиците факторов свертывания, однако наличие пролонгированного ВК позволяет также предположить патологи» тромбоцитов и/или сосудистой стенки. Очень важно знать состояние кровоточивости больного, и уместно отметить, что болезнь Виллебранда может протекать на фоне отсутствия геморрагическипроблем(упациентаичленовегосемьи). Прикажущихсянормальнымивеличинах лаборатории! данных (ИЛИ незначительных отклонениях от нормы) угрожающее жизни кровотечение может возникнуть при травме или тяжелом гемостатическом стрессе (ДМ-дефект мембраны, остальныесокращения в тексте)

Нарушения гемостаза |
223 |
Без кровоточивости с пролонгированием А ЧТВ и ПВ (нормальные тромбоциты и нормальное ВК), без коррекции в 1:1 микст-тесте обычно причиной пролонгирования является ингибитор, подобный волчаночному антикоагулянту.
Отсутствиеаномалийприпроведенииобычныхскрининговыхтестовкрови.
Больные с небольшой кровоточивостью в анамнезе и без отклонений при проведе-
нии обычных скрининговых проб (нормальное количество тромбоцитов, нормальные ВК, ПВ и АЧТВ) могут иметь дефицит ФХШ или а2-антиплазмина. Дефицит ФХШ удается выявить скрининговым тестом, в котором измеряется растворимость фибринового сгустка в 5 М мочевине. Фактор XIII образует прочные кова-лентные связи молекул фибрина-полимера, делая сгусток нерастворимым в мочевине. Отсутствие ФХШ приводит к растворению фибриновых сгустков (поддерживаемых водородными связями) в 5 М мочевине.
Специальные пробы для определения факторов свертывания крови. Ниже пере-
числены специальные пробы, которые необходимо проводить для определения причины кровоточивости после детального и полного сбора анамнеза и общего осмотрабольного.
1.Анализы специфического фактора свертывания крови.
2.Пробынафункциональноесостояниетромбоцитов(адгезия, агрегация, сек реция, прокоагулянтная активность).
3.Анализ ФВ (количество и функция).
4.Определение ингибитора(например, определениеволчаночногоантикоагу лянта или ингибитора специфических факторов VIII или IX).
5.Скрининговые пробы ДВС (ПВ, АЧТВ, количество тромбоцитов, уровень фибриногена и определение ПДФ или D-димера).
6.Пробы на определение нарушений фибринолиза.
7.Специфические пробы на активацию свертывания крови.
нализ специфического фактора свертывания крови. Функциональная актив-
ность факторов свертывания крови определяется в клинических лабораториях с помощью модифицированных методов АЧТВ и ПВ. Модификация включает добавление к реакционной смеси плазмы с известным дефицитом интересующего фактора свертывания крови. Эта плазма называется "субстратом" и содержит нормальноеколичествовсехфакторовсвертываниякровизаисключениемодного, содержание которого нужно измерить. Корригирующий эффект плазмы больного на пролонгированное время плазмы-субстрата сравнивается с корригирующим эффектом известной концентрации исследуемого фактора в нормаль-
ной плазме (например, фактор VIII - 100 %, 75 %, 50 %, 25 %, 10 %, 5 % и 1 %).
Результаты выражают в процентах от активности стандартной нормальной плазмы; 1 мл смешанной нормальной плазмы равен 100 % активности или 1 ед/мл. В других анализах, применяемых для измерения активности факторов свертываниякрови, используютсяхромогенные(колориметрические) субстраты. Последние расщепляются сериновыми протеазами факторов свертывания. Это позволяет получить кривую титрования и измерить активность конкретного фактора свертывания крови.
Концентрация белков свертывания крови определяется различными иммуно-
логическими методами. Это твердофазный иммуноферментный анализ (ТИФА), радиоиммунный анализ (РИА) или количественный иммуноэлектрофорез (КИЭФ).
224 |
|
Глава 6. Гемостаз и |
|
|
тромбоз |
Пробы на определение функциональной активности тромбоцитов описанв в главе 5.
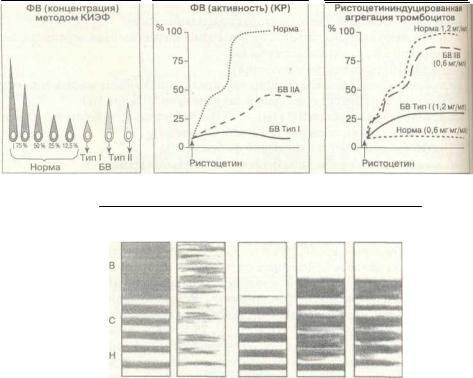
Пробы на определение болезни Виллебранда (БВ). Активация ФВ. Активной ФВ в качестве кофактора ристоцетина измеряется в модифицированном тесте агрегации тромбоцитов. Ристоцетин используют как агрегант, а лиофилизирован ные мембраны тромбоцитов здоровых людей — как источник гликопротеинов. Put тоцетин связывается с фактором Виллебранда; последний взаимодействует с ГШЬ и ГППЬ/Ша в мембранах тромбоцитов, вызывая взаимодействие по тип; тромбоцит-тромбоцит (агрегация тромбоцитов). Эффект плазмы больного (фак тор Виллебранда) в тестовой системе сравнивают с эффектом известных концен-траций нормального ФВ. Результаты выражают в процентах активности ФВ нормальной плазмы (рис. 6-20).
Ристоцетининдуцированная агрегация тромбоцитов(РИАТ) — еще один теп для определения реакции тромбоцитов на нормальную и субоптимальную ко»
I
В
Многомерный анализ ФВ
Норма |
Тип I |
ТипНА |
ТипИВ |
БВ тромбо- |
|
|
|
|
цитарного |
|
|
|
|
типа или |
|
|
|
|
псевдо-БВ |
|
|
|
|
|
Рис. 6-20. Определение концентрации ФВ методом КИЭФ (А); функциональной активности! по КР (Б) и РИАТ (В) у здоровых лиц и некоторых больных с БВ. Электрофоретическое разделен» мультимеров ФВ (Г) уздоровых лиц и больных с БВ. (В — высоко-, С — средне- и Н — низкомолску-| ляриые фракции ФВ; прочие сокращения см. в тексте)
Нарушения гемостаза |
225 |
центрации ристоцетина. Отличие РИАТ в том, что в первом случае в качестве источника ФВ суспендируются тромбоциты больного в его плазме (в методе "кофак-торристоцетина" используются нормальные лиофилизированные тромбоциты). РИАТ применяется для дифференцирования вариантов патологии ФВ (аномальный белок ФВ, тип lib) от классической болезни Виллебранда типа I (сниженный синтез ФВ). Больные с БВ типа ИВ дают полную реакцию на полунормальную концентрацию ристоцетина (0,6 мг/мл), в то времякак для такойже реакции тромбоцитов у здоровых людей необходимо 1,2 мг/мл. Реакция тромбоцитов на низкие концентрации ристоцетина уникальна для типа БВ ИВ (рис. 6-20).
Концентрация ФВ (антигенная концентрация ФВ — ФВ:Аг) измеряется методами количественного электроиммунофореза (КИЭФ), твердофазного иммуно-ферментного анализа (ТИФА) или радиоиммунного анализа (РИА). На рис. 6-20 представлены данные КИЭФ. При выполнении этой пробы агар с кроличьими анти-ФВ-антителами помещается на пластиковые предметные стекла. По одной стороне стекол сделаны ячейки для 10 мл разведенной плазмы (стандарты) или проб больного. Электрофорез проводится в течение суток. После промывания и окраски стекол определяют высоту окрашенных столбиков, образуемых преци-питированными антигеном и антителом, которая прямо пропорциональна концентрации ФВ. Высота пробы больного сравнивается со стандартом. Это точный и недорогостоящий метод. ТИФА и РИА (их нет на рисунке) имеют некоторое преимущество, позволяя анализировать большое количество проб одновременно и определять незначительную концентрацию ФВ. Разделение фракций ФВ по молекулярной массе с помощью электрофореза в агаровом геле с додецилсульфа-том натрия используется для идентификации различных подтипов болезни Виллебранда (тип 1IA-H), связанных с аномальной структурой белка Виллебранда (рис. 6-20).
Пробы на определение ингибиторов. Ингибиторы отдельных факторов свертывания крови (например, факторов VIII, IX и V) определяются смешиванием разведений плазмы больного с нормальной плазмой и инкубированием смеси в течение 2 ч при температуре 37 °С. В конце инкубационного периода в пробах повторно определяют АЧТВ. При отсутствии коррекции в каждом образце оценивают активность (содержание) интересующего фактора (например, фактора
VIII).
Считается, что образец с остаточной активностью фактора, составляющей 50 % от нормальной активности, содержит одну единицу Бетесда (БЕ) (Bethesda Unit, BU) ингибитора в 1 мл. Титр ингибитора равен обратной величине разведения тестируемой плазмы, которая нейтрализует 50 % активности фактора нормальной плазмы (например, ФVIII). Одна Оксфордская единица ингибитора (Великобритания) соответствует 1,21 единицы Бетесда (США).
Волчаночный антикоагулянт (ВА) пролонгирует как АЧТВ, так и ПВ; но в. низких титрах оказывает влияние только на АЧТВ. Оценить активность В А в плазме можно двумя клиническими тестами: определением времени действия разведенного яда гадюки Рассела и процедурой нейтрализации тромбоцитов (ПНТ). В первом тесте реактив (яд гадюки) непосредственно активирует фактор X. Последовательные разведения яда способствуют образованию небольших количеств активированного фактора X, в результате чего низкие уровни ВА проявляют свою активность против протромбиназного комплекса (ФХа + ФVa + Са2+ + фосфолипид тромбоцита) и увеличивают время свертывания крови.
<S Зак. 3 13
226 |
Глава 6. Гемостаз и |
|
тромбоз |
В процедуре нейтрализации тромбоцитов (ПНТ) используются мембра!
лиофилизированных нормальных тромбоцитов и плазма пациента. В А в плазме! связывается с Fc-рецепторами мембраны нормальных тромбоцитов. Повторное! определение АЧТВ в супернатанте этой смеси показывает нормализацию време- [ ни свертывания крови. Характеристика В А может быть получена с помощью!
иммунологических методов с применением специфических фосфолипидов, на-1 пример сфингомиелина, фосфатидилэтаноламина, фосфатидилхолина, фосфата-дилинозитола, кардиолипина (КЛ). Другой метод, подтверждающий наличие БАI в плазме, основан на использовании фосфолипидов с измененной конфигурацией, например гексагонального фосфатидилэтаноламина.
Антикардиолипиновые антитела (АКА) определяются методом ТИФА с при-1 менением антител против кардиолипина и против человеческих иммуноглобули-1 новых антител (IgG и IgM) к кардиолипину. Подобно волчаночной гиперкоагуля-1 ции, их наличие связывают с повышенной свертываемостью крови.
Скрининг-тесты на ДВС. (См. ниже раздел "Тесты на фибринолиз", а также]
табл. 6-13.)
Тесты на фибринолиз. Ниже приведены результаты скрининг-тестов, свиде-1 тельствующих о повышенной фибринолитической активности в плазме.
1.Сокращенное время свертывания цельной крови или время лизиса эуглобу-1 линовых сгустков по сравнению с нормальным.
2.Повышенный лизис фибрина в чашечном тесте или радиоизотопном иссле-1 довании.
3.Низкое содержание плазминогена, выявленное иммунологическими мето-' дами.
4.Повышенное содержание продуктов деградации фибрина (фибриногена)' (ПДФ) в сыворотке, измеряемое различными иммунологическими методами.
5.Повышенное содержание D-димера в плазме, указывающее на повышенный фибринолиз и активацию свертывания крови.
При определении ПДФ применяются поликлональные антитела к ПДФ с целью ■ выявления фибринолиза в сыворотке простым латекс-методом, однако с помо-1 щью этого теста нельзя дифференцировать фибриноген и дериваты фибрина. При определении D-димера выявляются специфические продукты лизиса фибрина. (При распаде фибриногена не образуется D-димер, так как для этого необходим перекрестносшитый фибрин.)
При определении D-димера применяются моноклинальные антитела против наименьшего продукта деградации (D-димера), возникающего в результате лизиса перекрестносшитого фибрина (но не фибриногена). Содержание D-димера измеряется в плазме с использованием латекс-метода или более чувствительного метода ТИФА. К преимуществам анализа D-димера по сравнению с ПДФ относятся: выявление D-димера в плазме и измерение специфического плазмин-фиб-ринового продукта. Последнее свидетельствует об активации свертывания крови in vivo с активацией тромбина и плазмина, которые вызывают соответственно перекрестное связывание фибрина и его деградацию D-димерами.
Специфические тесты определения активации свертывания крови. Тесты на оп-
ределение активации свертывания кровиin vivo относятся пока к исследовательским'и в большинстве клинических лабораторий не используются. Они включают:

Нарушения гемостаза___________________________________________________227
1) определение фибринопептидов А и В методом РИА; 2) определение про-тромбинового фрагмента 1,2 методом ТИФА; 3) определение комплекса AT III с тромбином иммунологическими и хромогенными методами; 4) определение ПС-активированного пептида, комплексов АПС-АПОИ, комплекса АПС-осг-макроглобулин, АПС-а,-АТ методом ТИФА или другими иммунологическими методами; 5) выявление Ф1Ха или комплекса 1Ха-АТ III иммунологическими методами; 6) обнаружение фактора Ха методами РИА или ТИФА.
Наследственные нарушения свертывания крови
Имеются сообщения о наследственном дефиците каждого из факторов свертывания крови. Наследственный дефицит любого фактора может стать причиной возникновения геморрагического синдрома, за исключением дефицита фактора XII, прекалликреина и ВМК. Наиболее характерны 3 наследственных нарушения свертывания крови: дефицит фактора VIII (гемофилия А), дефицит фактора IX (гемофилия В) и патология, связанная с фактором Виллебранда (болезнь Вил-лебранда, БВ). Способ наследования факторов свертывания крови представлен в табл. 6-3.
Гемофилия А
Гемофилия А (ГА) — наиболее характерный тип гемофилии (составляет 80-85 % всех случаев гемофилии). В США ГА встречается у 25 из 100 000 мужчин. Полагают, что в мире ГА в среднем страдают 30-100 из 1 млн человек. Основное нарушение при ГА — отсутствие или снижение коагулянтной активности фактора VIII в плазме (VIII:C), хотя молекула этого фактора, как правило, присутствует.
®VIII циркулирует в плазме, будучи связанным с фактором Виллебранда, который стабилизирует его активность и регулирует синтез (рис. 6-21). Исследования гена фактора VIII (хромосома X) показали множественные делеции и точечные мутации у кровных родственников.
Наследование и выявление носительства. Гемофилия наследуется сцеплено с Х-хромосомой. Сыновья женщин-носителей гена гемофилии имеют шанс его унаследовать в 50 % случаев (рис. 6-22). У мужчин заболевание проявляется кровоточивостью. Все сыновья гемофиликов здоровы, в то время как дочери обязательно являются носителями дефектной хромосомы. Дефект локализуется на Х-хромосоме, поэтому у мужчин нет нормального аллеля (XhY) и у них развивается клинически выраженная патологическая кровоточивость. Наоборот, у жен- щин-носителей (XhX), которые наследуют нормальный аллельный ген от матери, обычно нет тенденции к кровоточивости. Коагулянтная активность ФVIII у носи-
ТАБЛ ИЦА 6-3. Способ наследования факторов свертывания крови
Факторы |
Способ наследования |
ФУШиФ1Х |
Сцепленность с Х-хромосомой |
ФВ1 и дисфибриногенемии |
Аутосомно-доминантный |
Дефицит других факторов |
Аутосомно-рецессивный |
' В редких случаях варианты болезни Виллебранда оказываются аутосомно-рецессивными.

228 |
Глава 6. Гемостаз и |
|
тромбоз |
Место связывания тромбоцитов
Рис. 6-21. Фактор Виллебранда действует как мост между тромбоцитами и сосудистой стенкой,
песет итранспортирует ФУШ
телей должна составлять 50 % нормы. Тем не менее это не всегда так из-за широкого диапазона фактора VIII:C (50-200 %) у населения и повышения уровня ФУШ после физической нагрузки, при беременности, стрессе и различных других клинических состояниях. Уровень ФУШ:С позволяет выявить состояние но-сительства только у 60 %. Степень выявления удается повысить до 60-90 %, если дополнительноопределитьантигенфактораVIII (VIILAr) иполучитьсоотношение 2 : 1 (ФУШ:Аг/ФУ1П:С). Состояние носительства и пренатальный диагноз определяются еще более точно с помощью анализа гена ФУШ. Для этого применяют два метода: определение полиморфизма длин рестрикционных фрагментов и проведение полимеразной цепной реакции с обратной транскрипцией
Рис. 6-22. Х-связанпая передача гена гемофилии, представленная в типичной родосл<
