
- •ВВЕДЕНИЕ
- •Таблица 1
- •Показатели в % от контроля
- •Таблица 2
- •Аналгезия, ч
- •ОПИОИДНАЯ РЕГИОНАРНАЯ АНАЛГЕЗИЯ
- •Таблица 4
- •Таблица 5
- •Липоидотропность
- •Таламус
- •Таблица 7
- •Влияние морфина на внутривидовое поведение, измененное болью
- •Морфин, мг/кг
- •Время исследования
- •Время исследования
- •Глава 5
- •Глава 6
- •Глава 7
- •Таблица 15
- •Глава 9
- •ТРУДНО КУПИРУЕМЫЕ БОЛИ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ

Болевой синдром
Под редакцией профессора В.Л. МИХАЙЛОВИЧА
и профессора Ю.Д. ИГНАТОВА
ЛЕНИНГРАД «МЕДИЦИНА» ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ 1990
ББК 54.5 Б79 УДК 616.8-009.7-008.6
Рецензенты:
А.В. Вальдман, академик АМН СССР, директор НИИ фармакологии АМН СССР;
В.И. Страшнов, д-р мед. наук, проф., зав. кафедрой анестезиологии и реаниматологии I ЛМИ им. акад. И. П Павлова.
For summary see page 330
Б79 Болевой синдром / Под ред. В.Л. Михайловича, Ю.Д. Игнатова. — Л.: Медицина, 1990. — 336 с.: ил.
ISBN 5 — 225 — 01342 — 2.
В книге обобщены теоретические и клинические аспекты концепции болевого синдрома. Рассмотрены патофизиологические механизмы реакций на болевые воздействия. Подробно изложены патогенез формирования, особенности клинического течения и рекомендации но лечению болевого синдрома при основных заболеваниях, сопровождающихся его развитием.
Для фармакологов, физиологов и клиницистов.
|
4108050000 — 134 |
Б |
----------------------109-90 |
|
039(01)-90 |
ISBN 5 — 225 — 01342-2
(С) Коллектив авторов, 1990 г.

ВВЕДЕНИЕ
Не будет преувеличением утверждать, что проблема боли и аналгезии занимает одно из центральных мест в современной биологии и медицине и является предметом широкомасштабного мультидисциплинарного исследования. В настоящее время она переживает период интенсивного изучения, характеризующийся чрезвычайно быстрым появлением новых данных, концепций, теорий, которые порой даже не успевают получить должной смысловой ассимиляции как в фундаментальном, так и в теоретическом плане.
Боль — не только симптом большинства острых и хронических заболеваний, но и сложный психофизиологический феномен, вовлекающий механизмы регуляции и формирования эмоций, моторные, гуморальные и гемодинамические проявления. Сейчас уже можно довольно детально представить иерархию разноуровневого формирования боли, ее моторных и эмоциональных проявлений и роль «анальгетических систем» мозга, сегментарных систем восприятия и интеграции ноцицептивных сигналов. Центральные нейрофизиологические механизмы конвергенции, суммации, взаимодействия ноцицептивных и антиноцицептивных афферентных сигналов, происходящие на различных уровнях ЦНС, имеют самое непосредственное отношение к возникновению боли.
Среди многообразия болеутоляющих средств ведущее место, как наиболее эффективные и специфически действующие препараты, занимают наркотические анальгетики. Современное представление о нейрофизиологии боли со всей очевидностью предопределяет, что анальгетический и другие эффекты опиатов и опиоидов представляют собой результирующие их действия на различных уровнях ЦНС. Первичным центральным субстратом сложного взаимодействия ноцицептивной и антиноцицептивной систем являются задние рога спинного мозга. Именно здесь происходит взаимодействие между каналами «болевой» и «неболевой» чувствительности, на основании которого возникает поток восходящей импульсации нового качества. В настоящее время следует считать общепризнанным, что передача ноцицептивных сигналов может первично изменяться уже на уровне спинного мозга и что сегментарные механизмы действия опиатов и опиоидов играют существенную роль в реализации аналгезии.
В значительной степени на сегментарном уровне осуществляется реализация нисходящих влияний гетерогенных антиноцицептивных систем мозга, модулирующих формирование ноцицентивного потока импульсов к эффекторным нейронам разного функционального назначения и, в конечном итоге, определяющих выраженность ответного реагирования организма на боль и сдвиг психоэмоциональных, моторных и вегетативных показателей. До настоящего времени дискутируется вопрос о сопряженности изменений моторных и гемодинамических реакций под влиянием антиноцицептивных систем, их функциональной роли в определении кардинального механизма жизнеобеспечения — механизма вегетомоторного сопряжения. Вместе с тем
не вызывает сомнений способность опиатов и опиоидов активировать нисходящие регулирующие эффекты антиноцицептивных систем, хотя вклад опиоидергических систем в случае их прямого запуска или опосредованной активации при электроакупунктуре и других способах немедикаментозного обезболивания может быть различным.
Следует подчеркнуть, что ставшее уже традиционным исследование опиоидной системы получило новый импульс благодаря теории опиатных рецепторов и созданию веществ с элементами селективного агонистического и антагонистического действия. К сожалению, теория функциональной гетерогенности опиатных рецепторов весьма фрагментарна, в значительной мере ортодоксальна, а главное, лишь в малой мере реализована практически в виде наркотических анальгетиков, обладающих заданным спектром рецепторного действия и в связи с этим — определенным набором фармакотерапевтических эффектов. Созданные в последние годы новые опиоиды, по ряду показателей значительно превосходящие традиционные морфиноподобные анальгетики, сохранили большинство их негативных эффектов, главными из которых являются выраженный наркогенный потенциал и развитие наркомании. В настоящей книге на основании хорошо аргументированного экспериментального материала о различной динамике развития толерантности к анальгетическому и эмоционально позитивному эффектам опиатов и опиоидов, разного их изменения под влиянием нейромедиаторных анализаторов и ряда других фактов постулируется обнадеживающее положение о принципиальной возможности разделения обезболивающего и тимотропного компонентов действия нейротропных средств.
В последнее время пристальное внимание клиницистов и фармакологов обращено на недостаточную защиту сердечно-сосудистой системы в условиях опиатной аналгезии, что приводит к тяжелым осложнениям непосредственно в период болевой агрессии и после ее прекращения. Неудовлетворительное состояние проблемы медикаментозной коррекции сдвигов гемодинамики при боли во многом обусловлено недостаточной разработкой фундаментальных исследований в этом направлении, на основе которых возможно совершенствование опиатной аналгезии. Так, в мировой литературе практически отсутствуют исследования, посвященные анализу нейрофизиологических и нейрохимических аспектов регуляции кровообращения при боли. Отсутствуют данные о механизмах гемодинамических эффектов опиатов, опиоидов и селективных агонистов опиатных рецепторов. Совокупность этих данных, приведенных и критически осмысленных в настоящей книге, имеет первостепенное значение для понимания причин устойчивости сдвигов гемодинамики к наркотическим анальгетикам и определения перспектив оптимизации опиатной аналгезии.
С другой стороны, несмотря на общепринятое представление о полинейрохимизме боли, до настоящего времени практически нет фундаментальных обоснований ее регуляции через неопиатные системы
мозга. В этом плане большой интерес представляют адренергические механизмы, определяющие состояние сердечно-сосудистой системы в норме и при различных патологических состояниях. В этом плане неисследованными остаются такие принципиальные положения, как организация адренергических болеутоляющих систем, их взаимосвязь с опиоидергическими механизмами, сопряженность в формировании болевых реакций и гемодинамических проявлений боли. Решение этих вопросов необходимо не только для обоснования направлений развития неопиатной аналгезии, но и имеет большое практическое значение.
Значительный прогресс, наметившийся в понимании боли как сложного психофизиологического феномена, в формировании и модуляции которого существенную роль играют эмоциональные, мотивационные, типологические и другие психологические факторы, определил новую психофармакологическую стратегию обезболивания. Не вызывает сомнений, что изменения отношения к боли являются не только существенным компонентом анальгетического эффекта опиатных и неопиатных анальгетиков, но и лежат в основе неспецифического болеутоляющего действия транквилизаторов и других психотропных средств. Эти обстоятельства приобретают особую значимость при рассмотрении проблемы психофармакологической регуляции боли в клиническом аспекте, поскольку эмоционально-психическая настроенность человека на восприятие боли, его личностные особенности определяют различие индивидуальных реакций и большую вариабельность действия психотропных средств. Следовательно, экстраполяция экспериментальных данных об эмоциотропном компоненте корригирующего действия препаратов на боль у человека правомерна лишь в самом общем виде. Поэтому так актуальны данные, полученные с использованием оригинальных методических подходов, позволяющие в виде конкретных рекомендаций учитывать особенности индивидуального реагирования на боль в клинических условиях.
Основополагающий системный подход к анализу боли и аналгезии является наиболее правильным методологическим критерием адекватности существующие теорий и положений, определяющих стратегию и тактику борьбы с болью в клинике. Единство многообразных механизмов формирования проявлений боли и вместе с тем все более очевидная разобщенность таких кардинальных процессов, как регуляция моторных и гемодинамических ноцицептивных реакций, несмотря на кажущуюся парадоксальность такой регуляции, имеют глубокий биологический смысл и закреплены филогенетически дифференцированностью нейрохимических систем и даже на рецепторном уровне. Именно это принципиально отличное от ранее существовавших положение определяет современные направления медикаментозного воздействия на отдельные звенья в рамках целостной системы регуляции боли, позволяющие обеспечивать истинно адекватную аналгезию, т.е. коррекцию всех без исключения разномодальных проявлений защитной реакции организма на боль.

Глава 1
НЕЙРОФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ БОЛИ
РЕЦЕПТОРНЫЙ АППАРАТ И АФФЕРЕНТНЫЕ ПРОВОДНИКИ БОЛЕВОЙ ЧУВСТВИТЕЛЬНОСТИ
Вопрос о «болевых» рецепторах является одним из традиционно сложных и дискуссионных в проблеме боли и аналгезии. Несмотря на все возрастающее количество исследований, посвященных начальным, периферическим механизмам возникновения боли, до настоящего времени нет четких представлений ни о морфофункциональной организации аппарата, воспринимающего болевые воздействия, ни о существовании самих воздействий, адекватных для болевых рецепторов [подробнее см.: Хаютин В.М., 1976; Лиманский Ю.П., 1986; Ревенко С.В. и др., 1988а; La Motte R. et al., 1982; Meyer R. et al., 1985; Torebjork H., 1985; Szolcsanyi J., 1986]. Общим свойством разных no своей модальности стимулов, способных вызвать боль, является повреждение тканей — ноцицепция, по Ч. Шеррингтону (1900). Поэтому в современной литературе широко используется термин «ноцицептор» в качестве семантического аналога «болевого рецептора», хотя в смысловом отношении они, как и понятия «боль» и «ноцицепция», не эквивалентны.
Существует немало различных классификаций ноцицепторов — по модальности воздействия (механические, термические, химические), по способности отвечать на определенный или различные ноцицептивные стимулы (моно- и полимодальные), по принадлежности к тонким миелиновым и безмиелиновым (А-δ- и С- соответственно) волокнам, по локализации в различных тканях и т.д. Однако такое разделение, в основе которого лежат разные подходы и принципы, не вносит большой ясности в понимание природы рецептора и не дает ответа на основной традиционный вопрос, специфичны ли болевые рецепторы или боль (ноцицепция) является функцией интенсивности и синхронности любого воздействия.
М. Фрей [Frey М., 1894], по-видимому, первым выдвинул гипотезу о существовании специфических болевых рецепторов и предположил, что эти рецепторы представлены свободными неинкапсулированными нервными окончаниями. Согласно современным данным, они в большом количестве содержатся в различных тканях и органах и имеют множество концевых
разветвлений с мелкими аксоплазматическими отростками, которые и являются структурами, активируемыми болевым воздействием.
Было показано, что при раздражении кожи человека через металлические электроды, прикосновение которых практически не ощущалось, выявлялись «точки», пороговая стимуляция которых воспринималась как резкая нестерпимая боль [Дзидзишвили Н.Н., 1973; Кассиль Г.Н., 1975]. Представление о специфических ноцицепторах, как о свободных немиелинизированных нервных окончаниях, получило дальнейшее развитие и экспериментальное подтверждение [подробнее см.:
Zimmermann М., 1978; Torebjork Н., 1985]. Кроме того, в коже и, особенно, в дентине зубов были обнаружены своеобразные комплексы свободных нервных окончаний с клетками иннервируемой ткани, которые рассматриваются как сложные рецепторы болевой чувствительности [Matthews В., 1985].
Отличительной особенностью многих свободных немиелинизированных окончаний является их высокая хемочувствительность. Допускается даже, что болевой рецептор по своей природе не ноцицептивен, а «хемоцептивен», поскольку любое воздействие, приводящее к повреждению тканей и являющееся адекватным для ноцицептора, сопровождается высвобождением алгогенных (вызывающих боль) химических агентов. Выделяют 3 типа таких веществ — тканевые (серотонин, гистамин, ацетилхолин, некоторые простагландины, ионы К+ и Н+), плазменные (брадикинин, каллидин) и выделяющиеся из нервных окончаний (субстанция Р). Предложено немало гипотез о ноцицептивных механизмах алгогенных субстанций. Допускается, что субстанции, содержащиеся в основном в тканях, непосредственно активируют концевые разветвления немиелинизированных волокон и вызывают импульсную активность в высокопороговых кожных, висцеральных и мышечных афферентах. Они вызывают ощущение боли у человека и псевдоаффективную ноцицептивную реакцию у животных при аппликации на ткани. Другие (простагландины), сами не вызывающие боли, усиливают эффект ноцицептивного воздействия иной модальности. Третьи (субстанция Р) выделяются непосредственно из терминалей и взаимодействуют с рецепторами, локализованными на их мембране, и, деполяризуя ее, вызывают генерацию импульсного ноцицептивного потока. Предполагается, что субстанция Р, содержащаяся в сенсорных нейронах спинномозговых ганглиев, действует и как синаптический передатчик в нейронах заднего рога спинного мозга [Oehme P. et al., 1984]. В качестве химических агентов, активирующих свободные нервные окончания, рассматриваются не идентифицированные до конца вещества или продукты разрушения тканей, образующиеся при сильных повреждающих воздействиях, при воспалении, при локальной гипоксии [Yaksh Т., Hammond D., 1982; Cervero F., 1985]. Эндогенно образующиеся алгогенные вещества играют существенную роль в возникновении мышечной и висцеральной боли. Кроме того, эти вещества в субноцицептивных концентрациях способны активировать и полимодальные ноцицепторы [Ревенко С.В. и др., 1988]. С выделением эндогенных алгоиндукторных субстанций связывают явление сенситизации (повышенной чувствительности к физическим раздражениям) при воспалении и разномодальных повреждениях кожи [Meyer A. et al., 1988].
Свободные нервные окончания активируются и интенсивным механическим воздействием, вызывающим их деформацию, обусловленную сжатием ткани, растяжением полого органа с одновременным сокращением его гладкой мускулатуры. Эти окончания могут выполнять функцию специфических висцеральных ноницепторов в миокарде, в легких, в желчных
протоках. Они активировались только такой интенсивностью стимулов, которая вызывала псевдоаффективные ответные реакции [Cervero F., 1985].
Одновременно с представлениями о специфичности болевых рецепторов существуют и активно обсуждаются несколько разновидностей теории интенсивности А. Гольдшайдера [Goldscheider A., 1894], согласно которым боль возникает не в результате раздражения специальных «ноцицепторов», а вследствие избыточной активации всех типов рецепторов различных сенсорных модальностей, которые в норме реагируют только на неболевые, «неноцицептивные» стимулы. В формировании боли в этом случае главенствующее значение имеет интенсивность воздействия, закодированная в характере импульсной активности в афферентных проводниках, а также пространственно-временное соотношение афферентной информации, конвергенция и суммация афферентных потоков в ЦНС. Не вдаваясь в детальную дискуссию о доказательствах или опровержениях различных разновидностей этой теории, следует отметить, что в последние годы получены весьма убедительные данные о наличии «неспецифических ноцицепторов» в сердце, кишечнике, легких и их важной роли в возникновении висцеральной боли [Malliani A., Lombardi F., 1982; Blumberg Н. et al., 1983).
Боль, особенно висцеральная, может возникать не только в результате активации специфических или неспецифических ноцицепторов, но и вследствие изменения синхронности и частоты разрядов при действии ноцицептивных стимулов в тех афферентах. которые на неповреждающие раздражения отвечают асинхронной низкочастотной импульсацией. Поэтому сами тонкие А-δ- и безмиелиновые С-волокна могут выполнять роль «болевых» рецепторов [Хаютин В.М., 1980).
Существующие противоречия в представлениях о рецепторном аппарате болевой чувствительности во многом обусловлены тем, что непосредственное его электрофизиологическое исследование, как, например, механорецепторов — телец Паччини, практически невозможно, и о его деятельности судят по биоэлектрической активности, регистрируемой в афферентных нервах или в отдельных волокнах. Не вдаваясь в детализацию противоречий о наличии или отсутствии специфичности болевых рецепторов, следует отметить, что ортодоксальность этих противоречий может быть значительно уменьшена, если под термином «ноцицептор» подразумевать не только сам рецепторный аппарат, но и связанные с ним афферентные волокна. В связи с этим в литературе появилось новое обозначение — сенсорная болевая единица — и расширилось само понятие «ноцицептор». Этим термином стали обозначать не только сенсорные единицы, отвечающие на повреждающее воздействие, но и те, ответ которых прогрессивно увеличивается при усилении стимулов от субноцицептивных до ноцицептивных. Предполагается, что сенсорная единица имеет 2 возбудимых участка. Один из них — претерминальная часть аксона — возбуждается только повреждающими стимулами, в то время как другой —
сама терминаль — активируется уже субноцицептивными воздействиями [Ревенко С.В. и др., 1988].
В настоящее время считается общепризнанным, что основными проводниками кожной и висцеральной болевой чувствительности являются тонкие миелиновые А-δ- и безмиелиновые С-волокна, различающиеся по ряду физиологических свойств [подробнее см.: Ochoa J., 1984; Peri E., 1984]. Более того, допускается, что сами «ноцицепторы» представлены концевыми разветвлениями этих волокон в тканях.
По-видимому, впервые Я. Цоттерман [Zotterman Y., 1933] предположил, что именно с активацией С-волокон связано ощущение боли. Это предположение в последующем было подтверждено рядом исследований, но оно по-прежнему основывалось на сравнении ощущений человека с данными, полученными при регистрации активности С- афферентов у животных. У кошек и приматов неоднократно показано, что различное (механическое, термическое, химическое) ноцицептивное раздражение кожи вызывает импульсную активность в С-афферентах, причем часть из них активировалась всеми тремя видами ноцицептивных стимулов (полимодальные С-афференты), а часть — только механическим и термическим раздражениями (бимодальные С-афференты). Характерно, что частота и длительность импульсной активности в С-волокнах отчетливо коррелировала с интенсивностью и продолжительностью ноцицептивного воздействия. Предполагается, что у некоторых видов животных С-афференты имеют ведущее значение в генезе термической боли [Doucette R. et al, 1987; Lynn В., Schakhanben J., 1988].
Только с помощью микронейрографического метода регистрации активности отдельных С-волокон у человека было доказано, что ощущение боли возникает тогда, когда активируются эти афференты. Установлено, что у человека С-полимодальные волокна активируются нагреванием кожи в пределах +40... +49 °С, уколом, щипком, накожной аппликацией или внутрикожным введением гистамина, калия хлорида и других алгогенных субстанций. Рецептивные кожные поля С-афферентов имели площадь от 1 мм2 до 1 см2. Порог их термического ноцицептивного раздражения составлял +41...+47 °С, что хорошо соответствует порогу (+41...+49 °С) ощущения термической боли [La Mottc R. et al., 1982]. У большинства С-афферентов число и частота импульсов линейно возрастали с увеличением интенсивности термического раздражения. Прямая зависимость была выявлена между характером импульсной активности и субъективной оценкой болевого ощущения. При длительном ноцицептивном воздействии в С- афферентах наблюдался феномен утомления с одновременным уменьшением боли, но через непродолжительное время возникала сенситизация, проявляющаяся резким снижением порога термического раздражения С- волокон, и возрастала интенсивность болевого ощущения. Весьма характерно, что одиночное раздражение афферентных нервов у человека интенсивностью, достаточной для активации С-волокон, вызывало ощущение умеренной плохо локализуемой боли, однако при аналогичной по силе, но
более высокочастотной стимуляции (10 стим/с) уже через 3 с боль воспринималась как очень сильная и даже нестерпимая. Эти данные свидетельствуют, что временная суммация импульсных потоков, приходящих в головной мозг по С-афферентам, играет чрезвычайно важную роль в формировании боли [Torebjork Н., 1985].
А-δ-афференты тоже активируются механическим и термическим ноцицептивными раздражепиями кожи. Предполагается, что с импульсной активностью в бимодальных А-δ-волокнах связано то начальное ощущение острой колющей боли, которое испытывает человек сразу же после сильного термического по вреждения кожи - локального ожога, прикосновения к небольшому горячему предмету. Считается, что А-δ-волокна играют незначительную роль в передаче ноцицептивной информации из внутренних органов [Cervero F., 1985] за исключением легких, где они связаны с ирритантными рецепторами [Yaksh Т., Hammond D., 1982].
С активацией определенного калибра афферентных волокон связывают различные типы болевых ощущений: так называемую первичную — светлую, коротколатентную, хорошо локализованную и качественно детерминированную боль, и вторичную — темную, длиннолатенгную, плохо локализованную, тягостную, тупую боль. Такое разделение боли, многократно установленное в различных психофизиологических исследованиях при разных ноцицептивных воздействиях, в настоящее время является общепринятым. При сопоставлении ощущения боли у человека со спектром вовлеченных в возбуждение афферентных волокон при раздражении кожных нервов было убедительно показано, что «первичная» боль связана с афферентной импульсацией в А-δ-волокнах, а «вторичная» — с С-волокнами [подробнее см.: Torebjork Н., 1985). Нарушение проведения возбуждения в миелиновых волокнах (сдавление, асфиксия) приводит к ослаблению «первичной» боли, но «вторичная» боль может даже усиливаться.
Однако весь комплекс представленных данных ни в коей мере не должен инициировать представление об А-δ- и С-волокнах, как об однородной группе проводников исключительно болевых сигналов. Широко используемые в литературе термины «болевые», «ноцицептивные» афференты конечно нельзя понимать буквально. Они являются полимодальными сенсорными системами. Эти волокна передают информацию, не связанную с ноцицепцией, и активируются неповреждающими термическими (холодовыми, тепловыми) и механическими (прикосновение, небольшое сдавливание) воздействиями. Более того, активация небольшой группы С-волокон недостаточна для возникновения ощущения боли у человека, но боль может быть вызвана высокочастотной стимуляцией низкопороговых толстых миелиновых афферентов группы А-а [Wilier J., 1985).
Независимо от того, каковы механизмы возникновения ноцицептивной информации на периферии, в формировании боли ключевое значение имеют процессы, происходящие в ЦНС. Именно на основе центральных
механизмов: конвергенции, суммации, взаимодействия быстрой миелинизированной и медленной немиелинизированной систем на разных уровнях головного мозга — создаются ощущение и качественная окраска боли при действии различных ноцицептивных раздражении.
СЕГМЕНТАРНЫЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ БОЛЕВОГО ПОТОКА И ВОСХОДЯЩИЕ ПУТИ БОЛЕВОЙ ЧУВСТВИТЕЛЬНОСТИ
Первым центральным звеном, воспринимающим разномодальную афферентную информацию, является нейрональная система заднего рога спинного мозга. По современным данным, она представляет собой цитоархитектонически весьма сложную структуру, а в функциональном отношении рассматривается как своеобразный первичный интегративный центр сенсорной информации. Именно здесь происходит взаимодействие между каналами болевой и неболевой чувствительности, на основании которого формируется поток восходящей импульсации нового качества. В настоящее время в мировой литературе имеется огромное количество публикаций, посвященных морфофункциональной организации этой области спинного мозга и ее роли в переработке, формировании и передаче ноцицептивной информации, которые обобщены в ряде монографий и обзоров [Костюк П.Г., Преображенский Н.Н., 1975; Вальдман А.В., Игнатов Ю.Д., 1976; Жукова Г. П., 1977; Brown Н., 1981; Dubner R. et aL, 1984; Peri E., 1984; Lggo A. et al., 1985; Sigiura Y. et al., 1986; Light A., 1988; Blumenkopf В., 1988].
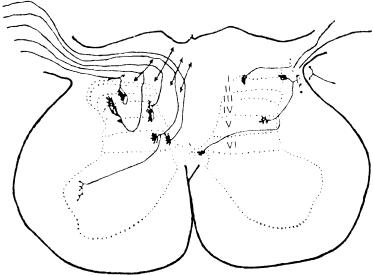
Рис 1 Распределение окончаний первичных афферентов в спинном мозге (по A. Light, 1988).
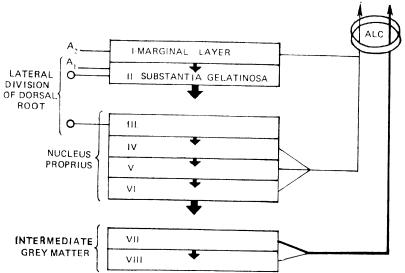
Слева - окончания афферентных волокон разных типов от сухожильных рецепторов, мышечных веретен и кожи, не связанных с ноцицепцией; справа - окончания безмиелиноных С афферентов и тонких миелиновых волокон, связанных с ноцицепцией, I — VI — слои серого вещества спинного мозга по В. Rexed (1954).
Распределение первичных афферентов в заднем роге спинного мозга. Афферентные волокна различного калибра по-разному распределяются уже в задних корешках перед их входом в спинной мозг — толстые миелинизированные проводники занимают их медиальную часть, а тонкие миелинизированные и С-волокна располагаются более латерально. Перерезка этих латеральных пучков сопровождается уменьшением боли. После входа в спинной мозг А-δ- и С-волокна в составе тракта Лиссауэра идут в каудальном и ростральном направлениях в пределах 1 — 2 сегментов и оканчиваются в дорсальной части заднего рога (рис. 1). Имеется определенное различие в окончании А-δ-, С-волокон, передающих ноцицептивную информацию, и А-δ-волокон, связанных с механорецепторами.
Установлено, что в I пластине, содержащей крупные, маргинальные клетки, оканчиваются А-δ-волокна, активируемые термическим и механическим ноцицептивными раздражениями, и С-полимодальные ноцицентивные афференты. Широко ветвящиеся тонкие терминали С- волокон образуют синапсы на дендритах маргинальных клеток и аксоаксональные контакты на терминалях других афферентных волокон. Желатинозная субстанция (II пластина) является основным местом окончания С-волокон, а также других афферентов, которые входят в нее с дорсальной поверхности, и, широко разветвляясь, диффузно распределяются во всей ее толще, достигая вентральной границы. А-δ-волокпа также оканчиваются в желатинозной субстанции. Причем А-δ-афференты, связанные с механорецепторами, оканчиваются в центральной части II пластины и в III пластине и более вентрально, тогда как ноцицентивные А-δ- волокна распределяются в верхних отделах II пластины.
Толстые афферентные волокна после входа в спинной мозг идут в составе дорсальных столбов и отдают коллатерали, оканчивающиеся на нейронах IV — VI пластин заднего рога. Некоторые волокна, делая в этой области восходящую петлю, входят в желатинозную субстанцию с вентральной стороны и разветвляются в радиальном направлении по всей ее глубине. Терминали этих волокон образуют синапсы на нейронах желатинозной субстанции и на дендритах глубжерасположенных клеток. В настоящее время очень мало известно о нейрохимической медиации в самом первом центральном синапсе: афферентное волокно-нейрон заднего рога спинного мозга. Предполагается несколько кандидатов, наиболее вероятными из которых считаются субстанция Р, холецистокинин, соматостатин, вазоактивный интестинальный полипептид (ВИП) [Dodd J. et al., 1984; Bhnnenkopf В., 1988].
Функциональная характеристика нейронов заднего рога, связанных с ноцицептивной афферентацией. Все нейроны дорсальной части заднего рога могут быть разделены на 3 группы. Первая состоит из клеток, активируемых исключительно ноцицептивными стимулами или раздражением «ноцицентивных» А-δ- и С-волокон. Вторая группа включает клетки, отвечающие на ноцицептивные и неноцицептнвные воздействия и на
стимуляцию как высокопороговых, так и низкопороговых афферентов. Третья группа представлена нейронами желатинозной субстанции, которые, взаимодействуя с клетками первых двух групп, образуют систему модулирующего контроля афферентного входа в спинной мозг и формирования восходящего ноцицептивного потока импульсов.
Нейроны, активируемые ноцицептивными стимулами, так называемые специфические ноцицептивные нейроны локализованы в основном в I слое, где оканчиваются А-δ- и С-афференты. Они имеют ограниченные (3 см2) рецептивные поля и небольшую пространственную конвергенцию афферентных входов. Некоторые из них, как правило, не имеющие спонтанных разрядов, активируются только А-δ-волокнами, связанные с механорецепторами. Другие, спонтанно активные, отвечают на механическое, термическое ноцицептивное раздражение кожи и на электрическую стимуляцию А-δ- и С-волокон (рис. 2), причем возбуждающее действие С-волокон на эти клетки не зависит от соотношения активности в толстых и тонких немиелинизированных волокнах, так как ответ нейронов на тепловое ноцицептивное раздражение кожи очень мало изменялся при блоке проведения по А-волокнам.
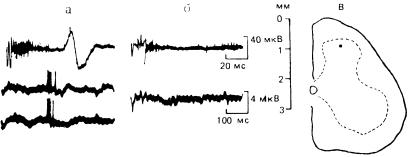
Рис. 2. Ответ нейрона заднего рога спинного мозга на электрораздражение С-афферентов до (а), после (б) поляризации афферентных волокон и локализация нейрона (в).
Сверху вниз: С-ответ кожного нерва при сверхпороговом раздражении, ответ нейрона на раздражение С-афферентов.
По некоторым данным, более 25 % нейронов желатинозной субстанции также реагировали исключительно на ноцицептивные стимулы. Предполагается, что такие клетки, активируемые С-волокнами, в функциональном отношении являются вставочными нейронами на пути передачи импульсов от первичных афферентов к нейронам I пластины. При одновременной регистрации активности пары клеток — одной в желатинозной субстанции, другой — в I пластине — было установлено, что латентный период первого потенциала действия в ответе нейрона желатинозной субстанции меньше, чем латентный период I спайка в ответной реакции нейрона I пластины и оба этих нейрона имели перекрывающиеся рецептивные поля [Price D. et al., 1979]. Эти различия были особенно характерны для нейронов наружной зоны желатинозной субстанции. Именно здесь располагаются клетки стеблевидной формы с
аксонами, направляющимися в I пластину заднего рога. Кроме того, клетки желатинозной субстанции, активируемые С-афферентами, могут возбуждать нейроны не только I, но и V пластины. Различное региональное распределение клеток I пластины, которые получают ноцицептивный вход через А-δ-афференты, и клеток желатинозной субстанции, возбуждаемых С- волокиами, могут быть одной из причин возникновения «быстрой» и «медленной» боли, поскольку аксоны нейронов I пластины участвуют в формировании спиноталамической восходящей системы.
Предполагается, что «специфические» ноципептивные нейроны играют существенную роль в формировании восходящего ноцицептивного потока, который передает в высшие отделы мозга информацию об интенсивности и локализации ноцицептивных стимулов (более подробно о морфологии и свойствах этих нейронов см.: Игнатов Ю.Д., 1986; Diidner R., Bennett G. 1983; Rethelyi M. et al, 1983; Woolf С., Fitzgerald M, 1983 Peri E., 1984; Iggo A. et al., 1985).
Однако ряд экспериментальных данных показывает, что роль клеток I слоя заднего рога, активируемых исключительно ноцицептивными афферентами, в общей картине процессов формирования восходящего болевого потока не должна излишне переоцениваться, как это было сразу после выявления этих «специфических» ноцицептивных нейронов Оказалось, что таких «специфических» нейронов не так уже много в I пластине и что они перемешаны с клетками, отвечающими на стимуляцию как высоко-, так и низкопороговых афферентов, а некоторые из них активируются и раздражением А β-афферентов и даже мы щечных волокон III и IV групп [Price D. et al.. 1979]. Кроме того, эти клетки не активировались брадикинином, и их ответы на ноцицептивныс воздействия не коррелировали с поведенческим реагированием на боль. Выявлено, что аксоны нейронов I пластины проецируются не только в спиноталамический тракт, но и во все квадранты спинного мозга и даже в такой классически неболевой тракт, как дорсолатеральные канатики [МсМаhan S., Wall P., 1982].
Нейроны, активируемые разномодальными афферентными входами, или «мультирецептивные», «конвергентные», «нейроны широкого афферентного диапазона», локализованные в основании заднего рога (пластины IV — V) и глубже (частично пластины VI), играют основную роль в переработке ноцицептивной информации, в передаче ее в восходящем направлении и в реализации низкоинтегрированных простейших реакций на повреждающие воздействия. Строение, источники их активации, свойства этих клеток и проекции их аксонов хорошо исследованы [Brown А., 1982; Dubner R., Bennett О., 1983; Peri E., 1984; Maixner W. et al , 1986; Li^ht A, 1988].
Общепризнанно, что клетки основания заднего рога имеют достаточно широкое, хорошо контурируемое рецептивное поле, окруженное подпороговой зоной, имеющей незначительный афферентный вход на эти нейроны. В тех случаях, когда эффективность афферентного входа возрастает, рецептивное поле может увеличиваться [Wall Р, Devor M., 1981].
На этих нейронах конвергируют афферентные волокна различного спектра и модальности, поскольку они отвечают на прикосновение, давление, на механическую и термическую ноцицептивную стимуляцию рецептивного поля. Они моносинаптически активируются низкопороговымн А-волокнами и одновременно имеют полней наптический С-вход. Нейроны IV—V пластин отвечают высокочастотной «пачкой» импульсов на естественное неповреждающее раздражение кожи и длительной импульсной активностью при ноцицептинном воздействии. Частота и продолжительность ответов нейрона возрастает пропорционально интенсивности ноципептивных, особенно термических стимулов.
Нейроны V пластины реагируют с латентным периодом 15—30 мс длительной и высокочастотной (частота разрядов увеличивается на 100— 800%) импульсной активностью на внутриартериальное введение брадикинина, причем латентный период и продолжительность ответной реакции на брадикинин у приматов хорошо коррелируют с возникновением ощущения боли у человека.
Одновременное раздражение А- и С-афферентов проявляется двумя ответными реакциями клеток — ранней (коротколатентный ответ на стимуляцию А-волокон) и поздней (С-ответ). Выключение проведения возбуждения по А-волокнам их поляризацией усиливает ответы клеток на раздражение С-волокон, и наоборот, предшествующее раздражение А- афферентов уменьшает их реагирование на ноцицептивное раздражение рецептивного поля или на активацию С-волокон. Нами было обнаружено, что ответная реакция нейронов V слоя на ноцицептивное механическое воздействие уменьшается, если оно наносится на фоне (или сразу же после) ритмической стимуляции низкопороговых афферентов (рис. 3). В последнее время получены весьма убедительные доказательства ведущей роли конвергентных нейронов в процессах кодирования интенсивности ноцицептивных термических стимулов [Maixner W. et al., 1986]. Предполагается, что изменение свойств конвергентных нейронов: рецептивного поля, спонтанной активности и ответов на разномодальные раздражения — у крыс с экспериментальным артритом лежат в основе гипералгезии и болевого синдрома у больных ревматоидным артритом [Caivino В. et al., 1987].
На нейронах заднего рога конвергируют не только разномодальные кожные, но также мышечные (III—IV группа) и висцеральные афференты. Происходящее на этих нейронах взаимодействие соматовисцеральных афферентных потоков лежит в основе возникновения отраженной боли [Foreman R. et al., 1981]. Установлено, что нейроны, на которых осуществляется взаимодействие соматических и висцеральных афферентов, активируются через висцеральные входы при естественном раздражении висцеральных рецепторов, но только в том случае, когда интенсивность воздействия, например давление в желчных путях достигает ноцицептивного уровня [Cervero К, 1982, 1985].

Рис. 3. Ответ нейрона IV слоя заднего рога спинного мозга на ноцицептивное раздражение кожи, наносимое до и после ритмической стимуляции пизкопороговых афферентов.
1 — фоновая импульсная активность: 2 — импульсная активность при ноцицептивном раздражении до стимуляции низкопороговых афферентов: 3
— то же после ритмического раздражения низкопороговых афферентов. Линия под осциллограммами — период ноцицсптпвного воздействия на кожу. Калибровка: времени — 1 с, амплитуды — 250 мкВ.
Естественно, что не все нейроны заднего рога имеют ноцицептивные афферентные входы. Во всех пластинах, особенно в IV, имеется достаточно большая популяция клеток с узким функциональным диапазоном, которые активируются легкими механическими воздействиями (прикосновением, небольшим давлением) и не отвечают на повреждающие стимулы. В то же время клетки, отвечающие на ноцицепцию, выявлены в VI пластине и даже в вентральном роге [Molinary H., 1982]. Эти нейроны, вероятно, участвуют в регуляции не только моторной, но и сенсорной деятельности спинного мозга, и в частности в регуляции боли, способствуя локализации ответа на боль. Поэтому цитоархитектонически выделяемые пластины в заднем роге спинного мозга скорее должны рассматриваться как зоны преимущественной концентрации нейронов с определенными свойствами, а не как строго функционально специализированные нейронные ансамбли.
Таким образом, можно считать, что конвергентные нейроны, локализованные в основании заднего рога, большинство из которых имеют восходящие проекции, принимают самое непосредственное участие в возникновении информации такого качества, которая высшими отделами головного мозга расценивается как болевая и которая запускает сложные механизмы ответного реагирования на боль. Однако в настоящее время есть все основания считать, что активность релейных нейронов, связанных с ноцицептивной афферентацией, их ответы на разномодальные стимулы, взаимодействие на них различных афферентных входов и, следовательно, формирование восходящего импульсного потока модулируется нейронами желатинозной субстанции.
Нейроны желатинозной субстанции, локализованные во II пластине, стали предметом активного исследования в последние 15—20 лет. Морфофункциональная организация этой области детально рассматривается
в специальных обобщающих статьях и обзорах [Bennett G. el al., 1980; Cervero F., I^go A., 1980; Wall P., 1980; Rethelyi M. et al., 1982; Dubner R, Bennett G., 1983; Bicknell Jr., Beal J., 1984; Dubner R. et al., 1984; Per! E, 1984; Iggo A. et al., 1985]. Поэтому здесь мы коснемся лишь некоторых свойств нейронов желатинозной субстанции, необходимых для понимания их роли в регуляции ноцицепции.
Эти нейроны имеют рецептивные поля различных размеров, формы и локализации. У половины из них рецептивные поля по размерам и локализации соответствуют таковым у нейронов IV—V пластин и располагаются в пределах какой-либо одной области (стопа, пальцы) нижней конечности. Характерной особенностью 1/3 нейронов желатинозной субстанции является наличие у них очень маленьких (менее 2 см2) рецептивных полей [Wall P., 1980]. У незначительного количества (3—9%) нейронов рецептивные поля занимали всю поверхность ипсилатеральной и иногда даже контралатеральной конечности. Именно на них конвергируют А-δ-, С-волокна, а на некоторых и А-р-афференты. Примечательно, что аксоны этих клеток не выходят за пределы спинного мозга.
Ориентация аксонов желатинозных нейронов весьма различна и во многом определяется локализацией сомы клетки. У нейронов, расположенных в дорсальной части желатинозной субстанции, аксоны направлены дорсально и проецируются в тракт Лиссауэра. Аксоны нейронов средней трети идут в продольном направлении внутри желатинозного вещества. По мере приближения к нижней границе желатинозной субстанции аксоны принимают вентральное направление и проникают, как правило, в глубжерасположенные слои заднего рога. О протяженности аксональных проекций имеются разноречивые и даже полярные представления. Согласно одним данным, аксоны нейронов желатинозной субстанции оканчиваются в пределах одного сегмента [Beal J., Cooper M., 1978], в то время как по другим
— они достигают даже таламуса [Willis W. et al., 1978]. Однако аксоны большинства (до 80%) желатинозных нейронов не проецируются дальше одного сегмента и оканчиваются в пластинах I, IV, V или даже в пределах одной II пластины. У меньшей части нейронов аксоны, входящие в тракт Лиссауэра, прослеживаются на расстоянии 15 — 40 мм.
Отдельные клетки имеют контралатеральные аксональные проекции. Основная масса нейронов имеет спонтанную активность в диапазоне от
1 до 40 имп/с (в среднем 5 — 10 имп/с). Она представлена разрядами постоянного ритма без высокочастотных «пачек» импульсов. Ни перерезка дорсолатеральных канатиков, ни полная спинализация существенно не изменяли фоновую активность желатинозных нейронов, что свидетельствует о ее независимости от нисходящей тонической регуляции и о большой роли афферентного сегментарного входа в ее формировании [Steedman W., Molony V., 1983]. Нейроны желатинозной субстанции реагируют на естественное раздражение их рецептивного поля. Большинство клеток отвечали как на неповреждающую механическую (прикосновение, расчесывание), так и на ноцицептивную (сдавленно зубчатым зажимом) стимуляцию [Price D. et al.,
1979; Fitzgerald M., 1981]. По данным Р. Cervero и A. Iggo (1980), разномодальная активация рецептивного поля сопровождается исключительно торможением активности нейронов, и в зависимости от характера воздействия они могут быть разделены на 3 группы. В первую группу входят клетки, активность которых тормозилась при низкопороговой механической стимуляции рецептивного поля. Вторую группу составляют нейроны, торможение активности которых возникало при раздражении рецептивного поля как повреждающими, так и неповреждающими стимулами. К третьей группе были отнесены клетки, разряды которых угнетались только при ноцицептивном раздражении рецептивного поля. Эти 3 группы клеток в функциональном отношении, т.е. по характеру ответов на разномодальную стимуляцию рецептивного поля, являются антиподами глубжерасположенных нейронов.
По общепринятому мнению, клетки желатинозной субстанции отличаются от других нейронов заднего рога, в частности V пластины, характером ответов на раздражение С-волокон и взаимодействием А- и С- афферентных входов. Так, нейронам желатинозной субстанции не свойствен феномен «взвинчивания» (wind up). Они не изменяют, как нейроны V пластины, ответы на раздражение С-волокон при выключении А-афферентов, а предшествующая стимуляция их не уменьшает ответные реакции желатинозных нейронов, возникающие при внутриартериальном введении брадикинина [Fitzgerald M., 1981]. Наряду с хорошо изученным быстрым реагированием нейронов желатинозной субстанции на разномодальные афферентные воздействия, выявлены более медленно и длительно протекающие изменения их активности [Wall P., 1980, 1985]. Эти изменения, вероятно, обусловлены действием различных биологически активных соединений, осуществляющих нейромодуляторную функцию, таких как энкефалпны, соматостатин, ангиотензин, холецистокинин, гликокортикоиды, субстанция Р, ГАМ.К, норадреналин, серотонин, локализующихся в дорсальной части заднего спинного мозга [Hunt S., 1982; Dodd J. et al., 1984; Blumenkopf В., 1988]. Однако функциональная роль медленных, длительных изменений активности нейронов желатинозной субстанции и их связь с регуляцией ноцицептивного афферентного потока пока не выяснены и требуют новой концептуальной гипотезы.
Функциональная роль желатинозной субстанции до настоящего времени весьма спорна. Практически все исследователи придают ей важное значение как нейрональной системе, регулирующей сенсорный вход и болевую чувствительность на сегментарном уровне. Однако каждый имеет свое, порой весьма противоречащее имеющимся, представление о механизмах этой регуляции. В настоящее время снова получила подтверждение и развитие точка зрения, высказанная более 30 лет назад [Pearson Л., 1952], о том, что желатинозная субстанция функционирует как релейная инстанция, передающая ноцицептивную информацию от первичных афферентов к нейронам спиноталамического тракта. Именно в области желатинозной субстанции оканчивается основная масса
ноцицептивных А-δ- и С-афферентов, которые непосредственно активируют нейроны желатинозной субстанции [Kumazawa Т., Peri Б., 1978; Peri Б., 1984].
Согласно другой, более общепринятой концепции клетки желатинозной субстанции не просто передают, а модулируют, эффективность синаптического воздействия афферентных входов на нейроны дорсального рога спинного мозга. Традиционно считается, что эта модуляция реализуется тормозными механизмами и что большая часть клеток желатинозной субстанции функционирует как тормозные интернейроны. Примечательно, что налоксон при внутривенном введении, возбуждая нейроны V пластины, одновременно угнетает активность нейронов желатинозной субстанции [Fitzgerald M., Wall P., 1980].
Модуляция афферентного сегментарного входа клетками желатинозной субстанции может осуществляться как пост-, так и пресинаптическими механизмами. В настоящее время известно немало достаточно хорошо проверенных фактов, свидетельствующих о важной роли желатинозной субстанции в генерации деполяризации первичных афферентов (ДПА) [подробнее см.: Wall M., 1980]. Желатинозной субстанции отводится ключевая роль в одной из самых распространенных и, пожалуй, самых дискуссионных теорий боли — теории «входных ворот» (gate control theory of pain) P. Мелзака и Р. Уолла (1965) [подробнее см. Мелзак Р., 1981]. Эта теория в первом ее постулате объясняет формирование ноцицептивного потока на сегментарном уровне на основе центрального взаимодействия быстропроводящей миелиновой (неноцицептивной) и медленнопроводящей безмиелиновой систем на первых релейных (конвергентных, мультирецептивных) нейронах спинного мозга (рис. 4). Афферентная импульсация, возникающая в миелиновых волокнах при неповреждающих раздражениях, одновременно с активацией релейных нейронов (Т) через коллатерали возбуждает нейроны желатинозной субстанции. Они, в свою очередь, деполяризуют первичные миелиновые афференты и тем самым пресинаптически ограничивают активирующее их влияние на Т-клетки. При ноцицептивном воздействии активируются тонкие миелиновые и безмиелиновые волокна, которые (в оригинале теории только С-волокна) оказывают тормозное влияние на нейроны желатинозной субстанции, в результате чего уменьшается деполяризация (или возникает гиперполяризация) миелиновых волокон, т.е. «открывается» афферентный вход и возрастает эффективность синаптического воздействия на Т-нейроны. Т-нейроны при достижении критического уровня, определяемого временной и пространственной суммацией «ноцицептивных» и неноцицептивных сигналов, формируют восходящий поток импульсов нового качества, который воспринимается вышерасположенными структурами мозга.
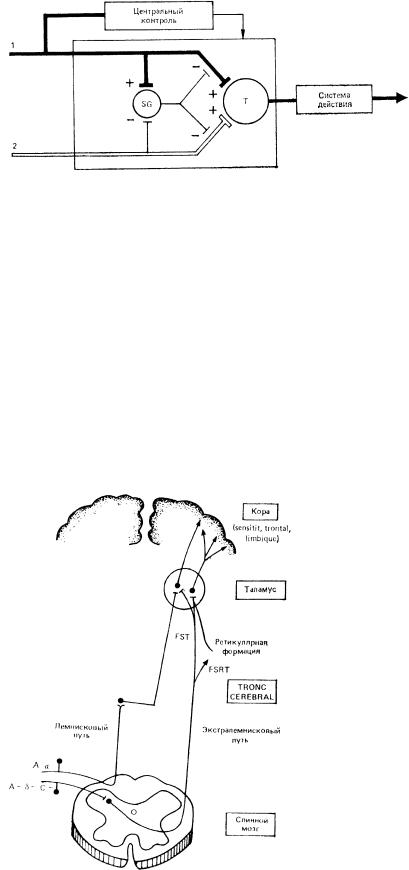
Рис. 4. Схема системы контроля афферентного входа (по R. Melzack, Р. Wall, 1965).
1 – толстые миелиновые волокна; 2 — тонкие безмиелиновые волокна: SG — желатинозная субстанция; Т — нейроны первого центрального переключения; (+) — возбуждающее действие. ( — ) — тормозное действие.
Положение теории Р. Мелзака и П. Уолла о том, что процессы пресинаптического торможения и облегчения являются ведущими в реализации модулирующего влияния желатинозной субстанции, длительное время являлись предметом активного обсуждения. Эта теория, как и любая новая теория, постоянно совершенствуется и дополняется. В современных ее модификациях, и в том числе самих авторов [Vyklicky L., 1981; Wall P., 1978, 1984], больший акцент сделан на роль постсинаптических и нейрохимических процессов в регуляции передачи разномодальных импульсов на релейные нейроны спинного мозга.
Рис. 5. Схема лемнисковой и экстралемнисковой восходящих афферентных систем (по Р. Boulu, 1984).
FST — спиноталамический тракт, FSRT — спиноретику-лоталамический тракт.
Таким образом, можно считать, что формирование восходящего «ноцицептивного» потока в спинном мозге происходит двумя способами — на основании взаимодействия разномодальных афферентных входов на релейных (конвергентных) нейронах и в результате активации «специфических болевых» нейронов, имеющих восходящие проекции.
Восходящие пути болевой чувствительности. Существуют 2 основные «классические» — лемнисковые и экстралемнисковые — восходящие афферентные системы (рис. 5). В пределах спинного мозга одна из них располагается в дорсальной и дорсолатеральной зоне белого вещества, другая — в его вентролатеральной (антеролатеральной) части. Известно, что
вЦНС не существует специализированных путей болевой чувствительности и что интеграция боли осуществляется на различных уровнях ЦНС на основе сложного взаимодействия лемнисковых и экстралемнисковых проекций. Вместе с тем не вызывает сомнений тот факт, что значительно большую роль
впередаче восходящей ноцицептивной информации играют вентролатеральные проекции, морфофункциональная организация которых детально исследована и обобщена в ряде монографий и обзоров [Оганнсян А.А., 1978; Yaksh Т., Hammond D, 1982: Kevetter G, Willis W., 1983; Ralston H., 1984; Willis W., 1985]. Об этом свидетельствуют и клинические наблюдения, показывающие, что после антеролатеральной хордотомии или деструкции этой системы при некоторых заболеваниях возникает длительная и выраженная аналгезия. С другой стороны, ощущение боли и ее локализация сохраняются при перерезке всех, кроме вентролатеральных, путей, а стимуляция аксонов в антеролатеральном квадранте после хордотомии вызывает интенсивную боль [Noordenbos W„ Wall P., 1976].
Источниками вентролатеральных проекций являются нейроны I—V и даже VI—VIII пластин спинного мозга (рис. 6), аксоны которых имеют диаметр от 1 до 11 мкм и скорость проведения 7—74 м/с. Вентролатеральные восходящие пути в пределах спинного мозга имеют определенную соматотопическую организацию — волокна, исходящие из более каудальных сегментов, располагаются более латерально, а из ростральных — медиально и вентрально. Конечные проекции первоначально выявляются в продолговатом мозге, затем — в среднем и, наконец, в галамусе. В зависимости от места окончания восходящая антеролатеральная система разделяется на 3 основных тракта — спиноталамический, спиноретикулярный и спиномезенцефалический. Первый из них обозначается как неоспиноталамический, а два других объединяются в палеоспиноталамический тракт. Однако данные последних лет со все большей убедительностью свидетельствуют об относительности такого строгого разделения, поскольку коллатерали аксонов одних и тех же нейронов спинного мозга могут проецироваться в различные супрасегментарные структуры [Kevetter G., Willis W., 1983; Liu R., 1986; Pechura С., Liu R., 1986]. Более того, предполагается, что некоторые свойства нейронов — источников восходящих трактов: размеры рецептивных полей,
ответы на разномодальные стимулы, скорость проведения по аксону — различаются в зависимости от проекции их аксонов [Yezierski R. et al., 1988].
Неоспиноталамический тракт начинается от нейронов I, V и частично VI — VII пластин спинного мозга. Нейроны — источники этого тракта, имеют кожные рецептивные поля различных(как правило, среднего и большого) размеров. В зависимости от модальности афферентных входов они разделяются на несколько групп. Одни из них, локализованные преимущественно в I пластине, активируются только ноцицептивными стимулами, другие, в основном клетки IV — V пластин, отвечают и на неповреждающие воздействия. На большинстве нейронов спиноталамического тракта, располагающихся в V пластине, конвергируют мышечные, кожные, висцеральные афференты, и эти клетки отвечают прогрессивно увеличивающейся частотой разрядов на неноцицептивную и разномодальную ноцицептивную (механическую, термическую, химическую) стимуляцию [Milne R. et al., 1981]. Аксоны спиноталамических нейронов после перекреста в передней комиссуре восходят контралатерально в вентролатеральном квадранте спинного мозга (рис. 7). В стволе головного мозга Неоспиноталамический тракт располагается дорсолатеральнее пирамид и нижнеоливарного комплекса и, не прерываясь, достигает таламуса. В пределах заднего таламуса он разделяется на латеральную и медиальную части. Первая из них оканчивается преимущественно в n. ventralis posterior lateralis, а вторая — в медиальных и интраламинарных ядрах. Недавно установлено, что нейроны — источники спиноталамического тракта содержат глутамат и холецистокинин [Ju G. et al., 1987; Magnusson K. et al., 1987]. Выявлено даже различие в их нейрохимической организации в зависимости от проекции аксонов — нейроны, аксоны которых оканчиваются в медиальном таламусе, содержат энкефалин и динорфин, в то время как клетки, проецирующиеся в латеральный таламус, — вазоактивный интестинальный пептид [Nahin R, 1988].
Рис. 6. Схема источников путей, восходящих в антеролатеральных столбах спинного мозга. I — VIII — слои серого вещества спинного мозга по В. Rexed (1954).
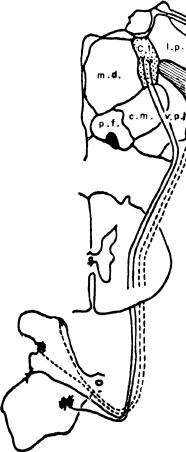
Рис. 7. Схема спиноталамического тракта (по W. Willis, 1985). Ядра таламуса, с. 1. — центральное латеральное, с. т. — центральное медиальное; 1. р. — латеральное заднее, m. d.
— медиальное заднее, р. f. — парафасцикулярное, v, р. I. каудальная часть вентрального заднелатерадь-ного; v. р. m. — вентральное заднемедиальное.
Прецизионными электрофизиологическими и гистологическими методами установлены различные проекции спиноталамических нейронов в таламусе. Аксоны спиноталамических нейронов I пластины и IV—V пластин оканчиваются соответственно в его вентролатеральных и задних ядрах, а глубжерасположенные клетки — в интраламинарных ядрах. Однако тонкая структура терминалей спиноталамических проекций из I и V слоев заднего рога спинного мозга в вентробазальный комплекс таламуса не отличается от таковой у терминалей спиноталамических аксонов клеток VII слоя заднего рога, оканчивающихся в центральном латеральном ядре таламуса [Peschanski M. et al., 1985Ма W. et al., 1987).
Спиноретикулярный тракт является вторым по величине путем передачи ноцицептивной информации. Нейроны — источники этого тракта, локализуются в V—VII и частично в VIII пластинах спинного мозга, что неоднократно было показано методом антидромной активации и маркировкой этих нейронов с помощью пероксидазы хрена. Некоторые спиноретикулярные нейроны являются энкефалинсодержащими. Примечательно, что нейроны I пластины спинного мозга не участвуют в формировании этого тракта [Kevetter G, Willis W., 1983; Nahin R„ Nicevich P.,

1986]. Спиноретикулярные нейроны имеют небольшие кожные рецептивные поля и активируются как неноцицептивными, так и ноцицептивными стимулами, причем частота их разрядов увеличивается с усилением интенсивности раздражения.
Рис. 8. Схема спиноретикулярного тракта (по W. Willis, 1985). n. g. с. — гигантоклеточное ядро.
Рис. 9. Схема спиномезенцефалического тракта (по W. Willis, 1985). β- а. g.
— околоводопроводное серое вещество; с. u. n. — клиновидное ядро
Спиноретикулярный тракт оканчивается в каудальной части ствола мозга (рис. 8). Именно в этой области, особенно в ретикулярном гигантоклеточном ядре, парагигантоклеточном ядре и в большом ядре шва, обнаружена массивная конечная дегенерация при перерезке вентролятеральных столбов. У человека больше половины волокон, восходящих в вентролатеральных столбах, оканчивается ипси- и контралатерально в зоне медиальных и латеральных ядер ретикулярной формации продолговатого мозга. Восходящие проекции от этих ядер достигают интраламинарных ядер таламуса (ретикулобульботаламический путь) и диффузно распространяются в гипоталамусе и лимбических структурах.
Спиномезенцефалический тракт иногда рассматривается как компонент спинорстикулоталамической системы, поскольку он формируется аксонами нейронов тех же пластин, где локализованы спиноретикулярные клетки [Menetrey D. et al., 1982]. Однако есть отличие в его морфологической
организации и проекциях. Волокна спиномезенцефалического тракта в вентро-латеральных столбах располагаются более поверхностно. Часть из них перекрещивается в спинном мозге, другие восходят преимущественно ипсилатерально и перекрещиваются в области покрышки головного мозга (рис. 9). У кошек часть спиномезенцефалических проекций от нейронов I слоя располагается в дорсолатеральном канатике [Hylnen J. et al., 1986]. Оканчивается спиномезенцефалический тракт в ретикулярной формации среднего мозга в центральном сером веществе и в таламусе. Клетки — источники спиномезенцефалического тракта различаются по локализации в спинном мозге, по размерам рецептивных полей, по ответам на разномодальные стимулы в зависимости от окончания их аксонов [Yezierski R., Schwartz R., 1986]. К этим восходящим волокнам добавляются многочисленные проекции из бульбарных структур, и вся эта сложная система часто объединяется в «диффузный покрышковый» или спинотектальный путь. В среднем мозге он отдает коллатерали в центральное серое вещество и в глубокие отделы верхних бугров. Волокна из центрального серого вещества, в свою очередь, проецируются в медиальные таламические ядра, в вентральную тегментальную область и в гипоталамус.
Антеролатеральные тракты являются основной, но не единственной ноцицептивной системой. Известно, что после антеро-латеральной хордотомии примерно у 50 % лиц через несколько месяцев снова возникала боль. Имеются также многочисленные экспериментальные и клинические данные о невозможности получения стойкой аналгезии при разрушении таламических сенсорных ядер [Tasker R., 1984]. Определенное значение в передаче болевой информации в ростральном направлении имеют тракты, восходящие в дорсальных и дорсолатеральных столбах белого вещества спинного мозга, традиционно относящиеся к лемнисковой афферентной системе.
Спиноцервикальный тракт — отчетливо выражен у низших млекопитающих, особенно кошек, и в меньшей степени у обезьян и человека. Он формируется аксонами клеток IV—VII пластин, которые восходят в дорсолатеральных столбах и оканчиваются в латеральном цервикальном ядре на уровне Ci-ii шейных сегментов. Нейроны — источники этого тракта активируются тактильными и различными (термическим, механическим, химическим) ноцицептивными раздражениями их рецептивных полей [Brown A., 1981]. От латерального шейного ядра афферентные проекции восходят через латеральную часть медиального лемниска, оканчиваются в среднем мозге и в контралатеральном задневентральном ядре таламуса и, переключаясь в нем, достигают соматосенсорной зоны коры. Нейроны латерального шейного ядра активируются также ноцицептивными механическими и термическими стимулами [Kalander К., Giesler G., 1987].
Дорсальные тракты содержат миелинизированные афференты задних корешков от кожи, сухожилий, мышц и внутренних органов, которые без перерыва в сером веществе спинного мозга восходят в задних столбах до нежного и клиновидного ядер. Вторичные проекции от задних ядер столбов
через медиальную петлю достигают задневентрального ядра таламуса, а оттуда проецируются в соматосенсорные зоны коры. Одновременно часть коллатералей заднекорешковых волокон оканчивается на нейронах III—IV пластин заднего рога спинного мозга, аксоны которых образуют так называемый постсинаптический дорсальный тракт, который также оканчивается в нежном и клиновидном ядрах [Bennett G. et al., 1983]. Часть нейронов, дающих начало постсинаптическому дорсальному тракту, отвечают как на тактильную, так и на ноцицептивную стимуляцию [Brown А. et al., 1983; Lu G. et al., 1983]. Ответы на эти стимулы выявлены и в некоторых волокнах задних столбов. Весьма вероятно, что ноцицептивная информация, передающаяся по этому тракту, четко дискриминированная по качеству и локализации, активирует системы высших отделов головного мозга, осуществляющих пространственный и временной анализ болевых сигналов [Мелзак Р., 1981]. Эти восходящие системы, наряду с неоспиноталамическим трактом, обеспечивают передачу информации о точной соматотопической топографии болевых стимулов. Однако морфофункциональная организация постсинаптического тракта дорсальных столбов, как и других восходящих путей, весьма видоспецифична. Так, у крыс этот тракт имеет ряд особенностей и не играет существенной роли в проведении ноципептивной информации [Giesler G., Cliffer К., 1985].
Кроме вентролатеральной и дорсолатеральной восходящих систем, в последние годы в спинном мозге выделяют еще одну систему, связанную с проведением ноцицептивной информации. Известно, что даже после билатеральной хордотомии возникают рецидивы соматических болевых синдромов и мало изменяется висцеральная боль. Поэтому постулируется существование внутренней проприоспинальной системы, представленной многочисленными цепочками короткоаксонных вставочных нейронов спинного мозга [Kerr P., Firkushima Т., 1980]. Эта внутренняя система включает в себя морфологически идентифицированные тракты — тракт Лиссауэра, дорсолатеральный, проприоспинальный и дорсальный интракорнеальный тракты. Не останавливаясь на детальной их морфофункцнональной организации [подробнее см.: Yaksh Т., Harmnond D., 1982], следует отметить, что аналогичные полисинаптпческие цепочки на уровне ретикулярной формации ствола и среднего мозга объединяются в проприоретикулярную восходящую систему. Предполагается, что проприоспинальные и проприоретикулярные проекции, наряду с палеоспиноталампческим трактом, участвуют в передаче плохо локализованной, тупой боли и в формировании вегетативных, эндокринных и аффективных проявлений боли.
Таким образом, можно выделить несколько восходящих протекций, которые существенно отличаются по морфологической организации и имеют непосредственное отношение к передаче ноцицептивной информации. Однако их ни в коем случае нельзя рассматривать как пути проведения исключительно боли, поскольку они являются также и основными субстратами сенсорного входа в различные структуры головного мозга
другой модальности. Современные морфологические, физиологические исследования и обширная практика нейрохирургических вмешательств свидетельствуют о том, что ноцицептивная информация достигает высших отделов мозга через многочисленные дублирующие каналы, которые в силу обширной конвергенции и диффузных проекций вовлекают в формирование боли сложноорганизованную иерархию различных структур головного мозга, в которых происходит взаимодействие разномодальных афферентных систем.
СУПРАСЕГМЕНТАРНЫЕ СТРУКТУРЫ И МЕХАНИЗМЫ ИНТЕГРАЦИИ БОЛИ
Одной из главных супрасегментарных зон восприятия афферентного притока и его переработки является ретикулярная формация головного мозга. Эта область имеет существенное значение и в регуляции болевой чувствительности.
Ретикулярная формация мозгового ствола и среднего мозга не только является важной релейной субстанцией для передачи ноцицептивной информации, но и осуществляет ее анализ и интеграцию. Именно здесь оканчиваются пути и (или) коллатерали восходящих систем и начинается диффузная проприоретикулярная система, а также восходящие проекции к вентробазальным и интраламинарным ядрам таламуса и далее — в соматосенсорную кору. Многочисленные электрофизиологические данные свидетельствуют о том, что значительное число нейронов ретикулярных ядер ствола имеют обширные ипси- и контралатеральные кожные рецептивные поля и активируются различными неповреждающими и ноцицептивными раздражениями — интенсивным сдавлением кожи и мышц, внутриартериальным введением брадикинина, электрической стимуляцией А-δ-, С-во-локон и высокопороговых (II — III группы) мышечных афферентов [подробнее см.: Костюк П.Г., Преображенский Н.Н., 1975; Майский В.А., 1983; Лиманский Ю.П.„ 1987; Yaksh Т., Hammond D., 1982]. Некоторые нейроны отвечают на интенсивные висцеральные стимулы. У нейронов гигантоклеточного ядра увеличиваются длительность и частота разрядов на каждый последующий ноцицептивный стимул, что свидетельствует о наличии у них, так же как и у некоторых нейронов заднего рога спинного мозга, явления «взвинчивания» (wind up).
В ретикулярной формации продолговатого мозга существуют также нейроны, активирующиеся исключительно ноцицептивными стимулами. Наибольшее их количество (43—66%) выявлено в медиальных ретикулярных ядрах. Перерезка дорсальных и дорсолатеральных столбов практически не изменяла ответы таких «болевых» клеток, но они полностью исчезали после вентролатеральной хордотомии. Примечательно, что ответы нейронов ретикулярного гигантоклеточного ядра отчетливо коррелировали с поведенческими проявлениями боли у кошек и обезьян, поскольку они были
максимально выражены лишь при такой интенсивности раздражения, которая вызывала у животных реакцию избегания.
Ретикулярная формация и центральное серое вещество (ЦСВ) среднего мозга имеют многочисленные афферентные входы, тесно взаимодействуют с различными структурами сенсомоторной, вегетативной, эмоциональноповеденческой интеграции и традиционно рассматриваются как один из узловых субстратов проведения и регуляции болевой чувствительности. На мезенцефалических нейронах конвергируют разномодальные афференты. Они имеют обширные, иногда занимающие всю поверхность тела животного, рецептивные поля. Клетки ЦСВ и смежных зон ретикулярной формации дифференцированно активируются неповреждающими и ноцицептивным стимулами у разных видов животных [Gebhart G., 1982]. При незначительном механическом раздражении эти нейроны реагируют непродолжительной низкочастотной активностью, но их ответ становится высокочасютным и длится в течение всего периода ноцицентивной стимуляции [Haigler Н., Spring D., 1981]. Характерно, что частота разрядов, вызванных естественным болевым раздражением, отчетливо коррелировала с частотой разрядов, возникающих при электрическом раздражении С-волокон. Стимуляция А- волокон вызывает ответы и в нейронах мезенцефалической покрышки, которые сохраняются после пересечения задних столбов и исчезают после вентральной хордотомии.
Раздражение ЦСВ и прилегающих к нему струкгур мезенцефалической покрышки через хронически имплантированные электроды у людей вызывает диффузные болевые ощущения, сопровождающиеся дискомфортом, страхом, отрицательными эмоциями и выраженными вегетативными проявлениями. При электрическом раздражении этих структур у кошек развивается аналогичная болевая реакции — вокализации, побег, прижатие ушей, расширение зрачков [Kiser et al., 1978]. Однако разрушение ЦСВ и мезенцефалических ядер или их функциональное выключение с помощью локального введения местных анестетиков существенно не изменяло порог болевой чувствительности [Deakin J., Dostrowsky J., 1979]. Весьма вероятно, что восходящие или проходящие транзитом в мезенцефалической ретикулярной формации волокна облегчают активность спиноталамических нейринов, связанных с ноцицепцией. Этим, по-видимому, можно объяснить, почему стимуляция мезенцефалических зон вызывает болевые, аверсивные ощущения и реакции, а их разрушения, полностью не блокирующие передачу ноцицептивной информации в ростральном направлении через спиноталамические и мезенцефалоталамические системы, не изменяют болевой порог.
На основе информации, поступающей в ретикулярную формацию через входы, формируются соматические и висцеральные рефлексы, которые интегрируются в сложные соматовисцеральные проявления ноцицепции. Через связи ретикулярной формации с гипоталамусом, базальными ядрами и лимбическим мозгом реализуются нейроэндокринные и эмоциональноаффективные компоненты боли, сопровождающие реакции защиты, бегства
или нападения в ответ на повреждающие воздействия. Ретикулярная формация, по-видимому, не участвует в тонкой качественной, временной и пространственной дискриминации болевых сигналов, хотя ее проекции в верхние бугорки покрышки среднего мозга, по мнению Ю.П. Лиманского (1986), могут играть определенную роль в зрительной ориентации при ноцицептивных воздействиях. Прямые и опосредованные многочисленные проекции ретикулярной формации в кору определяют ее участие в реакциях пробуждения, настораживания на повреждающие стимулы, в формировании ощущения боли и ее психофизиологической оценке.
Таламус. На сегодняшний день существует труднообозримое количество разноплановых экспериментальных и клинических исследований, посвященных выяснению роли таламуса в формировании и регуляции боли. В последние 10—15 лет они все больше концентрируются на изучении тех таламических зон, где оканчиваются основные восходящие тракты болевой чувствительности [подробнее см.: Казаков В. Н., 1983; Albe-Fessard D. et al., 1984; Peschanski M., Besson J., 1984; Ralston H„ 1984; Guilbaud G, 1985].
Несмотря на многообразие классификации таламических ядер [Смирнов В. M., 1972], можно выделить 3 основных ядерных комплекса, имеющих непосредственное отношение к интеграции боли: вентробазальный комплекс, задняя группа ядер, медиальные и интраламинарные ядра.
Вентробазальный комплекс является главным релейным ядром всей соматосенсорной афферентной системы. В основном здесь оканчиваются восходящие лемнисковые проекции и лишь в ограниченных зонах (вентральное заднее латеральное, вентральное заднее нижнее ядра) — неоспиноталамический тракт. Согласно устоявшимся представлениям, электрическое раздражение А-δ- С-афферентов не вызывает биоэлектрических ответов в вентробазальном комплексе и в нем практически нет нейронов, отвечающих на естественное ноцицептивное раздражение. Однако эти данные в большинстве случаев получены на наркотизированных кошках, у которых к тому же очень незначительны проекции неоспиноталамического тракта в эту область, и их исходно небольшое активирующее влияние резко уменьшается на фоне наркоза. Действительно,
уживотных без наркоза нейроны вентробазального комплекса отвечали на ноцицептивное раздражение сухожилий и мышц [Honda et al., 1983]. Большое количество нейронов, отвечающих на ноцицептивную стимуляцию, выявлено
уобезьян, и эти ответы угнетались морфином [Benoist J. et al., 1983; Casey К., Morrow Т., 1983].
Нейроны вентробазального комплекса проецируются в соматосенсорные (Sii, Si) зоны коры и частично в орбитальную кору. Поэтому ядра переключения вместе со своими корковыми проекциями участвуют в выделении таких признаков сигнала, как модальность, локализация, интенсивность и продолжительность стимулов. Мультисенсорная конвергенция на нейронах вентробазального комплекса обеспечивает точную соматотопическую информацию о локализации боли, ее пространственную соотнесенность и сенсорно-дискриминативный анализ.
Разрушение вентробазального комплекса проявляется проходящим устранением «быстрой» хорошо локализованной боли и изменяет способность к распознаванию ноцицептивных стимулов у высших животных и человека [Guilbaud G., 1985].
Задняя группа ядер. Наиболее характерной особенностью этих ассоциативных ядер является конвергенция на них полисенсорных входов из спиноталамических, спиноцервикальных и лемнискового трактов. Здесь же оканчиваются спиноретикулярные и спиномезенцефалоталамические проекции. Нейроны ядер задней группы имеют большие билатеральные рецептивные поля без признаков соматотопической организации. Около 60 % этих клеток активируются как неповреждающими, так и разномодальными ноцицептнвными (механическими, химическими, термическими) стимулами. Частота и продолжительность их разрядов прогрессивно возрастают с увеличением интенсивности раздражения. Нейроны отвечают на раздражение А-δ-, С-кожных афферентов и пульпы зуба. Нейрональная активность этих ядер сильно подавляется общими анестетиками, и этим обстоятельством обусловлено меньшее количество нейронов, отвечающих на ноцицептивные стимулы у наркотизированных животных. Задняя группа ядер имеет многочисленные проекции в кору, и в том числе в заднюю часть ее соматосенсорной области (Si, Sii). Считается, что эти таламические ядра, наряду с вентробазальным комплексом, участвуют в передаче и оценке информации о локализации болевого воздействия и частично — в формировании мотивационно-аффективных компонентов боли.
Медиальные и интраламинарные ядра. К ним относятся ассоциативное медиодорсальное ядро и неспецифические интраламинарные ядра — центральное медиальное, центральное латеральное, парацентральное, парафасцикулярное и срединный центр. На них оканчиваются волокна спиноталамического тракта, а также обширные проекции из всех восходящих трактов, связанных с ноцицепцией. Клетки этих ядер отвечают на соматические, висцеральные, слуховые, зрительные и болевые стимулы. Разномодальные ноцицептивные раздражения — пульпы зуба, А-δ-, С- кожных волокон, висцеральных афферентов, а также механическое, термическое и др. вызывают отчетливые, увеличивающиеся пропорционально интенсивности стимулов, ответы нейронов. Они не изменяются после пересечения дорсальных и дорсолатеральных трактов спинного мозга, но полностью исчезают после вентральной хордотомии. Некоторые нейроны срединного центра и парафасцикулярного ядра активировались исключительно ноцицептивным раздражением или стимуляцией А-δ- и С-афферентов. Причем они могли «дифференцировать» - низко- и высокопороговые ноцицептивные входы, поскольку характер и латентный период их ответов существенно различались. Предполагается, что клетки интраламинарных ядер осуществляют оценку и раскодирование интенсивности ноцицептивных стимулов, различая их по продолжительности и паттерну разрядов. Интраламинарные и медиальные ядра имеют четко
идентифицированные проекции в премоторную зону коры [Albe-Fessard D. et al., 1984].
Разрушение интраламинарных и медиальных ядер у животных резко ослабляет или полностью устраняет защитные ноцицептивные реакции. Деструкция их у людей сопровождается аналгезией, особенно отчетливо выраженной, когда боль обусловлена преимущественной активацией высокопороговых висцеральных афферентов. Разрушение медиодорсального ядра снижает ответные реакции на боль, создает эмоциональную индифферентность к боли.
Следовательно, медиальные и интраламинарные ядра таламуса, получающие, наряду с ноцицептивными входами, массивный афферентный приток из ЦСВ, гипоталамуса, лимбической и стриопаллидарной систем и имеющие обширные субкортикальные и корковые проекции, играют основополагающую роль в интеграции «вторичной», протопатической, плохо локализованной боли. Эти ядра формируют также сложные вегетомоторные высокоинтегрированные защитные реакции на ноцицепцию, а также мотивационно-поведенческие проявления боли и ее аффективное, дискомфортное восприятие.
Кора головного мозга. Традиционно считалось, что основное значение в переработке болевой информации имеет вторая (Sii) соматосенсорная зона, и для этого, казалось бы, были достаточно убедительные основания [Дуринян Р.А., 1980; Biedenbach M. et al., 1979; Lamour Y. et al., 1983]. Действительно, передняя часть зоны Sii получает проекции из вентробазального таламуса, а задняя — из медиальных, интраламинарных и задних групп ядер. В этой зоне были зарегистрированы негативные потенциалы, вызванные различными ноцицептивными раздражениями у кошек, обезьян и у человека. Величина потенциалов, возникающих при раздражении пульпы зуба у человека, отчетливо коррелировала с интенсивностью болевых ощущений. В зоне Sii неоднократно были зарегистрированы нейроны, отвечающие как на тактильные, так и на ноцицептивные стимулы. Были даже выявлены клетки в IV слое коры, активируемые преимущественно ноцицептивным раздражением кожи и мышц их рецептивных полей, которые, по-видимому, участвуют в декодировании информации об интенсивности и локализации болевых стимулов. Билатеральное разрушение зоны Sii у кошек увеличивало пороги поведенческих проявлений ноцицепции и пороги болевых ощущений у человека, а перерезка таламических проекций к ней использовалась даже в качестве нейрохирургического способа уменьшения болевых синдромов. Значительная роль в модуляции болевой чувствительности придавалась к орбитальной области коры, где оканчиваются проекции из n. centrum medianum таламуса.
Представления о таламокортикальных проекциях и об участии различных зон коры в перцепции и оценке боли существенно дополнены в последние годы [Roos A. et al, Albe-Fes-sard D. et al, 1984; Andersson S., Rydenhag В., 1985; Raussell E, Avendano C, 1985; Martinez-Moreno E. et al, 1987]. Установлено, что регистрация вызванных потенциалов и ответов
клеток на ноцицептивные стимулы в строго определенных зонах коры, в частности в SII, во многом обусловлена применением наркоза. У бодрствующих животных и человека они регистрировались в различных и обширных корковых зонах и даже в зоне Si.
В многочисленных зонах коры выявлено и увеличение кровотока при ноцицептивных раздражениях, тогда как тактильные стимулы его изменяли только в постцентральной извилине. Кроме того, деструкция различных, порой весьма обширных, участков коры не вызывала полной и стойкой аналгезии, хотя при значительных разрушениях возрастал латентный период ощущения боли и нарушалась ее локализация.
Естественно, что на основе выявления корковых субстратов ноцицептивных входов практически невозможно представить какую-либо приемлемую схему корковой интеграции боли. Но все же в обобщенном виде она может быть сведена к тому, что процесс первичного восприятия и сенсорной дискриминации осуществляется в большей мере соматосенсорной и фронтоорбитальной областям коры, в то время как другие области, получающие обширные проекции различных восходящих систем, участвуют в качественной ее оценке, в формировании мотивационно-аффективных, когнитивных и психодинамических процессов, обеспечивающих переживание боли и реализацию ответных реакций на боль.
При рассмотрении морфофункциональной организации ноцицептивных систем всегда весьма заманчивой представлялась возможность связать 2 принципиально различных ощущения боли, 2 ее типа — первичную, быструю, хорошо локализуемую, и вторичную, медленную, диффузную, имеющую отчетливые негативные эмоциональные и вегетомоторные проявления, с двумя системами периферического и центрального проведения ноцицептивных сигналов и с различными субстратами центральной интеграции боли. Действительно, экспериментальные и психофизиологические исследования ощущения боли у человека подтверждают правомочность такой дифференциации. Более того, разделение боли на 2 типа соответствует выделению филогенетически различных видов чувствительности — более поздней, молодой эпикритической, и более ранней, древней — протопатической, двух разновидностей ноцицептивных афферентов (А- и С-волокна) и двух классических типов восходящих систем. В виде обобщенных представлений постулируется, что первичная боль возникает при активации преимущественно быстропроводящих миелинизированных А-у-δ-афферентов. Ноцицептивная информация в этом случае передается в основном по неоспино-таламическому тракту и частично
— по системе дорсолатеральных и дорсальных лемнисковых проекций, через вентролатеральный отдел таламуса достигает в основном соматосенсорной коры. Благодаря быстрой передаче информации через эту систему обеспечиваются точная локализация боли, ее сенсорная дискриминация, оценка длительности и интенсивности ноцицептивного стимула. Все это в конечном счете приводит к тому, что данное воздействие воспринимается
именно как болевое — сигнальное для принятия решения о необходимости и степени реагирования на повреждение.
Вторичная боль в значительной степени обусловлена проведением ноцицептивной информации по медленным немиелинизированным С- афферентам, которая затем передается по палео-спиноталамическим восходящим системам (спиноретикулоталамическому, спиномезенцефалоталамическому трактам и по другим подразделениям этих диффузных проекций), а также по проприоспинальной системе. По мере рострального проведения ноцицептивных сигналов происходит активация ряда супрасегментарных структур — ретикулярной формации, гипоталамуса, лимбической и стриопаллидарной систем. Ноцицептивный поток через преимущественно медиальные, интраламинарные и задние ядра таламуса достигает различных областей коры головного мозга. Вся эта сложноорганизованная иерархия восходящих проекций и структур головного мозга обусловливает ощущение труднодифференцируемой по качеству и локализации боли, ее многокомпонентные висцсромоторные и эмоционально-аффективные проявления и психическое переживание боли.
Однако следует особо подчеркнуть, что такая схема ни в коей мере не должна ассоциироваться с выделением каких-либо строго специфических «болевых» афферентов, «болевых» трактов и «болевых» структур. Многолетняя история клинико-экспериментального изучения боли со всей очевидностью свидетельствует о том, что повреждения и перерезки различных трактов и структур головного мозга, связанных с ноцицепцией, не дают выраженной и стойкой аналгезии. Кроме того, в последние годы меняется сама стратегия экспериментального изучения и моделирования боли, поскольку все более доминирует представление, что при длительных болевых синдромах существенно изменяются не только периферические, но и центральные механизмы боли, включая даже перестройку процессов формирования и передачи ноцицептивной информации [La Motte R, 1984; Wall P, 1984; Guilband G. et al, 1986; Calvino B. et al., 1987]. Боль в отличие от ноцицепции — это не только и даже не столько сенсорная модальность, но и ощущение, эмоция и «своеобразное психическое состояние», по П.К. Анохину (1958). Поэтому боль как психофизиологический феномен формируется на основе интеграции «ноцицептивных» и «антиноцицептивных» систем и механизмов головного мозга.
МОРФОФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ АНАЛЬГЕТИЧЕСКИХ СИСТЕМ ГОЛОВНОГО МОЗГА
Новый подход к изучению проблемы боли и аналгезии определился в связи с открытием так называемых анальгетических (антиноцицептивных) зон головного мозга, т.е. зон, электрическая стимуляция которых вызывает обезболивание. Разноплановое и широкомасштабное исследование феномена стимуляционной аналгезии позволило сформулировать новую концепцию о существовании эндогенных болеутоляющих систем головного мозга,
выяснить морфофункциональную организацию этих систем, их нейрофизиологические и нейрохимические механизмы. Эта концепция легла в основу принципиально нового подхода к медикаментозной регуляции боли, и, несмотря на то, что ей за последние 10—15 лет посвящено огромное количество публикаций, в том числе и обобщающего характера, до сих пор она по-прежнему является предметом интенсивного мультидисциплинарного изучения, характеризующегося появлением новых данных и гипотез [подробнее см.: Вальдман А.В., Игнатов Ю.Д., 1976; Калюжный Л.В., 1984: Лиманский Ю.П., 1986; Basbaum A., Fields H„ 1984; Fields H., 1984; Fardin V. et al, 1984; Grey В., Dostrovsky J., 1985; Fields H., Heinricher M, 1985; Willis W., 1984, 1985; Jensen Т., 1986; Janss A., Gebhart G., 1988].
Ключевое место среди анальгетических зон головного мозга занимает ЦСВ среднего мозга. Оно находится в непосредственной близости со структурами, в которые направляются афферентные волокна восходящих ноцицептивных систем, и получает проекции от спинальных сенсорных путей, от нейронов спинального тригеминального ядра, от восходящих проекций ретикулярной формации. Именно при электрическом раздражении ЦСВ впервые был выявлен феномен селективного обезболивания [Reynolds D., 1968], получивший впоследствии название стимуляционной аналгезии, причем наиболее отчетливое и селективное обезболивание возникало при стимуляции вентральных отделов ЦСВ [Ротго С. et al., 1988].
Другой важной областью в эндогенной болеутоляющей системе являются ядра шва ствола и среднего мозга. Нейроны ядер шва получают прямые волокна из ЦСВ, а аксоны их клеток проецируются как в восходящем, так и в нисходящем направлениях. Нисходящие волокна из этих ядер, особенно из большого ядра шва, проходят в дорсолатеральном канатике и прослеживаются в заднем роге спинного мозга. Неоднократно было показано, что перерезка дорсолатеральных канатиков устраняла или резко уменьшала аналгезию, вызванную стимуляцией ЦСВ и ядер шва. Эти ядра традиционно рассматриваются как одно из главных, а некоторыми из авторов
— как основное, конечное звено эндогенной болеутоляющей системы ЦСВ (рис. 10). Однако вряд ли ядра шва выполняют просто релейную функцию. Более того, выявлены сложные реципрокные отношения между клетками ядер шва и ЦСВ и показаны прямые проекции из ЦСВ в спинной мозг.
Рис. 10. Схема главных компонентов нисходящей антиноцицептивной системы ствола мозга (по A. Basbaum, H. Field, 1984).
PAG — околоводопроводное серое вещество; RGC — ретикулярное гигантоклеточное ядро,; RpgL — ретикулярное парагигантоклеточное ядро; NRM — большое ядро шва: RMC — ретикулярное крупноклеточное ядро; Е
— нейронные системы, содержащие опиоидние пептиды; NE — норадренергическая и серотонинергическая системы.
Нейрофизиологическим механизмом реализации стимуляционной аналгезии является угнетение восходящего ноцицептивного потока, формируемого на сегментарном уровне. Как показано многочисленными электрофизиологическими исследованиями, стимуляция ЦСВ и ядер шва тормозит активность нейронов заднего рога спинного мозга, связанных с ноцицептивной афферентацией, и в первую очередь их ответы на повреждающее раздражение рецептивного поля. Особенно отчетливо изменялась активность нейронов — источников спиноталамического тракта. Примечательно, что раздражение ЦСВ, угнетающее активность спиноталамических нейронов спинного мозга, одновременно активировало клетки большого ядра шва, что подтверждает и релейную их функцию в реализации нисходящего торможения [Wiltis W., 1985]. Нисходящее торможение может проявляться изменением характера разрядов в ответе клетки в большей степени, чем уменьшением их количества. В спинном мозге это торможение реализуется как пост-, так и пресинаптическими механизмами. В пользу первого свидетельствует возникновение ТПСП в клетках спиноталамического тракта при раздражении ядер шва [Duggan A., 1984]. В пользу второго — деполяризация С-афферентов, выявляемая по увеличению порога их активации при интраспинальном раздражении [Hental
I., Fields H., 1979]. Кроме того, стимуляция ЦСВ вызывает активацию нейронов желатинозной субстанции, которые участвуют в пресинаптическом торможении ноцицептивной информации.
До настоящего времени остается весьма дискуссионной интерпретация причинно-следственной связи данных, полученных в электрофизиологических экспериментах, с поведенческими проявлениями стимуляционной аналгезии. До сих пор нет единого мнения о том, угнетение каких ответов и каких нейронов заднего рога спинного мозга можно рассматривать в качестве нейрофизиологической основы болеутоляющего эффекта центральной стимуляции. Оказалось, что в ЦСВ и ядрах шва «точек», активация которых угнетает ответы нейронов заднего рога, значительно больше, чем «точек», вызывающих стимуляционную аналгезию. Кроме того, неоднократно показано, что различные «точки» по-разному изменяют фоновую и вызванную активность разных нейронов заднего рога спинного мозга. По мнению A. Duggan (1985), критерием участия определенных зон ЦСВ в стимуляционной аналгезии является только селективное торможение ответов мультисенсорных нейронов заднего рога на периферическое ноцицептивное раздражение.
Наряду с нисходящей системой ядер шва, существует еще одна система, участвующая в контроле за активностью сегментарных механизмов афферентного входа, а именно — система нисходящих связей ядер ретикулярной формации ствола головного мозга. Эти ядра, объединяемые термином «ростровентральный ствол» [Fields H., 1984], играют существенную роль в модуляции боли. Раздражение этой области вызывает отчетливое обезболивание и угнетает ответы нейронов заднего рога спинного мозга на ноцицептивные стимулы. По некоторым данным, стимуляция ретикулярных ядер ствола в значительно большей степени, чем раздражение ядер шва, угнетает передачу ноцицептивной информации в спинном мозге. Поэтому ядра шва играют большую роль в реализации нисходящего компонента стимуляционной аналгезии [Grey В., Dostrovsky J., 1985]. В отличие от волокон, нисходящих из ядер шва, ретикулоспинальные пути оканчиваются не только в I—V слоях заднего рога, но и в боковом и передних рогах, что, по-видимому, имеет существенное значение для сопряженной регуляции вегетативной и моторной деятельности в феномене стимуляционной аналгезии.
Сейчас значительный акцент сделан на изучение роли в регуляции болевой чувствительности латерального ретикулярного ядра как одного из важных звеньев эндогенной анальгетической системы головного мозга. Установлено, что его электрическое раздражение сопровождается отчетливой аналгезией, которая не связана с активацией рядом расположенных клеток или нисходящих волокон, поскольку локальная стимуляция нейронов латерального ретикулярного ядра глутаматом также вызывала обезболивание [Gebhart G., Ossipov M., 1986; Sotgiu M., 1986, 1987]. При активации этого ядра селективно угнетались ответы нейронов заднего рога спинного мозга не только на естественное ноцицептивное раздражение их кожных рецептивных
полей, но и на стимуляцию С-афферентов кожных нервов. В отличие от других анальгетических зон головного мозга при этом снижался наклон кривой зависимости стимул — ответ с одновременным увеличением порога нейронального ответа, что свидетельствует о качественно ином изменении самого процесса кодирования клетками спинного мозга ноцицептивной информации [Janss A., Gebhart G„ 1988].
Существенная функциональная особенность латерального ретикулярного ядра состоит в том, что оно вызывает постоянное тоническое (не связанное с искусственной активацией) нисходящее торможение, которое не выявлено у других анальгетических зон головного мозга или его наличие весьма проблематично. Нисходящее торможение из латерального ядра реализуется через дорсолатеральные канатики. Некоторая часть нисходящих волокон проходит в вентролатеральных канатиках [Jones S., Gebhart G., 1986]. Предполагается, что нейроны латерального ретикулярного ядра функционально гетерогенны и разные их популяции по-разному участвуют в регуляции болевой чувствительности. Некоторые из них выполняют функцию релейного звена в системе ЦСВ — ядра шва — спинной мозг и имеют морфологически идентифицированные прямые проекции из ЦСВ и ядер шва [Mantyh Р., 1983; Roste L. et al, 1985]. Более того, волокна, нисходящие из ЦСВ и большого ядра шва, конвергируют на одних и тех же нейронах латерального ретикулярного ядра [Sotgiu М., 1986, 1987]. О релейной функции этого ядра свидетельствуют данные, показывающие, что если разрушение большого ядра шва уменьшает на 25—50 % нисходящее торможение сегментарных ноцицептивных нейронов, вызванное стимуляцией ЦСВ, то последующая билатеральная деструкция латерального ретикулярного ядра полностью устраняет это торможение. Определенная популяция клеток латерального ядра, отвечающих на ноцицептивное периферическое раздражение, по-видимому, выполняет роль релейного звена, но уже в системе «обратной связи», модулирующей запуск анальгетических зон ЦСВ и ядер шва.
Усилившийся в последние годы интерес исследователей к латеральному ретикулярному ядру обусловлен и тем обстоятельством, что оно одновременно играет чрезвычайно важную роль в регуляции гемодинамики. Именно вентролатеральная зона головного мозга, по общепризнанному представлению, является одним из основных источников тонической активации вазомоторных преганглионарных нейронов спинного мозга [подробнее см.: Willette R. et al., 1983; Ross С. et al„ 1984; Granata A. et al., 1985]. Раздражение этой области или активация ее нейронов глутаматом вызывает не только аналгезию, но и тахикардию, прессорные реакции, усиление сердечного выброса, а деструкция латерального ретикулярного ядра сопровождается гиперальгезией, гипотензией и брадикардией [Gebhart G., Ossipov М., 1986; Janss A. et al., 1987]. В работах А.А. Зайцева и соавт. (1982), О.С. Медведева и соавт. (1987), А. Б. Фана, А.В. Красюкова (1987) показано, что стимуляционная аналгезия при раздражении ЦСВ лишь в 10 % случаев не сопровождалась повышением артериального давления, а по мере
усиления транскраниальной стимуляции и углубления аналгезии развивались гипертензивные сдвиги, достигавшие 30—40 % от исходных значений артериального давления. В недавних исследованиях нашей лаборатории [Богданов Е.Г., 1987; Хван А.А., 1987] четко прослежена зависимость между артериальной гипертензией, тахикардией и увеличением симпатической биоэлектрической активности по мере усиления стимуляционной аналгезии, вызванной раздражением ЦСВ среднего мозга (рис. 11).
Очевидно, что гемодинамическая направленность влияния «анальгетических систем» во многом определяется активируемой структурой головного мозга. Установлено, что селективное торможение ноцицептивных ответов нейронов заднего рога спинного мозга развивается только при стимуляции ЦСВ среднего мозга и сопровождается повышением мышечного кровотока и его снижением в коже, т.е. компонентами типичной «защитной» реакции. В то же время раздражение вентральной покрышки головного мозга неселективно тормозит ответы нейронов на болевые и неболевые стимулы и не вызывает сдвигов гемодинамики [Duggan A., Morion С., 1983]. Примечательно, что типичная сердечно-сосудистая «защитная» реакция возникает и при активации нейронов ЦСВ гомоцистеиновой кислотой [McDognall A. et al., 1985], а также при химической (микроинъекции катехоламинов) и электрической стимуляции дорсального ядра шва [Robinson S., 1984]. Считают, что одновременное подавление на уровне спинного мозга проведения болевых импульсов и увеличение кровоснабжения мускулатуры представляют адаптационную реакцию организма на вредные воздействия. Эта гипотеза определяет общебиологическое значение «антиноцицептивных» механизмов, а в более широком смысле — позволяет рассматривать регуляцию боли и гемодинамики как единый, взаимосвязанный процесс.
Рис. 11. Влияние стимуляции ЦСВ среднего мозга на системную гемодинамику в норме (а) и на фоне ноцицептивного раздражения кожного нерва (б) у бодрствующей кошки.
Стимуляция среднего мозга с интенсивностью 1В, 3 В и 6 В соответственно. МИ — межсистольные интервалы. АД — артериальное давление.
Таким образом, анальгетические системы головного мозга являются ключевыми механизмами формирования боли и изменения реакций организма на боль. Им, по-видимому, не свойственны такая селективность и функциональная детерминированность, какие присущи мономодальным системам — зрительной, слуховой. Различные анальгетические системы функционируют не изолированно, а взаимодействуя между собой и с другими системами, они регулируют не только болевую чувствительность, но и сопряженные с болью разномодальные — от простейших защитных рефлексов до сложноинтегрированных вегетативных и эмоциональных, поведенческих реакций — проявления боли. В свою очередь, болевые ноцицептивные воздействия являются основными факторами, активирующими (запускающими) эндогенные болеутоляющие системы.
НЕЙРОФИЗИОЛОГИЧЕСКИЕ И НЕЙРОХИМИЧЕСКИЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ ГЕМОДИНАМИЧЕСКИХ НОЦИЦЕПТИВНЫХ РЕАКЦИЙ
Боль, выполняющая на начальном этапе несомненно сигнальную функцию, определяет ответные реакции организма, направленные на мобилизацию разномодальных регуляторных систем для устранения ноцицептивного воздействия или его последствий. Наряду с включением механизмов, определяющих эмоционально-аффективные проявления боли, которые в функциональном плане являются одновременно стимулом к активному предотвращению чрезвычайного вредоносного раздражителя, также активируются процессы вегетативного реагирования. Особую значимость среди них имеют изменения сердечно-сосудистой системы. Гемодинамические реакции, возникающие на этапе ощущения боли, «болисигнала», направлены прежде всего на обеспечение возросших нутритивных потребностей скелетной мускулатуры, необходимых для реализации комплекса аффективно-моторных актов активной обороны или избегания. С общебиологических позиций такие реакции сердечно-сосудистой системы имеют адаптивное значение.
Иная ситуация складывается при продолжающемся и (или) усиливающемся ноцицептивном воздействии, особенно когда в силу ограничивающих влияний различных факторов (биологических и социальных у человека) гемодинамические сдвиги, запускаемые болевыми стимулами, не могут реализоваться в процессе двигательных актов. В этих условиях сердечно-сосудистые реакции утрачивают свой адаптивный смысл и приобретают значение самостоятельных патогенетических факторов развития патологического состояния. Следовательно, нормализация сдвигов сердечно-сосудистой системы должна быть неотъемлемым компонентом
оптимального лекарственного обезболивания. К сожалению, данные экспериментальной фармакологии и опыт клинической медицины свидетельствуют о малой эффективности влияния существующих болеутоляющих средств на гемодинамические реакции ноцицептивного генеза, что во многом обусловлено недостаточной изученностью механизмов регуляции функции сердечно-сосудистой системы при боли. Ключевое значение в этом плане имеет вопрос об общности или разобщенности нейрофизиологических механизмов формирования эмоциональноаффективных и гемодинамических проявлений боли.
Суммируя экспериментальные данные и результаты клинических наблюдений, можно заключить, что ноцицептивные стимулы различной природы вызывают, как правило, гипертензивные и тахикардические реакции, сопровождающиеся разнонаправленными изменениями органного кровотока и биохимическими проявлениями симпатико-адреналовой активации [Розонов Ю.Б., 1976; Зайцев А.А. и др., 1980; Дмитриев А.В., 1982; Игнатов Ю.Д., Зайцев А.А., 1987; Kissin I. et al., 1983; Kuchner M., Alavi A., 1985; Freye E., 1987, и мн. др.]. Описаны также депрессорные ноцицептивные реакции, однако они возникали лишь на фоне сверхглубокого наркоза или под влиянием субстанций типа брадикинина, обладающих прямым сосудорасширяющим свойством [Фолков Б., Нил Э., 1976; Панов А.В., 1988]. У бодрствующих животных в ряде исследований выявлена четкая корреляция между сдвигами гемодинамики и эмоциональноаффективными проявлениями боли различного генеза [Медведев О.С., Степочкина Н.А.» 1977; Дмитриев А.В., 1982; Зайцев А.А., Бершадский Б.Г., 1984].
Конкретный нейрофизиологический субстрат реализации ноцицептивных вазомоторных рефлексов мало изучен. Предполагается, что ноцицептивная импульсация вызывает прессорные реакции, характерными особенностями которых являются крутой фронт нарастания и высокая амплитуда (рис. 12). Эти реакции возникают не в результате активации специализированных «болевых» рецепторов, а вследствие возбуждения тонких афферентов. Для развития ноцицептивных вазомоторных рефлексов необходимо, чтобы суммарный поток импульсов от данного рецептивного поля достиг некоторой критической интенсивности, которая определяется количеством возбуждаемых тонких волокон, частотой их разрядов и степенью удаленности данного поля от входа в спинной мозг [Хаютин В.М., 1980]. Показано, что селективное раздражение А-δ-афферентных волокон приводит к возникновению однокомпонентного симпатического разряда в почечном нерве и небольшим сдвигам артериального давления, а при активации С-волокон формируется вторая волна биоэлектрического ответа и резко увеличиваются амплитуда и скорость нарастания прессорной реакции артериального давления [Богданов Б.Г., 1986; Mense S., 1983]. Однако С- волокна не являются единственными проводниками информации, ответственной за возникновение ноцицептивных прессорных реакций, поскольку такие реакции, вызванные растяжением кишечника, сохраняются в
полном объеме после введения капсаицина, вызывающего дегенерацию тонких афферентных волокон [Lembeck F., Skotitsch G, 1982].
Рис. 12. Рефлекторные реакции артериального давления у наркотизированной уретаном кошки, вызванные поочередным введением ацетилхолина (I) и мехолина (II) в сосуды перфузируемой тонкой кишки (по В.М. Хаютину, 1980). Приведены дозы препаратов.
В основе гипертензивных сдвигов, запускаемых ноцицептивным воздействием, лежит активация симпатических механизмов различных уровней ЦНС. Примечательно, что гемодинамические ноцицептивные реакции отчетливо коррелируют с С-компонентом сомато- и висцеросимпатических рефлекторных ответов. Однако это вовсе не означает, что супрасегментарные вазомоторные механизмы играют основную роль в формировании ноцицептивных реакций артериального давления, поскольку в последние годы существенной ревизии подвергнуты представления о том, что С-ответы (С-симпатические рефлексы) интегрируются на супрасегментарном, а А-рефлексы — на сегментарном уровне ЦНС. Установлено, что большинство компонентов симпатических рефлекторных ответов целиком или частично реализуются через спинной мозг [Хаютин В.М., 1980; Лебедев В.П., 1986].
Нейрофизиолргическим субстратом сегментарных гемодинамических реакций являются преганглионарные симпатические нейроны, локализованные преимущественно в боковом роге спинного мозга, а также в промежуточной зоне и вблизи центрального канала. Цитоархитектоника и свойства преганглионарных симпатических нейронов подробно изложены в ряде обобщающих работ [см.: Лебедев В.П., 1986; Janig W., 1982].
Аксоны этих нейронов не только выходят через передние корешки и достигают ганглиев, но и распространяются внутри спинного мозга, образуя проприоспинальный симпатический тракт. Посредством проприоспинальной системы преганглионарные нейроны активируются соматическими и висцеральными стимулами, и эта система участвует в генерализации
симпатических рефлексов. Именно вовлечение через систему проприоспинальных связей преганглионарных нейронов различных сегментов определяет сдвиги системной гемодинамики, сопряженные с изменениями регионарного кровообращения, прежде всего в скелетных мышцах и мезентериальных сосудах, как наиболее массивных (емких) сосудистых зонах, которые необходимы для реализации поведенческих реакций избегания или устранения вредоносного стимула. Очевидно, что структура гемодинамической реакции при этом достаточно универсальна и вполне соответствует картине, сопровождающей типичную реакцию типа «страх—ярость», которая включает повышение артериального давления, увеличение сердечного выброса, сужение сосудов почек и желудочнокишечного тракта с одновременным расширением сосудов скелетных мышц, связанным с активацией системы холинергической вазодилатации [Вальдман А.В. и др., 1979]. Можно предположить, что генерализация, и вместе с тем отчетливая регионарная дифференцировка сдвигов кровообращения при боли, обусловлена не только активацией проприоспинальной системы интермедио-медиального ядра, но и синергичным функционированием проприоспинальных систем спинного мозга разной модальности [Костюк П.Г., Преображенский Н.Н., 1975; Cervero F., 1983, 1985]. Об этом же свидетельствует прямая зависимость между выраженностью и генерализацией моторных реакций и реакций сердечно-сосудистой системы при увеличении интенсивности ноцицептивного раздражения.
Несомненно, что сам сегментарный уровень вазомоторной регуляции не в состоянии полноценно регулировать кровообращение в норме и тем более при боли. Изменение кровообращения в разных регионах организма в рамках генерализованной симпатико-адреналовой активации при боли требует тонких модулирующих влияний, реализуемых структурами супрасегментарного и прежде всего — бульбарного уровня. Многочисленными исследованиями доказано существование специфических «вазомоторных» нейронов в ядрах продолговатого мозга, получающих проекции от «собственных» рефлексогенных зон сердечно-сосудистой системы [подробнее см.: Фолков Б., Нил Э., 1976; Лебедев В.П., 1986]. Установлено существование специализированных нисходящих проекций бульбарных нейронов к симпатическим нейронам спинного мозга. Примечательно также, что восходящий поток ноцицептивных сигналов интегрируется как раз в структурах бульбарного отдела головного прессорных сдвигов артериального давления при боли и в значительной мере определяет индивидуальные особенности гемо динамического обеспечения нопицептивных реакций. Более того, имеющиеся в настоящее время данные позволяют рассматривать собственный гомеостатический механизм сердечно-сосудистой системы — барорецепторные рефлексы, — как универсальную систему «генерализованного торможения», при запуске которой, наряду с ослаблением гипердинамических сдвигов кровообращения, развивается угнетение психомоторных функций и аверсивных реакций различной, и в том числе ноцицентивной, природы [подробнее см.: Randich
A., Maixner W., 1984]. Сердечно-легочные и синоаортальные бароафференты модулируют нейротранссмиссию в различных образованиях продолговатого мозга: гигантоклеточном ядре, ядре солитарного тракта, «синем пятне» и некоторых других. В этих же структурах представлены соматические и висцеральные входы от спиноталамического и спиноретнкулярного трактов, которые проецируются из I, IV, V и VII пластин заднего рога спинного мозга и осуществляют передачу ноцицептивных сигналов к гипоталамолимбическому комплексу и коре. Широкие анатомические связи различной модальности на бульбарном уровне являются основой установленного в электрофизиологических экспериментах барорефлекторного торможения болевой импульсации как от кожи, так и от внутренних органов. Очевидно, что ведущая роль в этих процессах принадлежит ядру солитарного тракта, что подтверждается высоким содержанием в нем опиатных рецепторов, а также развитием налоксонзависимой аналгезии при микроинъекциях опиатов в это ядро [Lewis J. et al., 1987].
Приведенные данные доказывают тесную взаимосвязь сдвигов кровообращения при боли с ее эмоционально-аффективными проявлениями. Вместе с тем они не позволяют ответить на вопрос об особенностях формирования разномодальных ноцицептивных реакций в рамках вегетомоторного сопряжения, имеющий стратегическое значение для оптимизации медикаментозной терапии болевых синдромов. Важно подчеркнуть, что уже сам факт развития гипертензии и тахикардии под влиянием ноцицептивных стимулов у наркотизированных животных, а также данные клинической анестезиологии о резистентности гемодинамических и эндокринных сдвигов к болеутоляющим средствам позволяют предполагать существование таких особенностей.
Определенную ясность в этот вопрос внесли исследования последних лет, посвященные роли антиноцицептивных систем головного мозга в регуляции кровообращения.
Весьма вероятно, что антиноцицептивные системы обладают тонической активностью, поскольку разрушение ЦСВ среднего мозга у крыс приводит к тахикардии [Bernet F., Denimal J., 1982]. У децеребрированных кошек прессорные ноцицептивные рефлексы развиваются только при сохранении связи продолговатого мозга со средним и когда от продолговатого мозга отделена его ростральная часть, примыкающая к мосту [Хаютин В.М., 1980]. Следовательно, часть антиноцицептивных систем, локализующаяся в области понтобульбарного соединения, способна тонически подавлять ноцицепгивные вазомоторные рефлексы без искусственной активации нисходящих путей. Активация антиноцицептивных структур вызывает не только аналгезию, но и изменения спонтанного поведения и фоновой гемодинамики, в частности артериальную гипертензию [Игнатов Ю.Д., Зайцев А.А., 1987; Janss A. et ai., 1987; Depauiis A. et al., 1988]. Электрическое раздражение околоводопроводного серого вещества среднего мозга, вызывающее стимуляционную аналгезию у бодрствующих кошек, может одновременно и зависимо от интенсивности центральной
стимуляции уменьшать гемодинамические ноцицептивные реакции [Зайцев А.А. и др., 1982]. Такое же действие выявлено и при опосредованной активации антиноцицептивных зон головного мозга, которая происходит при акупунктурной аналгезии и при аналгезии, вызванной транскраниальной электростимуляцией [подробнее см.: Игнатов Ю.Д, Зайцев А.А., 1987; Лебедев В.И. и др., 1987]. В клинических условиях транскраниальная электроаналгезия предупреждает вегетативные и гормональные сдвиги при болезненных диагностических манипуляциях, сохраняющиеся на фоне медикаментозного анестезиологического пособия у различных групп больных, а у пациентов с лабильной артериальной гипертензией — вызывает отчетливое длительное снижение систолического и диастолического артериального давления. В экспериментах на бодрствующих кроликах транскраниальная аналгезия угнетала прессорные реакции артериального давления, вызванные раздражением А- и С-волокон седалищного нерва, уменьшала амплитуду позднего компонента соматосимпатического рефлекса, и в меньшей степени — подъем артериального давления в ответ на окклюзию сонных артерий.
Вместе с тем выраженность стимуляционной аналгезии зависит от интенсивности раздражения, и она пропорциональна повышению системного артериального давления [Игнатов Ю.Д., Зайцев А.А., 1987]. По нашим данным, аналгезия, аналогичная стимуляционной, возникала и при повышении артериального давления мезатоном, оказывающим сугубо периферическое адреномиметическое действие (рис. 13). В данном случае аналгезия причинно связана с гипертензией, поскольку проявлялась она только в период подъема артериального давления и прогрессировала при последовательном ступенчатом его повышении при повторном введении мезатона. Характерно, что налоксон не устранял аналгезию, вызванную мезатоновой гипертензией, и лишь частично ослаблял стимуляционную аналгезию, возникающую на фоне выраженной гипертензии.
Гипертензия, развивающаяся на фоне стимуляционной аналгезии, указывает на возможность синергичного функционирования собственно болевого (антиноцицептивные системы) и собственно сердечно-сосудистого (барорефлексы) гомеостатических механизмов. По имеющемся данным [подробнее см.: Randich A., Maixner W., 1984; Naranjo J., Fuentes J., 1985], при искусственной активации барорецепторов уменьшается выраженность реакции избегания крыс на стимуляцию тройничного комплекса. У людей по мере формирования эссенциальной гипертензии обнаруживается снижение реактивности к раздражению пульпы зуба, аналогичные изменения характерны для животных с различными формами гипертензии, причем билатеральная синоаортальная денервация снижает у них болевые пороги. Установлено, что структуры бульбарного уровня, такие как парагигантоклеточное ядро или гигантоклеточное, получающее ноцицептивные входы и непосредственно участвующие в реализации барорефлекторных влияний [Lewis J. et al., 1987; Lovick Т., 1987], имеют прямые проекции как от нейронов ядра солитарного тракта, так и от
нейронов большого ядра шва. Именно эти конвергентные бульбарные образования участвуют в формировании опиатной и неопиатной аналгезии и угнетении функции сердечно-сосудистой системы.
Рис 13. Изменения ноцицептивных реакций в зависимости от сдвигов артериального давления, вызванных вазоактивными препаратами.
Числа у графиков — латентный период отдергивания хвоста (в числителе) и порог вокализации (в знаменателе) и % от контроля; по оси ординат - уровень артериального давления (мм рт ст.) Стрелками указано введение мезатона (М), натрия нитропруссида (НН) налоксона (Н — 1 мг/кг). АНЦ; — раздражение среднего мозга с интенсивностью. вызывающей максимальную стимуляционную аналгезию. * — р<0.05 по сравнению с контролем.
Существует несомненная связь между барорефлекторными механизмами регуляции болевой чувствительности и процессами, возникающими при активации антиноцицептивных зон головного мозга. Очевидно, что при их градуально усиливающемся раздражении последовательно запускаются механизмы, кардинально различающиеся по нейрохимическому профилю. Начальные проявления стимуляционной аналгезии формируются за счет опиоидергических систем нисходящего торможения, в то время как усиление аналгезии опосредуется неоплатными механизмами, одновременно обеспечивающими гемодинамические предпосылки для избегания аверсивного раздражения. Развивающаяся при этом артериальная гипертензия может быть фактором, запускающим через барорецепторы высокого давления барорефлекторные механизмы регуляции эмоционально-аффективных проявлений боли. С другой стороны, равновероятна возможность непосредственной активации центральных звеньев барорефлексов в процессе раздражения антиноцицептивных систем головного мозга. Это положение доказывается нашими данными, показывающими, что стимуляционная аналгезия сохранялась в полном объеме на фоне введения натрия нитропруссида в дозе, не изменяющей фонового артериального давления, но препятствующей его повышению при раздражении антиноцицептивных зон мозга, т.е. натрия нитропруссид исключал активацию барорефлексов через периферические сосудистые рецепторы (см. рис. 13). Следовательно, эти данные позволяют предполагать

взаимодействие барорефлексов и антнноцицептивных систем на супрасегментарном уровне ЦНС.
Важно подчеркнуть, что болеутоляющая функция барорецепторных рефлексов проявляется лишь в достаточно узком диапазоне и по мере усиления ноцицептивного воздействия происходит как бы ускользание болевых импульсов от бароконтроля, их «прорыв» к вышележащим структурам головного мозга, интегрирующим вокализацию и другие типичные компоненты генерализованной эмоционально-аффективной реакции на боль. Учитывая структурную иерархию и последовательность включения при боли разных гомеостатических механизмов, можно предположить, что «анальгетические системы» как раз определяют диапазон барорефлекторной регуляции, ограничивая ее эффективность при очень сильных воздействиях. Подобный характер взаимоотношений двух гомеостатических систем оправдан с точки зрения биологической целесообразности, поскольку устранение бароконтроля является одним из ведущих механизмов формирования гипердинамических сдвигов кровообращения при боли, необходимых для устранения аверсивного воздействия.
Представленный фактический материал свидетельствует о сложности и многочисленных особенностях нейрофизиологических механизмов
формирования и регуляции сердечно-сосудистых реакций при боли. Главная из них заключается в самой функциональной значимости ноцицептивной информации, приводящей различные системы организма в состояние
максимальной готовности и, следовательно, создающей крайне сложную взаимосвязь вазомоторных механизмов — нейрогенных и гуморальных. Не до конца понятно и, по-видимому, необычно участие барорефлекторных механизмов в регуляции комплексной ноцицептивной реакции организма. Из имеющихся данных следует, что барорефлексы регулируют не только гемодинамические, но и поведенческие ноцицептивные реакции, причем их «антиноцицептивное» действие проявляется как при естественной активации барорецепторов при повышении артериального давления, так и при первичном запуске антиноцицептивных систем среднего мозга.
Ключевую роль в регуляции различных проявлений боли играют антиноцицептивные системы головного мозга, которые, с одной стороны, тормозят негативные эмоции и их моторные компоненты, а с другой — мобилизуют вегетативные функции на избегание повреждающего воздействия. На наш взгляд, тесная взаимосвязь между стимуляционной аналгезией и артериальным давлением отражает разобщенность механизмов регуляции разномодальных функций при боли как крайнем варианте аверсивного ощущения. Недаром отмечают сходство сдвигов гемодинамики (повышение артериального давления, тахикардия, усиление мышечного кровотока) при электрической или химической (гомоцистеиновая кислота) активации среднего мозга с изменениями кровообращения при типичной «защитной реакции» [Duggan А., 1982; McDongall A. et а1., 1985]. По крайней мере, это оправдано с точки зрения биологической целесообразности и

позволяет рассматривать антиноципептивные системы не только как механизмы подавления боли, но и как механизмы, обеспечивающие предпосылки к ее активному избеганию с целью устранения повреждающего воздействия.
Таким образом, несмотря на тесную взаимосвязь механизмов формирования эмоциональных, моторных и гемодинамических проявлений боли не вызывают сомнения особенности реализации ее разномодальных компонентов, определяемые на уровне нейромедиаторных и даже рецепторных механизмов. Полинейрохимизм процессов формирования реакций сердечно-сосудистой системы при боли изучен в значительно меньшей степени, чем нейромедиаторные механизмы регуляции эмоциональных и моторных ноцицептивных реакций. Несмотря на сформировавшееся мнение о важной роли в регуляции кровообращения в норме и при патологических состояниях серотонинергических и ГАМКергических систем [подробнее см.: Шмуйлович Л.М., Кудрин А.Н., 1987; De Feudis F., 1983; Krstic M„ 1985; Syrnoens J., Janssens M., 1986; Bom A. et al., 1988], практически отсутствуют данные, позволяющие обосновать их значение в контроле гемодинамики при боли. Подробнее исследованы опиоид- и адренергические механизмы, что, по-видимому, обусловлено их базовой ролью в регуляции болевой чувствительности и сердечнососудистых функций соответственно.
В ряде обзоров последних лет обсуждается значение опиатных нейропептидов в вазомоторных механизмах головного и спинного мозга, в функционировании нисходящих систем ствола головного мозга, барорефлексах и других процессах, определяющих вегетомоторное сопряжение [Вальдман А.В., Медведев О.С., 1982; Romagnano M, Hamill R., 1984; Howe P., 1985; Laubie M., Schrnitt H., 1985; Campbell G., 1986]. Радиоиммунологически показано совместное распределение на всем протяжении спинного мозга млекопитающих симпатических нейронов и энкефалинсодержащих волокон, что рассматривается как морфологическая основа опиоидергической регуляции вегетативных функций. Энкефалины, эндорфины и опиатные рецепторы выявлены также в других структурах ЦНС, участвующих в контроле за кровообращением. Предполагается, что метэнкефалин определяет «прессорные» системы организма, тогда как β- эндорфин составляет основу «депрессорных» систем.
По-видимому, опиоидергические системы регуляции гемодинамики обладают незначительной тонической активностью, поскольку, по данным большинства авторов, налоксон в дозах, блокирующих различные типы опиатных рецепторов, не вызывает закономерных сдвигов артериального давления и частоты сердечных сокращений у нормотензивных животных и людей [Вальдман А.В., Медведев О.С., 1982; Fuehmayor N.. Cubeddu L., 1986]. Это представление подтверждается результатами многочисленных экспериментов и клиническими наблюдениями, в которых на фоне морфина, фентанила и других опиоидов в оптимальных анальгетических дозах наблюдается стабильность или незначительная депрессия фоновых
показателей системной и регионарной гемодинамики [Ghoneim M et а1 1984; Goldstein G., 1985; Freye F, 1987].
Использование налоксона позволило установить важную роль опиоидергических механизмов в колебаниях артериального давления в процессе физиологического сна и при эмоциональном стрессе, в формировании артериальных гипертензий, гипотензии при травматическом, геморрагическом, септическом и других видах шока [Bell J. et а1., 1985; Мееr К. et а1., 1986; Naranjo J. et а1., 1986; Ludbrook J., Rutter P., 1987]. У наркотизированных собак налоксон не изменяет гипертензивные сдвиги при стимуляции n. saphenus, но в условиях ваготомии и денервации синусов усиливает прессорные реакции артериального давления, вызванные раздражением афферентных волокон группы А-б. У интактных и спинальных животных налоксон усиливает вокализацию и повышает амплитуду С- рефлекса при стимуляции соматического нерва. Следовательно, не вызывает сомнений участие опиоидергических механизмов в формировании сдвигов системной гемодинамики при аверсивных воздействиях. Однако до настоящего времени противоречивы представления не только об их нейрофизиологической организации, но и о функциональной направленности. Предполагается, что гемодинамические эффекты опиатов реализуются преимущественно через супрасегментарные структуры, поскольку децеребрация не изменяет, а спинализация ослабляет блокирующее влияние налоксона на гипотензивное и брадикардическое действие морфина [Feldberg W., 1980]. Существенное значение придается и опиоидергическим процессам в спинном мозге [Marshally D., Buccafusco J., 1985; Maurette P. et al„ 1985].
Следует подчеркнуть, что гемодинамические ноцицептивные реакции справедливо рассматриваются в качестве коррелятов эмоциональноповеденческих проявлений боли, обеспечивающих нутритивную функцию и, следовательно, определяющихся во многом активностью скелетной мускулатуры. С этих позиций сформировалось аксиоматическое представление о принципиальной идентичности опиоидергических механизмов регуляции разномодальных компонентов болевых реакций. Анализ собственных результатов (табл. 1) и данных литературы показывает, что на фоне торможения поведенческих проявлений боли гемодинамические сдвиги либо достоверно не изменяются, либо даже могут увеличиваться, причем резистентность сердечно-сосудистых ноцицептивных реакций характерна для всех основных болеутоляющих средств (морфина, промедола, фентанила, пентазоцина и др.) в диапазоне анальгетических доз (подробнее см. гл. 2). Эта диссоциация не зависит от природы болевых стимулов — механических, электрических, термических, химических. Приведенные результаты позволяют предполагать, что процессы опиоидергической регуляции разномодальных функций организма могут быть разобщены и что именно нейрохимическая разобщенность определяет особенности нейрофизиологических процессов регуляции гемодинамики при боли [Игнатов Ю.Д., Зайцев А.А., 1984; Игнатов Ю.Д. и др., 1987].
