
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / Научные тренды продления жизни
.PDF
CD4–клетки можно уничтожать с помощью антител к их маркерам
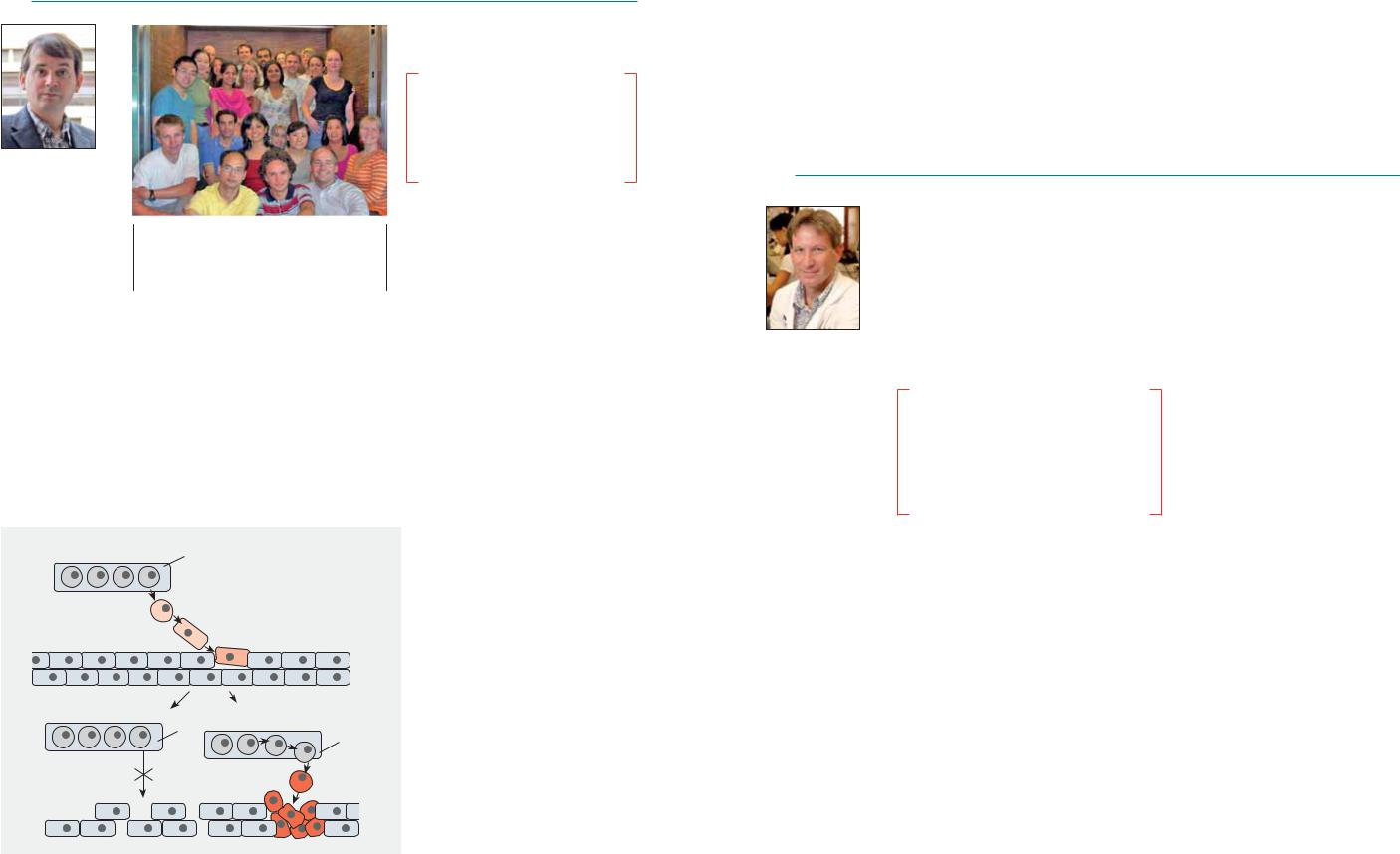
В лаборатории доктора Хейнес изучают влияние старения на иммунную систему.
Для «омоложения» популяции Т-клеток, которая более всего затрагивается старением, необходимо уничтожить плохо
функционирующие клетки и освободить пространство для новых иммунных клеток.
В исследованиях группы Хейнес, проводившихся на мышах было показано, что у старых мышей CD4+ наивные клетки нормально не функционируют и экспрессируют низкое количество молекулы CD40L.
Ученые уничтожили все CD4 клетки с помощью антител к их маркеру.
Через два месяца у старых мышей восстановилась популяция наивных Т-клеток. При этом все они прекрасно выполняли свои функции.
Лора ХЕЙНЕС (Laura HAYNES)
Институт Трюдо (Trudeau Institute), Саранак-Лэйк, США
NK-клетки могут выступать как регулирующие при воспалении и аутоиммунных заболеваниях
Кристиан МЮНЦ (Christian MÜNZ)
Директор института Экспериментальной Иммунологии, Департамент патологии, Универсистетский Госпиталь Цюриха (Department of Pathology, University Hospital of Zurich), Германия.
Научные интересы Кристиана Мюнца – изучение иммунного контроля постоянных вирусных инфекций, в основном, вируса Эпштейна-Барра (EBV), терапия аутоиммунных заболеваний.
Естественные киллеры (NK) традиционно рассматривались как клетки, которые быстро убивают трансформированные и зараженные клетки, без предварительной активации.
Это обеспечивает первую линию защиты до начала адаптивного иммунного ответа против развития инфекции и опухоли.
Однако стало ясно, что NK взаимодействуют с различными компонентами иммунной системы, и поэтому имеют возможность функционировать как регулирующие клетки.
Исследование иммунорегуляторных свойств NK позволило бы пролить свет на NKопосредованный адаптивный и врожденный иммунитет, отслеживать NK-клетки в качестве маркеров при аутоиммунных болезнях и, возможно, разработать новые методы лечения.
| 178 | Научные тренды продления жизни
Онкогенез и старение
Выборочное ингибирование JNK блокирует боль и препятствует росту раковой опухоли
Петер ГЕРНЕР (Peter GERNER)
Центр исследования боли Департамента анестезиологии Гарвардской медицинской школы (Pain Research Center, Department of Anesthesiology, Harvard Medical School), Бостон, США
При лечении раковых заболеваний очень важно уменьшить болевые ощущения, которые постоянно испытывают пациенты.
Многочисленные исследования показывают, что C-Jun N-terminal киназы (JNK) причастны как к росту опухоли, так и к проявлению нейропатических болей.
Группа профессора Петера Гернера изучала роль JNK в росте опухоли и проявлении боли в модели рака кожи. Было подтверждено, что рост опухоли был связан с активацией JNK в опухолевой массе, спинном мозге и периферических нервах. В ходе исследований животным
была произведена инъекция пептида Д-JNKI-1 (селективного ингибитора JNK). В результате рост опухоли замедлился, а подопытные животные стали меньше реагировать
на раздражение, что говорит об уменьшении болевых ощущений.
В отличие от этого, инъекция морфина (5 мг/кг), обычно используемого как анальгетик на терминальной стадии рака, не ингибировала рост опухоли.
Данные исследований показывают, что JNK ингибиторы, такие как Д-JNKI-1, могут быть использованы для лечения рака и болевых синдромов.
Кавеолин-1 по-разному влияет на различные аспекты опухолевой прогрессии
Кавеолин-1 (Cav1) регулирует |
Кавеолин-1, с одной стороны, может |
|||
многие раковые процессы, включая |
функционировать как супрессор |
|||
трансформацию клеток, рост |
опухоли, а с другой – является |
|||
опухоли, клеточную миграцию |
и прогностическим фактором в |
|||
и метастазирование, а так же |
различных человеческих раковых |
|||
множественную лекарственную |
клетках. |
|||
устойчивость и ангиогенез. |
|
|
|
|
Однако, существует как |
|
Многолетние исследования показывают, что |
||
позитивное, так и негативное |
|
функции Cav1 взаимозависимы на стадии |
||
влияние кавеолина-1 |
|
опухоли и экспрессии молекулярных эффек- |
||
на различные аспекты |
|
торов, которые влияют на его роль в опухоле- |
||
опухолевой прогрессии. |
|
вой прогрессии. |
||
|
|
|
|
|
Иван Роберт НАБИ (Ivan Robert NABI)
Университет Британской Колумбии (University of British Columbia), Ванкувер, Канада
Научные тренды продления жизни | 179 |

«Выключение» гена кавеолина-3 защищает от рака молочной железы
Майкл ЛИСАНТИ (Michael LISANTI)
Департамент биологии рака Онкологического центра Киммел при Университете Томаса Джефферсона (Department of Cancer Biology, Kimmel Cancer Center, Thomas Jefferson University), Филадельфия, США
Основное направление в работе |
|
желез. Кавеолин-3 локализован в |
||||
лаборатории профессора Михаеля |
мышечных клетках, в том числе |
|||||
Лисанти – изучение роли кавеолина-1 |
и в миоэпителиальных клетках |
|||||
в нормальной и патогенной |
|
молочной железы. Изучался фетотип |
||||
сигнализации при развитии |
|
мышей CAV-3 (-/-) NULL, т.е. |
||||
опухолей. |
|
лишенных кавеолина-3. Его удаление |
||||
Работа лаборатории в течении |
|
вызывало состояние, похожее |
||||
|
на начальные стадии лактации. |
|||||
последних десяти лет показывает, |
||||||
Имплантировав опухолевые клетки, |
||||||
что кавеолин-1 функционирует |
|
|||||
|
ученые продемонстрировали, что |
|||||
в качестве «тормоза» во время |
|
|||||
|
CAV-3 (-/-) мыши защищены от |
|||||
проведения сигнала, что сродни |
||||||
образования опухолей молочных |
||||||
другим супрессорам раковой |
|
|||||
|
желез, возможно, как раз за счет |
|||||
опухоли. |
|
|||||
|
образований лактогенной среды. |
|||||
Ученые показали, что |
|
|||||
|
|
|
||||
функциональная потеря |
|
|
|
|
|
|
|
В текущих исследованиях планируется разработ- |
|||||
одного-единственного |
|
|||||
гена достаточна, |
|
|
ка новой терапии с помощью лактогенной среды |
|||
|
для профилактики и лечения рака молочной же- |
|||||
чтобы защищать |
|
|
||||
|
лезы человека. |
|||||
от рака молочных |
|
|
||||
|
|
|
|
|
||
Функциональная активность ММП снижается по мере развития опухоли
Матриксные металлопротеиназы (ММП), а также их тканевые ингибиторы (TIMP) играют важную роль в процессах опухолевого роста, ангиогенеза, инвазии, метастазирования и в значительной степени определяют злокачественность опухоли.
Влаборатории Татьяны Короленко для изучения фагоцитарной функции опухоль-ассоциированных макрофагов, а также уровня ММР/ TIMP -1 при опухолевом росте и метастазировании использовались мыши с трансплантированной аденокарциномой легких Льюис, метастазирующей в легкие. Для получения модели макрофагальной депрессии в печени, легких и опухоли мышам
однократно вводили хлорид гадолиния (ХГД).
Входе исследования было показано, что поглощение
ХГД клетками печени интактных мышей не влияло на концентрацию TIMP -1 в сыворотке крови и на активность ММП печени. Общая
активность ММП была минимальна в опухолевой ткани и снижалась по мере роста опухоли. Формирование метастазов в легких сопровождалось снижением активности ММП в легочной ткани. Рост опухоли сопровождался увеличением концентрации сывороточного
TIMP -1, но в меньшей степени по сравнению с мышами, получавшими ХГД. Развитие метастазов индуцировало снижение активности ММП в легких, ХГД не оказывал влияния на это процесс.
Татьяна
КОРОЛЕНКО
Лаборатория клеточной физиологии и биохимии Института физиологии СО РАМН, г. Новосибирск.
Нарушение нормальной функции теломер и их укорочение способствует геномной нестабильности и ускоряет клеточное старение
Джудит КЭМПИСИ (Judith CAMPISI)
Департамент изучения рака и ответов на повреждение ДНК, Отдел наук о жизни, Национальная лаборатория Лоренса Беркли Баковский институт изучения рака (Cancer & DNA Damage Responses Department, Life Science Division, Lawrence Berkeley National Laboratory, Buck Institute for Age Research), Беркли, США
Лаборатория профессора Джудит Кэмписи проводит многосторонние исследования механизмов старения, специализируясь на выяснении молекулярных причин старения клеток (когда клетки теряют способность к делению, оставаясь при этом функционально активными) и клеточной смерти, а также влияния повреждений и
репарации ДНК на преждевременное старение и генетические синдромы, предрасполагающие к раку.
Работы по изучению механизмов клеточного старения и роли теломер и связанных с теломерами белков в поддержании стабильности генома принесли Джудит Кэмписи мировую известность. Она также проводит активные исследования по выявлению роли геновсупрессоров опухолей, геномной нестабильности и окислительного стресса на формы клинической манифестации (фенотипы) старения и рака.
Научная группа Джудит Кэмписи установила, что старение клеток – это сложный многокомпонентный процесс.
Клетки, способные делиться, отвечают на различные стрессовые стимулы, которые могут вызвать клеточное старение.
К таким стимулам относится дисфункция теломер, повреждение нетеломерных участков ДНК, избыток митогенных сигналов (включая онкогенные сигналы, которые приводят к геномным нарушениям и хромосомным перестройкам), нарушение организации хроматина и т.д.
Клеточное старение приводит к коренным изменениям в фенотипе клетки. Клетка навсегда теряет способность к пролиферации. Изменяется профиль экспресии множества генов. Кроме того, многие клетки приобретают устойчивость к апоптозу.
|
КЛЕТКА |
Сильные |
Дисфункция |
митогенные |
|
|
сигналы |
|
теломер |
|
|
|
|
|
|
|
Нарушение |
Повреждение |
|
структуры |
|
хроматина |
|
ДНК |
|
|
|
|
ФЕНОТИП СТАРЕНИЯ
Остановка
клеточного
роста
Устойчивость
Изменения
к апоптозу
экспрессии
генов
Внастоящее время в лаборатории Дж. Кэмписи проводится активный поиск биомаркеров клеточного старения, позволяющих быстро определить наличие данного фенотипа у клеток.
Влаборатории
недавно разработана идентификационная система, использующая маркерный ген бета-галактозидазы для быстрой детекции клеток, приобретающих фенотип клеточного старения.
| 180 | Научные тренды продления жизни |
Научные тренды продления жизни | 181 | |
Укорочение теломер существенно сокращает пролиферативный потенциал стволовых клеток пожилых людей
Карл Леннард РУДОЛЬФ (Karl Lenhard RUDOLPH)
Научная группа старения стволовых клеток Макса Планка, Институт молекулярной биологии, Университет Ульма, (Max-Planck-Research Group on Stem Cell Aging,Institute of Molecular Biology University of Ulm), Ульм, Германия
Главное направление исследований научной группы профессора Рудольфа – изучение молекулярных причин процесса старения стволовых клеток взрослого организма.
У молодых или взрослых организмов ниши стволовых клеток эффективно замещают утраченные клетки:
стволовые клетки выходят из ниш, делятся и дифференцируют. В пожилом возрасте стволовые клетки имеют низкие уровни теломеразы, недостаточные для сохранения стабильности теломер. Поэтому
стволовые клетки в старости имеют укороченные теломеры и пониженную мобилизационную
Молодость или зрелость
(нормальные теломеры) ниша
|
Обновление ткани |
Время |
Мутации |
Старость |
Онкогенез |
(короткие теломеры) |
|
ниша |
(высокие уровни теломеразы) |
ниша
Опухоль
Стареющая
ткань
активность для эффективной регенерации тканей.
Короткие теломеры стволовых клеток препятствуют накоплению ненормальных и модифицированных клеток в здоровой ткани, тем самым снижая онкогенный риск.
Вместе с тем они ускоряют старение из-за низкой мобилизационной активности стволовых клеток и прогрессирующей дегенерации тканей. Стволовые клетки с аномально высокими уровнями теломеразы (это может произойти, например, в результате мутации)
мобилизуются более быстро, чем нормальные клетки. В таких условиях обновление ткани происходит быстро, но повышается риск развития рака.
В исследованиях профессора Рудольфа используется мышь, дефектная по теломеразе, в качестве модельной системы изучения процесса укорочения и сохранения
стабильности хромосом в стволовых клетках. Укорочение теломер значительно сокращает пролиферативный потенциал стволовых клеток взрослого организма. Установлено, что укорочение теломер индуцирует в клетке механизм внутреннего контроля и остановку клеточного цикла (intrinsic checkpoint) , снижающего самообновление и функцию взрослых стволовых клеток. Ингибирование этого механизма (например, делеция локуса Cdkn1/p15INK4b – циклинзависимого ингибитора киназ, инактивация экзонуклеазы-1) восстанавливало функцию стволовых клеток и продляло жизнь мышей с отсутствием теломеразы. Кроме того,
укорочение теломер способствует патологическим изменениям в окружении ниши стволовых клеток и развитию болезней стволовых клеток (гемопоэтическая дисфункция и проч). В Ганновере проф. Рудольф проводил исследования по
влиянию укорочения хромосом на регенеративную функцию печени и обнаружил, что укорочение хромосом в гепатоцитах связано с хромосомной нестабильностью и повышенным риском развития рака печени и цирроза печени.
Экспрессия опухолевого супрессора p16ink4a
в периферических Т-лимфоцитах может служить в качестве биомаркера старения
Норманн
ШАРПЛЕСС (Norman E. SHARPLESS)
Департаменты медицины и генетики, Школа медицины при университете Сев. Каролины, Центр углубленного изучения рака Линебергера (Departments of Medicine and Genetics, The University of North Carolina School of Medicine, Lineberger Comprehensive Cancer Center),Чепел-Хилл, США
Круг научных и медицинских интересов Норманна Шарплесса включает разработку новых
антираковых терапий, поиск биомаркеров старения, изучение меланом и генетические исследования рака. Главный фокус исследований в
лаборатории доктора Шарплесса – это изучение роли локуса опухолевого супрессора INK4a/ARF в развитии рака и в старении человека.
Экспрессия фактора p16INK4a, являющегося важным индуктором клеточного старения, заметно увеличивается с возрастом. Следовательно, экспрессия данного белка может служить своеобразным биомаркером физиологического (но не временного) старения.
В лаборатории доктора Шарплесса:
-обнаружено, что активация механизмов клеточного старения происходит в некоторых
самообновляемых клеточных компартментах организма и нишах стволовых клеток. Следовательно,
старение организма происходит по мере старения взрослых стволовых клеток.
-показано, что потеря клеточного
старения в данных компартментах и нишах ведет к раку. Следовательно,
рак и старение представляют собой, соответственно, потерю и успешное развитие клеточного старения в отдельных нишах стволовых клеток.
Поскольку фактор p16INK4a играет важную роль в предотвращении меланомы, в лаборатории также на протяжении длительного времени проводятся исследования этой особо опасной формы рака. Созданы несколько мышиных моделей
меланомы человека, используемых для тестирования новых антираковых терапевтических агентов. Показана репрессивная роль p16INK4a/RB- и ARF/p53зависимых супрессорных путей по отношению к меланоме
в ответ на активацию RAS/RAFзависимых сигналов. Открыт новый подтип экспрессионного профиля меланомы человека, что позволило обнаружить новую терапевтическую мишень – белок CD200 (мембранный гликопротеин-иммуномодулятор, регулирующий развитие миелоидных линий клеток и участвующий в проведении ингибирующего сигнала по отношению к развитию макрофагов) – для лечения меланомы.
| 182 | Научные тренды продления жизни |
Научные тренды продления жизни | 183 | |

Дефицит опухолевого супрессора р53 приводит к резкому сокращению жизни мыши и существенно усиливает риск онкогенеза
Лоренс
ДОУНХАУЭР (Lawrence A. DONEHOWER)
Департамент молекулярной и клеточной биологии Департамент молекулярной вирусологии и микробиологии Бэй-
лоровский колледж медицины, Хьюстон, шт. Техас, США Department of Molecular Virology & Microbiology
and Department of Molecular and Cellular Biology Baylor College of Medicine, Houston TX, USA
Основная научная тема Лоренса Доунхауэра – изучение роли супрессоров опухолей в развитии рака и старении с особым фокусом на исследовании защитных свойств фактора р53.
В лаборатории професора Доунхауэра были созданы мыши, дефектные по гену супрессора р53. Такие мыши имеют нормальное развитие, однако уже в раннем возрасте обнаруживают крайне высокую чувствительность к разнообразным формам рака.
Подобными фенотипами обладают
Когда активность р53 повышена при сохранении базовой регуляции, р53 защищает от рака, но не замедляет старение.
“сверх” мыши с дополнительными копиями генов р53 или ARFи мыши с генетически супрессированной актив-
ностью MDM2. “Сверх” мышь, несущая дополнительные гены р53 и ARF, имеет повышенную устойчивость к раку и длительную продолжительность жизни.
Совершенно иная ситуация возникает, когда нарушена нормальная регуляция р53. Потеря регуляции р53 была достигнута за счет удаления N-концевого домена белка, отвечающего за взаимодействие с MDM2. Так, «м»-мышь несет делецию размером в 500 т.п.н., в результате которой удалены 26 генов, следующих вслед за геном
р53, и первые 6 экзонов самого гена р53. Другой пример – мышь Р44tg, экспрессирующая укороченную форму р53 (p44).
В этих двух мышиных моделях р53 имеет повышенные стабильность и транскрипционную активность, что выражается в усилении
Мышиные модели, объясняющие роль р53 в старении
|
|
«сверх» |
|
|
р53-мышь |
|
Нормальное |
«сверх» |
|
старение |
ARF-мышь |
|
|
|
|
|
мышь с низкой |
Повышенная активность |
|
активностью MDM2 |
р53 и нормальная |
|
|
регуляция |
|
|
|
Задержка |
«сверх» |
|
старения |
р53/ARF-мышь |
Аберрантная активация |
Ускоренное |
«м»-мышь |
р53 из-за отсутствия |
|
|
регуляции со стороны |
старение |
|
MDM2 |
|
P44tg-мышь |
|
|
|
|
|
|
|
мышь, дефицитная |
|
Аберрантная активация |
|
|
|
|
|
|
по BRCA1 |
|
Ускоренное |
||||||||
р53 из-за постоянного |
|
|
|
|
|
|
||
стресса или |
|
|
|
старение |
|
|
|
|
повреждения клетки |
|
|
|
|
|
|
мышь, дефицитная |
|
|
||||||||
|
|
|
|
|
|
|
по ZMPTE24 |
онкоустойчивости, но ускоряет |
|
В настоящее время в лаборатории |
||
старение животных вследствие |
|
Доунхауэра проводятся исследования |
||
истощения регенеративной функции |
по выявлению молекулярных |
|||
тканей. Похожие фенотипы имеют |
|
механизмов влияния р53 на старение |
||
мыши, дефектные по генам BRCA1 |
|
на базе анализа созданных мышиных |
||
(фактор поддержания геномной |
|
моделей, мутантных по р53. |
||
стабильности) и протеазе |
|
|
|
|
ZMPTE24 и подверженные |
|
Полная потеря р53 высоко предрасполагает к |
||
постоянному стрессу на |
|
раку. Мышь с гиперэкспрессией р53 (р53 +/m) |
||
клеточном уровне из-за |
|
имеет гораздо более выраженную устойчи- |
||
персистирующих нарушений |
|
вость к раку, но более короткую продолжи- |
||
ДНК и хромосомной |
|
тельность жизни. |
||
нестабильности. |
|
|
|
|
Экспрессия теломеразы задерживает старение у мышей, устойчивых к раку
Мария БЛАСКО (María A. BLASCO)
Группа изучения теломер и теломераз, Программа молекулярной онкологии, Испанский национальный онкологический центр (Telomere and Telomerase Group, Molecular Oncology Program,Spanish National Cancer Research Center (CNIO)), Мадрид, Испания
Доктор Бласко изучает строение, регуляцию и функцию теломер, укорочение которых связано с сокращением жизнеспособности клеток, а укорочение и последующая стабилизация длины – с раковой трансформацией клетки.
Раковые клетки, как правило, имеют повышенные уровни теломеразной активности, что позволяет им непрерывно поддерживать высокий пролиферативный потенциал и способность опухолей к быстрой экспансии в здоровые ткани и метастазированию. Конститутивная экспрессия ревертазного домена теломеразы (домен TERT – telomerase reverse transcriptase), имеющего активность обратной транскриптазы, в мышах с генетически индуцированной устойчивостью к раку за счет усиления экспрессии супрессоров опухоли р53, р16 и р19ARF приводила к задержке старения и удлинению средней продолжительности жизни.
Полученные результаты свидетельствуют об эффекте антистарения конститутивной экспрессии теломеразы у млекопитающих.
В лаборатории Марии Бласко было недавно установлено, что
теломерные участки хромосом часто транскрибируются при участии РНК-полимеразы II, продуцируя некодирующие РНК (TERRA или TelRNA), состоящие из повторов UUAGGG. Накопление TERRA
в возрастных клетках связано с укорочением теломер, что делает их информативными биомаркерами клеточного старения. TERRA являются негативными регуляторами
теломеразы.
В карциномах человека отмечены низкие уровни TERRA, что отмечает их потенциальную защитную роль против рака путем ограничения зависимого от теломераз удлинения теломер в раковых клетках.
| 184 | Научные тренды продления жизни |
Научные тренды продления жизни | 185 | |

Высокая и тщательно контролируемая активность поли– ADP-рибозилирования может способствовать продлению жизни
Александр
БЮКЛЕ
(Alexander BÜRKLE)
Кафедра молекулярной токсикологии, Биологический факультет Университета Констанца (Chair of Molecular Toxicology, Department of Biology, University of Konstanz), Констанц, Германия
Область научных интересов включает изучение роли поли-ADP- рибозилирования в репарации ДНК и старении и нейротоксичности прионовых белков.
В1992 году Бюкле в соавторстве с К. Грубе описал положительную корреляцию между активностью
поли-ADP-рибозилирования (PARP1), индуцированного одноцепочечными разрывами ДНК, в периферических моноцитах и продолжительностью жизни у млекопитающих.
Впериферических моноцитах человека активность PARP-1 в 5 раз превышала активность PARP-1 в крысиных моноцитах за счет самоактивации путем рибозилирования фермента,
уровень которого в 2 раза превышал содержание рибозилированной PARP-1 в клетках крысы.
Свозрастом активность PARP падает и у человека, и у крыс.
Сдругой стороны, активность PARP
виммортализованных лимфоцитах, взятых у французских долгожителей
ввозрасте 100 и более превышала таковую в клетках представителей контрольной группы (возраст от 20 до 70 лет).
Таким образом, высокая (и тщательно контролируемая) активность PARP может способствовать продлению жизни через супрессию геномной нестабильности и онкогенеза.
Репарация ДНК |
|
Одно- и двухцепочечные |
||
|
разрывы ДНК |
|||
|
|
|||
Центросома |
|
Изменение |
||
|
||||
|
числа хромосом |
|||
|
|
|||
|
|
|
|
ОНКОГЕНЕЗ |
Теломера |
|
Укорочение/ |
||
|
||||
|
дисрегуляция |
|||
|
|
|||
|
|
|
|
|
Центромера |
|
Митотическая |
||
|
||||
|
дисрегуляция? |
|||
|
|
|||
|
|
|
|
СТАРЕНИЕ |
|
|
|
|
ТКАНЕЙ |
Клеточная смерть, |
|
Выживание мутированных и |
|||
|
|||||
опосредованная |
|
|
трансформированных клеток |
||
|
|
||||
PARP |
|
|
|
|
Увеличение повреждения |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
окружающих клеток |
Поли-ADP-рибозилирование регулирует не только репарацию ДНК, но имеет вклад и в другие аспекты сохранения геномной стабильности через взаимодействие с центросомой и хромосомными участками (теломеры и центромеры).
В сумме, активность клеточной PARP является важным фактором в ингибировании онкогенеза и тканевого старения.
Кластерин модулирует влияние окислительного стресса на клеточное старение
Эстафиос ГОНОС (Efstathios E. GONOS)
Программа молекулярного и клеточного старения, Греческий национальный научный фонд, Институт биологических исследований и биотехнологии (Molecular and Cellular Ageing Program, National Hellenic Research Foundation (N.H.R.F.), Афины, Греция
Основная область научных интересов доктора Гоноса включает анализ экспрессионных профилей различных тканей с целью проследить возрастные изменения в экспрессии генов и выявить гены, связанные с клеточным старением. В своих исследованиях он использует клональную систему эмбриональных фибробластов крысы.
С помощью этой системы были отобраны восемь генов, связанных с клеточным старением у млекопитающих.
Количественный анализ экспрессионных профилей выявил, что данные
гены активно экспрессируются в ряде тканях человека и крыс, подверженных ускоренному старению под действием различных стрессовых факторов. Дополнительный анализ показал, что ген аполипопротеина
J/кластерина (ген CLU) участвует
в регуляции сигналов, направленных на выживание клеток в стрессовых условиях. Кроме того, было обнаружено, что экспрессия фибронектина связана с процессом искусственно вызванного старения фибробластов.
Был проведен сравнительный количественный и качественный анализ клеток, изъятых у здоровых долгожителей в возрасте 100 и более лет, по их свойствам в культуре тканей, активности протеолитических ферментов, феномену укорочения теломер и экспрессионных профилей генов и показано, что клеточные характеристики долгожителей близки к таковым у
клеток молодых доноров, а отличие от клеток пожилых доноров.
Используя дифференциальные системы скрининга долгожителей, было выделено несколько генов, потенциально связанных с продолжительностью жизни.
Понимание процессов репарации ДНК поможет предотвратить развитие рака
Цель исследований научной группы Джеффри Маргисона – изучить механизмы, с помощью которых химические вещества, вызывающих алкилирование агентов, проявляют биологический эффект в живых организмах. Эти виды агентов присутствуют в окружающей среде, но могут также быть произведены нормальными эндогенными клеточными процессами.
Их биологические эффекты, включающие мутацию, злокачественное преобразование (канцерогенез) и смерть клетки, вызваны различными типами повреждения ДНК. Процессы репарации защищают ДНК от потенциально смертельных эффектов эндогенного повреждения.
В организме человека эти процессы, видимо, защищают клетки от злокачественного преобразования, но, к сожалению, они могут также быть от-
ветственны за сопротивление опухоли химиотерапии.
Понимание процессов репарации ДНК может внести вклад и в предотвращение, и в лечение рака.
Группа Джеффри Маргисона занимается разработкой стратегии улучшения эффективности терапии рака, с помощью влияния на конкретные процессы репарации ДНК. В результате был выявлен PaTrin-2 , мощный
ингибитор восстанавливающего ДНК белка, O6-алкилгуанин-ДНК- трансферазы.
В лаборатории Маргисона также было идентифицировано семейство
белков, связанных с алкилтрансферазами, которые были названы алкилтрансферазо-подобными белками.
Джеффри
МАРГИСОН
(Geoffry
MARGINSON)
Патерсон институт исcледований рака (Paterson Institute for Cancer Research)
Манчестер, Великоритания.
| 186 | Научные тренды продления жизни |
Научные тренды продления жизни | 187 | |

Антираковая терапия стимулирует развитие клеточного старения в опухолях-мишенях
Клеменс ШМИТ (Clemens A. SCHMITT)
Центр молекулярной медицины Макса Дельбрюка (Max- Delbrück-Center for Molecular Medicine), Берлин, Германия
В лаборатории профессора Шмита изучаются молекулярные механизмы клеточных ответов на стрессовое воздействие.
Онкогенные сигналы вызывают активацию стрессового ответа в нормальных клетках, который служит своеобразным «барьером» на пути превращения клетки из нормальной в опухолевую.
Стрессовые ответы сопровождаются индукцией апоптоза или клеточного старения для остановки предракового состояния в клетке и последующей гибели (изоляции) измененной клетки. Однако при длительной онкогенной стимуляции клетка может преодолеть данный барьер и безвозвратно приобрести онкогенный фенотип.
Для исследования клеточного ответа на стресс, вызванный действием антираковой терапии в лаборатории профессора Шмита были созданы мышиные модели лимфом и других опухолей с известными генетически-
ми нарушениями.
На базе данных моделей была показана противоопухолевая роль гистоновой метилазы Suv39h1,
ингибирование которой приводило к развитию у мышей лимфомы В-лимфоцитов, направляемой конститутивной экспрессией встроенного протоокогена Ras.
Метилирование гистона H3R9 (мишени для метилазы Suv39h1) у мышей, дефицитных по Suv39h1, пре-
дотвращало образование лимфом и инициировало процесс клеточного старения у В-клеток как защитного механизма против рака.
Была также установлена модулирующая роль генетических нарушений в локусе INK4a/ARF в чувствительности/устойчивости различных типов лимфом к противораковому лечению.
Открыт врожденный противораковый иммунный ответ у мышей
В лаборатории Чжэна Цуя в линии мышей BALB/c были обнаружены особи, устойчивые к введению в
организм больших летальных доз раковых клеток.
Установлено, что устойчивость к раку связана с наличием у мышей лейкоцитов, способных к выявлению и уничтожению раковых клеток в течение нескольких часов после заражения.
Из этих особей была основана линия SR/CR (Spontaneous regression/complete resistant). Ключевыми компонентами этого ответа являются гранулоциты, моноциты и есте-
ственные клетки-киллеры, которые обуславливают врожденный клеточный иммунитет. Было выявлено, что адаптивный перенос донорных лейкоцитов из линии мышей SR/CR может обеспечивать защиту чувствительных к раку мышей дикого типа от последующего введения им рако-
вых клеток, а также уничтожение уже имеющихся злокачественных опухолей без дополнительных процедур.
Это исследование предполагает возможность разработки аналогичного метода переноса лейкоцитов для человека, если удастся выявить людей с подобной антираковой активностью лейкоцитов и использовать их в качестве доноров.
Чжэн ЦУЙ (Zheng CUI)
Отделение патологий, Школа медицины Университета Уэйк Форест (Department of Pathology, Wake Forest University School of Medicine), ВинстонСалем, США
Хроническое воздействие стресса на клетки вызывает индукцию биомаркеров клеточного старения
Оливье ТЮССО (Olivier TOUSSAINT)
Лаборатория клеточной биохимии и биологии, Факультет биологии, Университет Намюра (Laboratory of Cellular Biochemistry and Biology, Faculty
of Biology, University of Namur) Намюр, Бельгия
|
|
|
|
|
Протеомный анализ |
||
|
|
|
|
|
позволил выявить несколько |
||
|
|
|
|
|
десятков белков, включая |
||
|
|
|
|
|
аннексин А2, IGFBP-3, |
||
|
|
|
|
|
кавеолин-1, гемоксигеназа-1, |
||
|
|
|
|
|
IL-1α и т.д., экспрессия |
||
|
|
|
|
|
которых была существенно |
||
|
|
|
|
|
выше в стареющих |
||
|
|
|
|
|
фибробластах. |
||
|
|
|
|
|
Группа доктора Тюссо |
||
Коллектив лаборатории клеточной |
биохимии |
||||||
также принимала участие |
|||||||
и биологии Намюрского университета под ру- |
|||||||
в общеевропейском |
|||||||
ководством доктора Тюссо изучает |
влияние |
||||||
окислительного стресса на клеточное старение, |
проекте GEHA (GEnetics |
||||||
используя культуры фибробластов и |
научные |
of Healthy Aging), цель |
|||||
подходы транскриптомики и протеомики. |
|
|
|
которого состояла в |
|||
Доктор Тюссо выдвинул гипотезу |
|
|
|
|
картировании генов, |
||
|
|
|
|
участвующих в регуляции |
|||
о том, что в клетках, подвергнутых |
|
|
продолжительности жизни, у |
||||
сублетальному воздействию |
|
|
|||||
|
|
европеоидов. |
|||||
стресса, должны вырабатываться |
|
|
|||||
|
|
|
|
|
|
||
биомаркеры клеточного старения. |
|
|
|
|
|
|
|
|
|
Был найден локус на хромосоме 11, |
|||||
В своих ранних исследованиях |
|
|
|||||
|
|
сцепленный с долголетием, который |
|||||
в начале 90-х он обнаружил, |
|
|
содержал |
целый ряд потенциальных |
|||
что обработка фибробластов |
|
|
генов-кандидатов «долголетия», вклю- |
||||
человека сублетальными дозами |
|
|
чая гены сиртуина-3 (SIRT3), инсулина |
||||
этанола и бутилгидропероксида |
|
|
(INS), тирозингидроксилазы (TH), инсу- |
||||
вызывала появление типичных |
|
|
линоподобного гормона роста-2 (IGF2) |
||||
морфологических признаков |
|
|
и протоонкогена HRAS1. |
||||
клеточного старения. Сходные |
|
|
|
|
|
|
|
|
|
В митохондриальной ДНК была |
|||||
изменения происходили при |
|
|
|||||
обработке клеток перекисью |
|
|
найдена мутация С150Т, влияющая |
||||
водорода. Также было |
|
|
на эффективность окислительного |
||||
показано, что длительная и |
|
|
фосфорилирования, и показано, |
||||
повторяющаяся обработка клеток |
|
|
что у пожилых людей происходит |
||||
провоспалительными цитокинами |
|
|
накопление митохондриального |
||||
(IL-1α, TNFα, TGFβ1) также вызывала |
|
варианта 150Т, связанного со |
|||||
появление биомаркеров старения. |
сниженной эффективностью работы |
|
дыхательной цепи митохондрий. |
||
|
| 188 | Научные тренды продления жизни |
Научные тренды продления жизни | 189 | |

Регенерация тканей и тканевая инженерия
Стволовые клетки
и их окружение (cтволовые ниши)
Воздействие инсулина объединяет эффекты режима питания и старения на поддержание герминальных стволовых клеток
Даниела
ДРАММОНД–
БАРБОСА
(Daniela DRUMMONDBARBOSA)
Лаборатория клеточной биологии и биологии развития Медицинского центра Университета Вандербилт, Нэшвиль. (Department of Cell and Developmental Biology, Vanderbilt University Medical Center, Nashville).
Известно, что режим |
|
|
|
|
|
клеток ниши, и за счет |
||
|
|
|
|
|
||||
питания сильно |
|
|
|
|
|
взаимодействия клеток |
||
влияет на старение |
|
|
|
|
|
ниши с ГСК. Изменение |
||
организма. У самок |
|
|
|
|
|
количества клеток |
||
дрозофил с хорошим |
|
|
|
|
|
ниши регулируется |
||
режимом питания с |
|
|
|
|
|
посредством сигнальной |
||
возрастом наблюдалось |
|
|
|
|
|
сети трансмембранного |
||
уменьшение количества |
|
|
|
|
|
рецепторного белка |
||
герминальных |
|
|
|
|
|
Notch. В то время |
||
стволовых клеток |
|
|
|
|
|
как взаимодействие |
||
(ГСК). А у самок, |
|
|
|
|
|
клеток происходит |
||
испытывающих |
|
|
|
|
|
посредством |
||
недостаток в питании, |
|
|
|
|
|
Е-кадгерина – |
||
снижение количества |
|
|
|
|
|
трансмембранного |
||
ГСК было гораздо |
|
|
|
|
|
гликопротеина. |
||
|
|
|
|
|
||||
более резким. От |
Основная тема ис- |
Исследователи |
||||||
режима питания зависит |
следований |
группы |
||||||
показали, что системные |
||||||||
секреция инсулина, |
Даниелы Драммонд– |
|||||||
Барбоса — изучение |
воздействия, подобные |
|||||||
которая уменьшается с |
||||||||
роли соматических |
инсулину, совмещают |
|||||||
возрастом. С помощью |
||||||||
факторов в поддер- |
реакцию организма |
|||||||
фосфоинозитол-3- |
||||||||
жании герминальных |
на режим питания |
|||||||
киназы исследователи |
стволовых |
клеток |
||||||
и старение. А так же |
||||||||
обнаружили пониженное |
дрозофил. |
|
||||||
|
то, что регуляция |
|||||||
действие инсулина в |
|
|
|
|
||||
|
|
|
|
стволовых клеток |
||||
более зрелых яичниках дрозофил. |
|
|||||||
происходит посредством их |
||||||||
|
|
|
|
|
||||
Было показано, что воздействие |
микроокружения, то есть ниши. |
|||||||
инсулина объединяет |
|
|
|
|
|
|
||
эффекты режима |
|
|
Кроме того, эти исследования ещё раз под- |
|||||
питания и старения |
|
|
||||||
|
|
твердили наличие связи между низким воздей- |
||||||
на поддержание ГСК. |
|
|
ствием инсулина, строгой диетой и увеличен- |
|||||
Регуляция происходит за |
|
|
ной продолжительностью жизни. |
|||||
счет изменения количества |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
NFкB контролирует выработку многих факторов роста и необходим для нормальной пролиферации стволовых клеток
При лечении заболеваний сердца |
секрецию стволовыми клетками |
|||
особое внимание уделяется методи- |
мезенхимы человека (VEGF), |
|||
кам использования стволовых клеток |
фактора роста фибробластов 2 |
|||
для восстановления поврежденных |
(FGF2), инсулиноподобного фактора |
|||
тканей и органов. |
|
|
роста 1 (IGF-1) или фактора роста |
|
Однако при всей своей привлека- |
гепатоцитов (HGF). |
|||
|
|
|||
тельности применение этих методик |
Как оказалось, ключевым фактором, |
|||
имеет ряд ограничений. Основным |
задействованным в ответе стволовых |
|||
из них является крайне неполное по- |
клеток на внешние раздражители, яв- |
|||
нимание механизмов пролиферации |
ляется NFкB. Именно при его инги- |
|||
стволовых клеток. |
|
|
бировании происходит падение уров- |
|
Ученые группы Даниела Мелдрума |
ня этих факторов в клетке до 50%. |
|||
|
|
|||
предположили, что |
|
|
|
|
присутствие фактора |
|
Фармакологическая активация NFkB в стволовых |
||
некроза опухоли |
|
|||
|
клетках перед их трансплантацией пациенту может |
|||
альфа (TNF-alpha), |
|
быть весьма полезна для усиления их паракринно- |
||
эндотоксинов (LPS) либо |
|
го эффекта за счет стимуляции продукции факто- |
||
гипоксия увеличивают |
|
ров роста и пролиферации клеток. |
||
производство и |
|
|
|
|
|
|
|
|
|
Даниел МЕЛДРУМ (Daniel MELDRUM)
Центр Иммунологии, Отделение медицины университета Индианы (Center for Immunobiology, Indiana University School of Medicine), Индианаполис, США.
Ведется поиск способов управления механизмами деления стволовых клеток
|
|
|
|
|
Шон МОРРИСОН |
|
|
|
|
(Sean MORRISON) |
|
|
|
|
Медицинский |
|
|
|
|
|
|
|
||
институт Ховарда |
|
|
|
|
Хьюза при |
|
|
|
|
университете |
|
|
|
|
Мичиган (Howard |
|
|
|
|
Hughes Medical |
|
|
|
|
Institute, Life Sciences |
Значительный вклад в изучение |
|||
Institute, Center for |
||||
Stem Cell Biology, |
стволовых клеток, их способности |
|||
University of Michigan), |
самовоспроизводиться и |
|||
США |
||||
участвовать в регенерации |
||||
|
||||
|
тканей внесла лаборатория |
|||
|
Шона Моррисона, |
|
||
|
|
|||
|
ученые которой подробно |
|
||
|
описали симметричное и |
|
||
|
асимметричное деление |
|
||
|
стволовых клеток. |
|
||
|
|
|
|
|
При симметричном делении стволовая клетка себя копирует, производя при этом своего идентичного двойника.
При асимметричном делении стволовая клетка даёт начало нескольким прогениторным
клеткам, которые в свою очередь производят клетки определённой ткани, с уже предопределённой программой дифференцировки в клетки определённого типа.
Механизмами того или иного деления можно управлять в культуре клеток in vitro, что открывает большие возможности использования их в целях регенерации тканей и клеточной терапии.
| 190 | Научные тренды продления жизни |
Научные тренды продления жизни | 191 | |

Создано искусственное микро-окружение для культивирования сателлитных клеток
Хелен БЛАУ (Helen BLAU)
Медицинская школа университета Стэндфорда,
Калифорния (Stanford University School of Medicine), США
Лаборатория профессора Блау изучает поведение стволовых клеток и ниш стволовых клеток, а также занимается вопросами ядерного перепрограмирования. Цель ученых – разработка терапевтических средств, которые могли бы выступать в качестве стимуляторов или ингибиторов стволовых клеток непосредственно в человеческом организме.
Путём воздействия как на межклеточные, так и на внутриклеточные процессы стволовых клеток и их окружения, учёные изучают пути пе-
редачи сигнала, лежащие в основе таких процессов, как самообновление, дифференцировка, возникновение рака.
Лаборатория работает на стволовых клетках мышечной ткани, гематопоэтических стволовых клетках, стволовых клетках поджелудочной железы, используя методы мультидисциплинарной биоинженерии и микроскопии.
Ученые проводили исследования на сателлитных клетках – стволовых клетках мышечной ткани, которые играют важную роль в регенерации мышечной ткани в зрелом возрасте. Эти клетки во время постнатального периода входят в состояние покоя и откладываются между волокнами мышечной ткани, выполняющими роль их ниши.
Сателлитные клетки особенно чувствительны к окружению и, выделенные in vivo, они быстро теряют характеристики стволовых клеток в культуре. Этот факт сильно осложняет работу ученых, поскольку изучать свойства сателлитных клеток в отсутствии ниши не представлялось возможным.
В лаборатории профессора Блау на основе биоматериалов было создано искусственное микро-окружение для культивирования сателлитных клеток.
Было показано, что сателлитные клетки, выделенные из живого организма, сохраняли свои свойства стволовых клеток вплоть до нескольких недель культивирования в условиях искуственной био-ниши.
Более того, клетка, взятая из такой культуры и пересаженная в организм, оказалась способной к само-обновлению с сохранением всех своих прежних свойств.
Открыт новый тип стволовых клеток с огромным потенциалом для регенеративной медицины
Мариус
РАТАЙЧЕК
(Mariusz
RATAJCZAK)
Джеймс Грэхам Браун Центр Исследований рака (James Graham Brown Cancer Center), США
Профессор Ратайчек возглавляет программу «Биология стволовых клеток». Его лаборатория пытается найти применение запрограммированным стволовым клеткам для регенерации тканей, в основном – в кардиоваскулярных заболеваниях. Вторая цель научной работы – понять природу и поведение при старении стволовых клеток определённых тканей.
Лаборатории профессора Ратайчека удалось обнаружить новый тип стволовых клеток, который был впоследствии назван «очень маленькие стволовые клетки эмбрионального типа» (very small embryonic-like (VSEL) stem cells). Они имеют огромный потенциал в регенеративной медицине. Как оказалось, часть подобных стволовых
клеток во время гаструляции и органогенеза откладывается в каждом органе. Эти клетки порождают уже органо-специфические стволовые клетки, которые стареют и постепенно элиминируются с возрастом. Однако, пул VSEL остаётся в органах почти неизменённым, образуя всё новые моно-потентные (тканеспецифичные) стволовые клетки. Лаборатории удалось определить местоположение и специфические маркеры этих «стволовых клеток эмбрионального типа» в нескольких органах мыши. Один из основных маркеров VSEL – рецептор CXCR4, который по-видимому является определяющим в жизнедеятельности и функционировании этих клеток.
В настоящее время ведутся работы по более детальному изучению VSEL клеток как в культуре клеток человека так и на мышах. Изучение этих клеток, локализация их в конкретных органах послужит важной предпосылкой для использования их в медицине в качестве регенеративного материала определённой ткани или органа.
Обнаружены биомаркеры стволовых клеток
|
|
|
|
стволовых клеток с целью их |
||
|
|
|
|
использования в регенера- |
||
|
|
|
|
ции нервной ткани. |
||
|
|
|
|
Используя системный под- |
||
|
|
|
|
ход в изучении клеточного |
||
|
|
|
|
метаболизма (метаболоми- |
||
|
|
|
|
ки), учёные выявили новые |
||
|
|
|
|
«малые молекулы» во вну- |
||
|
|
|
|
триклеточном пространстве |
||
|
|
|
|
эмбриональных стволовых |
||
|
|
|
|
клеток человека. Эти мо- |
||
|
|
|
|
лекулы были обнаружены |
||
|
|
|
|
только в стволовых клетках |
||
Лаборатория профессора Цезар занимается |
и привлекли большое вни- |
|||||
мание учёных. В перспекти- |
||||||
исследованиями в области метаболизма эмбри- |
||||||
ональных стволовых клеток человека. |
|
ве их можно использовать |
||||
Одно из направлений работы группы |
|
как биомаркеры стволовых |
||||
|
клеток. |
|||||
профессора Цезар – поиск мар- |
|
|
|
|||
керов ранней стадии нейроде- |
|
|
|
|
|
|
|
В настоящее время, группа занимается во- |
|||||
генеративных заболеваний, па- |
|
|
||||
|
просами происхождения этих «малых мо- |
|||||
раллельно ведутся проекты по |
|
|
||||
|
лекул», их роли в стволовых клетках. |
|||||
изучению метаболизма нервных |
|
|
|
|
|
|
Габриелла ЦЕЗАР (Gabriela
G. CEZAR)
Центр стволовых клеток и регенеративной медицины университета Висконсин, США (University of Wisconsin Stem Cell & Regenrative Medicine Center)
| 192 | Научные тренды продления жизни |
Научные тренды продления жизни | 193 | |

Создана временная шкала поведения стволовых клеток в организме
Конни ИВС (Connie J. EAVES)
Директор лаборатории Терри Фокса, Ванкувер, Канада (Terry Fox Laboratory, BC cancer agency, Vancouver)
Гематопоэтические стволовые клетки обычно делятся во взрослом организме несколько раз. До сих пор не очень ясно, чем определяется число этих делений в течение жизни. Ученые проанализировали процесс самообновления стволовых клеток и выяснили, что выделенные стволовые клетки младенца
The Autologous Transplant Process
1.Collection
Stem cells are collected from the patient’s bone marrow or blood
до трёх недель жизни демонстрируют огромное преимущество перед клетками, выделенными из организма взрослого человека. После трёх недель зародышевые стволовые клетки теряют свою способность хорошо делиться и порождать новые клетки, которые впоследствии дифференцируются в клетки ткани.
Кроме того, ученые создали временную шкалу поведения стволовых клеток с возрастом. Это
послужит основой для дальнейших исследований, в которых необходимо установить первопричину ограничения числа делений стволовых клеток, происходящую с возрастом.
5.Reinfusion
5IBXFE TUFN DFMMT are reinfused into the patient
2. Processing |
|
|
#MPPE PS CPOF |
|
|
marrow is |
|
4. Chemotherapy |
processed in the |
|
High dose |
laboratory to purify |
|
chemotherapy |
and concentrate the |
3. Cryopreservation |
and/or radiation |
stem cells |
#MPPE PS CPOF NBSSPX JT |
therapy is given |
|
frozen to preserve it |
to the patient |
Уменьшение регенеративной способности ткани с возрастом может быть обратимо
Томас РАНДО (Thomas RANDO)
Медицинская школа Университета Стэнфорда. (Stanford University School of Medicine), руководитель неврологической службы здравоохранения
Пало Альто (Neurology Service VA Palo
Alto Health Care System), заместитель директора Стэнфордского Центра Долголетия (Stanford Center on Longevity (SCL)).
Основные темы исследований лаборатории Томаса Рандо
— старение стволовых клеток (сателлитных клеток) в мышце, влияние ниш стволовых клеток на этот процесс, возможность «омоложения» взрослых прогениторных клеток.
Используя мышей в качестве моделей для исследования регенеративной способности мышечной ткани, исследователи группы Томаса Рандо выяснили, что с возрастом происходит уменьшение активации Notch (трансмембранные белки),
результатом чего является ухудшение регенеративного потенциала сателлитных клеток.
При повреждении «юных» мышц усиливается секреция трансмембранного лиганда Notch – Delta, инициируя, тем самым, Notch-сигнальный каскад в стволовых клетках, что приводит к их усиленной пролиферации.
Воздействие сыворотки от моло-
дой особи на сателлитные клетки старой особи in vitro также приводило к усиленной экспрессии Delta, большей активации Notch и выросшей пролиферацией этих клеток in vitro.
Ещё одним важным результатом исследований стало доказательство того факта, что Wnt – сигнальная активность в активированных сателлитных клетках у старых мышей значительно выше, чем у молодых. Аналогично, при обработке сателлитных клеток
«старой» сывороткой, активность Wnt возрастала. Поскольку Wnt играют существенную роль в фиброзе, то можно сделать вывод, что активация Wnt в этом случае означает, что сателлитные клетки старого организма активируются для образования фибрина, что ведет к дальнейшему фиброзу в
регенерации мышцы. Таким образом, ингибирование Wnt– сигнального пути позволяет остановить дифференцировку стволовых клеток мышечного волокна в фиброзную ткань.
Важные выводы, которые можно сделать из этих исследований:
1. Соматические факторы могут моделировать молекулярные сигнальные пути, активирующие тканеспецифичные прогениторные клетки.
2.Микрооркужение (ниши) стволовых клеток у молодых животных стимулирует регенерацию, в то время как у взрослых особей либо не способно стимулировать, либо подавляет регенерацию тканей.
3.Уменьшение регенеративной способности ткани с возрастом может быть обратимо при использовании определенных факторов.
| 194 | Научные тренды продления жизни |
Научные тренды продления жизни | 195 | |

Активация MAPK/Notch показала возможность «омоложения» сателлитных клеток мышцы
Ирина КОНБОЙ (Irina CONBOY)
Лаборатория
биоинженерии
Калифорнийского
Университета, Беркли, США. (Department of Bioengineering, University of California, Berkeley, CA, USA).
В лаборатории Ирины Конбой было показано, что, помимо снижения активации Notch, с возрастом повышается уровень TGFβ, который индуцирует образование большого количества фосфорилированного Smad3 в резидентных прогениторных клетках мышцы, что мешает регенеративной способно-
не могли активироваться в ответ на истощение мышцы, из-за снижения активности Notch, одновременно с увеличением активности TGFβ. Кроме того, было показано, что большое значение в активации Notch играет MAPK/pERK сигнальный путь. С помощью вестерн блоттинга (Western blot) исследователи
|
|
|
|
|
Delta/Notch |
|
||
|
TGF-b/pSmad3 |
|
|
regeneration stage: |
||||
|
|
|
||||||
|
|
|
||||||
|
|
|
|
|
|
|
|
|
Quiescent |
|
А. |
|
|
|
|
|
Activated |
|
|
|
|
|
||||
satellite cell |
|
|
|
|
|
|
|
satellite cell |
B.?
early
Wnt
Delta/Notch
C.
Numb |
|
Fibrogenic lineage |
|
late
выяснили, что с возрастом, активность MAPKсигнального каскада снижается. При исследовании содержания уровня Delta, количества актив-
ного Notch, и активности миогенеза в ответ на присутствие антагонистов или агонистов MAPK, ученые выяснили, что агонист (FGF 2) индуцировал Delta и активировал Notch. В то время как ингибиторы MAPK-сигнального пути угнетали активность Notch и снижали уровень Delta. При непосредственной активации MAPK, регенеративная способность сателлитных клеток мышечной ткани, как молодой, так и старой, значительно увеличивалась.
Старение ниши влияет на пролиферативную активность эпидермальных стволовых клеток
Фиона УАТТ (Fiona WATT)
Центр исследования канцерогенеза при Научном исследовательском
институте, Кэмбридж, Великобритания (Cancer Research UK Cambridge Research)
Ученые группы Фионы Уатт показали, что количество и функции эпидермальных стволовых клеток не изменяется с возрастом, и что местное окружение (ниша) и
системные факторы влияют на старение кожи и активность стволовых клеток. Это связано с уменьшенной экспрессией гена Igfbp3
в дерме. С возрастом экспрессия этого гена уменьшается практически в 5 раз, что напрямую влияет на пролифе-
ративную способность эпидермиса. Это было доказано с использованием нокаутных мышей.
Старение ниши влияет на пролиферацию мезенхимальных стволовых клеток
Ученые группы Гюнтера Леппердингера изучали способности к дифференцировке и пролиферативной активности мезенхимальных стволовых клеток (МСК) костного мозга в зависимости от возраста мыши,
а также возможное участие ниши МСК во влиянии на свойства этих клеток.
Мезенхимальные стволовые клетки выделяли из мышей трех различных линий — короткоживущей
(SAMP6 – 9,7 месяца), среднеживущей — (SAMR1 – 16,3 месяца) и долгоживущей (C57BL/6 — 28 месяцев). Ученые исследовали колониеобразующие
единицы костного мозга и выяснили, что эти клетки обладали сходными характеристиками in vitro вне зависимости от продолжительности жизни организма.
В то время как данные по генетическому анализу in situ показали различия в экспрессии множества генов в нишах мезенхимальных стволовых клеток, изменение эксперссии генов различалось практически в два раза.
Таким образом, было доказано, что мезенхимальные стволовые клетки не изменяют своих характеристик с возрастом, но испытывают сильное влияние стареющего микрооокружения (ниши).
Гюнтер
ЛЕППЕРДИНГЕР (Günter LEPPERDINGER)
Институт
исследований биомедициских основ старения, Австрия (Institute for biomedical aging research).
| 196 | Научные тренды продления жизни |
Научные тренды продления жизни | 197 | |
