
6 курс / Иммунология / Kazmirchuk_V_E_Kovalchuk_L_B_Maltsev_D_V_Klinicheskaya_immunologia
.pdf
факторами агрессии нейтрофилов всё же являются свободные радикалы, поскольку именно они обладают максимально выраженным деструктивным действием.
В последнее время продемонстрировано, что нейтрофилы образуют в тканевой жидкости своебразные сетчастые плазменные структуры, получившие название экстрацеллюлярных плазматических ловушек (рис. 7, 8). Механизм их действия чем-то напоминает работу паутины. Нити подобных ловушек связывают и иммобилизируют микроорганизмы, а агрессивные агенты (свободные радикалы, токсические перекиси, гидролитические ферменты), которые высвобождает нейтрофил в плазматические нити, разрушают фиксированные объекты. Сам нейтрофил фагоцитирует лишь остатки микробов (так называемый микрофагоцитоз). Таким образом, нейтрофильные гранулоциты сочетают внеклеточный и внутриклеточный этапы деструкции патогенов. Формирование плазматических ловушек выгодно на начальных этапах воспаления, когда за максимально сжатые сроки необходимо охватить всю зону инфекционного поражения. Побочными эффектами внеклеточного разрушения объектов является повреждение собственных тканей и развитие выраженной интоксикации. На более поздних этапах воспаления, когда патоген уже хорошо известен, актуальным является качество и безопасность ответа, в связи с чем более важную роль играют макрофаги.
Рис. 7. Экстрацеллюлярные плазма- |
Рис. 8. Экстрацеллюлярные плазма- |
тические ловушки нейтрофилов (а) |
тические ловушки нейтрофилов (б) |
Дендритные клетки. Ключевым компонентом врождённых механизмов резистентности является дендритная клетка. Исследования последних лет привлекли вимание к изучению дендритных клеток в связи с открытием на них так называемых toll-like рецепторов. Дендритные клетки кожи и слизистых покрывают организм тончайшей "паутиной", преграждая попадание патогенов в нижележащие ткани. Если считать, что именно факторы врождённой резистентности запускают иммунный ответ, то инициация и корректное разворачивание иммунных реакций было бы невозможно без участия дендритных клеток. Их способность к захвату и переработке патогена значительно уступает способности к антигенной презентации, которая совершается на несколько порядков эффективнее, чем любыми другими АПК. Поэтому дендритные

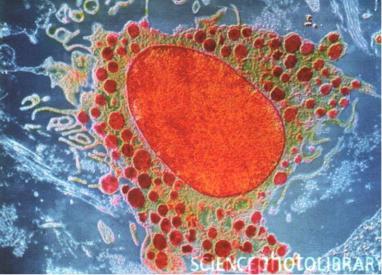
Рис. 9. Электронная микрофотография дендритной клетки и Т-лимфоцита в момент взаимодействия друг с другом в процессе инициации иммунного ответа
(фото из http://rakpochki.net/moscow.aspx)
На микрофотографии представлена дендритная клетка (окрашена красным цветом) в момент взаимодействия с наивным Т-хелпером (окрашен серым цветом), во время которого осуществляется презентация антигена, проникшего в кожные покровы организма, и инициация специфического иммунного ответа. Хорошо видны многочисленные цитоплазматические отростки дендритной клетки, во много раз увеличивающие площадь её мембранной поверхности — зоны активного взаимодействия с различными патогенами.
клетки предназначены не столько для непосредственной элиминации патогена, сколько для инициации и регуляции Т— и В-клеточного иммунного ответа против него. Дендритные клетки, в отличие от макрофагов, не обременены функцией фагоцитоза, а потому могут всецело отдаваться обслуживанию иммунокомпетентных клеток при реализации иммунного ответа.
Для выполнения своих функций дендритные клетки обладают уникальной способностью активировать так называемые "наивные" Т-лимфоциты (зрелые иммуноциты, которые ещё никогда не встречались с антигеном). Кроме этого, следует обратить вимание на органную приуроченность дендритных клеток.
Так, дендритные клетки кожи (клетки Лангерганса) постоянно захватывают внеклеточные антигены (рис. 9). Когда рецепторы их шаблонного распознавания взаимодействуют с патогенсвязанными молекулярными шаблонами, эти клетки активируются и ведут себя как антигенпредставляющие. Эндогенные сигналы об опасности (синтез α-интерферона вирусинфицированными клетками или повышение уровня белков теплового шока в результате некротической гибели клеток) также активируют дендритные клетки. Активированные дендритные клетки мигрируют в ближайший дренирующий лимфатический узел, где они презентируют антиген Т-лимфоцитам. Перед этим антиген расщепляется внутриклеточно до коротких пептидов, которые встраиваются в
пептидсвязывающую борозду молекул HLA II класса. Затем образованный комплекс поступает на цитолемму дендритной клетки (рис. 10).
Рис. 10. Роль дендритных клеток в иммунном ответе
На рисунке показано, как инфицированные или повреждённые патогеном клетки ткани активируют дендритные клетки баръерных органов (клетки Лангерганса). Последние мигрируют в зону повреждения, где распознают патоген по его молекулярным шаблонам. Захватив определённую порцию патогена, клетки Лангерганса покидают очаг и мигрируют в регионарный лимфатический узел. На пути миграции они называются вуалевидными клетками. В лимфатическом узле прибывшие дендритные клетки презентируют антиген специфическим, но "наивным" (некомпетентным) Т-хелперам. Благодаря антигенной презентации наивные Т-клетки активируются и приобретают компетентность, способствуя инициации иммунных реакций.
На мембране дендритных клеток содержатся следующие рецепторы шаблонного распознавания: рецепторы к липополисахаридам, рецептору к маннозе, компоненты семейства молекул, именуемые toll-like. Молекулярными шаблонами, которые способны распознать дендритные клетки, являются манноза клеточных стенок, поверхностные липополисахариды грамотрицательных бактерий, тейхоевые кислоты, находящиеся на поверхности грамположительных бактериальных агентов. Кроме этого, дендритные клетки экспрессируют рецепторы к опсонинам (к Fc-фрагментам антител и СЗЬ-компоненту комплемента). Таким образом, указанные клетки снабжены достаточно мощным рецепторным арсеналом для осуществления распознавания патогена.
Следует отметить, что активация именно toll-like рецепторов заставляет дендритные клетки увеличивать экспрессию В7-костимулирующих молекул (известных как CD80 и CD86), которые являются дополнительными, но крайне необходимыми сигналами, определяющими активацию Т-лимфоцита при его взаимодействии с антигенпрезентирующей клеткой (АПК). Напомим, что взаимодействия антигенраспознающего рецептора Т-лимфоцита с комплексом пептид — HLA II АПК является недостаточной для активации Т-лимфоцита, более того, может завершиться его апоптозом.
Во время миграции в регионарные лимфоузлы активированные дендритные клетки называют вуалеподобными. Они обнаруживаются в лимфе и в паракортикальной зоне афферентных лимфатических узлов. Именно эти клетки являются переносчиками антигена из кожи в лимфоидные органы.
Дендритные клетки селезёнки (интердигитальные клетки) находятся в Т-зависимых зонах - периартериолярных муфтах селезёнки. Они размещают свои отростки между Т-лимфоцитами и осуществляют презентацию антигенов иммуноцитам. Такие же клетки содержатся и в Т-зависимых зонах лимфоузлов.
В фолликулах селезёнки и лимфатических узлов находятся дендритные фолликулярные клетки, связывающие антигены или иммунные комплексы (антиген-антитело-комплемент) на своей поверхности, однако не поглощающие их. Это явление инициирует образование зародышевых центров в фолликулах селезёнки и лимфатических узлов. Зародышевые центры являются специализированными зонами иммунных органов, где разворачиваются
В-клеточные реакции. Здесь так называемые В2-лимфоциты, уже встретившиеся с антигеном и простимулированные Т-хелперами, производят переключение класса синтезируемых иммуноглобулинов, начиная продукцию IgG, IgA или IgE. Также именно здесь происходит соматический гипермутагенез антигенраспознающих рецепторов В-клеток. При этом формируется ряд
В-лимфоцитов с определёнными различиями в структуре антигенсвязывающего сайта, специфического к данному антигену. Путём взаимодействия с фиксированным на поверхности дендритной клетки антигеном отбираются
В-лимфоциты с наиболее соответствующими иммуноглобулиновыми рецепторами (а значит, и антителами) к его антигенным детерминантам. Именно таким В-лимфоцитам и будет обеспечена дальнейшая клональная экспансия. Кроме этого считают, что фолликулярные дендритные клетки, длительно сохраняющие антиген на своей поверхности, принимают участие в формировании иммунной памяти (см. § "Иммунная память").
Так называемые тимические дендритные клетки способны презентировать собственные антигены созревающим Т-лимфоцитам тимуса, принимая участие
вформировании иммунной толерантности путём негативной селекции (высокоактивные аутореактивные Т-лимфоциты, "откликнувшиеся" на аутоантиген,
вдальнейшем подвергаются апоптозу).
Следует отметить, что активированные дендритные клетки за счёт синтеза цитокинов могут влиять на определение преимущественного пути разворачивания иммунной реакции. Считают, что при синтезе ИЛ-12 последующие
иммунные реакции будут реализовываться по клеточному типу, а при преимущественном выделении ИЛ 4 или ИЛ-Ιβ будут активированы гуморальные реакции иммунитета.
Функции дендритных клеток:
1.Обеспечение антигенной презентации и инициации иммунного ответа.
2.Влияние на выбор преимущественного пути реализации иммунной реакции (по клеточному типу/по гуморальному типу).
3.Поддержание функциональной связи между местом пребывания патогена и иммунными органами.
4.Обслуживание В-клеточных реакций и участие в коррекции специфичности их иммуноглобулиновых рецепторов.
5.Участие в поддержании иммунной толерантности (причём, как центральной, так и периферической).
6.Участие в формировании иммунной памяти.
7.Непосредственное повреждение патогена (скромный вклад по сравнению с нейтрофилами и макрофагами).
Естественные киллеры (ЕК). Это большие гранулярные лимфоциты — низкодифференцированные потомки стволовой клетки. Различают тканевые и циркулирующие ЕК. Тканевые ЕК содержатся в печени и плаценте, обеспечивая поддержание иммунной толерантности к пищевым антигенам и антигенам плода соответственно. Для этого указанные естественные киллеры связываются с активированными лимфоцитами и инициируют каскад апоптоза в них, т.е. совершают киллинговый эффект. Циркулирующие ЕК обеспечивают защиту от спонтанно изменённых собственных клеток (в том числе — опухолевых), а также приимают участие в разрушении вирусинфицированных клеток.
Реакция, в которой приимает участие естественный киллер, называется
спонтанной клеточно-опосредованной цитотоксичностью (СКОЦ), поскольку для её реализации не требуется антител и комплемента. В то же время указанные клетки способны вступать и в реакции антителозависимой клеточноопосредованной цитотоксичности, поскольку содержат поверхностные Fcрецепторы.
Механизм СКОЦ состоит в следующем (рис. 11). При помощи киллингактивирунщего рецептора естественные киллеры взаимодействуют с олигосахарами ганглиозидов и гликозаминогликанов поверхностных структур клетокмишеней. Поскольку такие молекулы являются "вездесущими", естественные киллеры потенциально могут повреждать практически любую собственную клетку. Естественно, этого в организме не происходит. Дело в -fbM, что активацию естественного киллера предупреждает киллингингибирующий рецептор, распознающий молекулы HLA I класса (только те разновидности, которые присущи конкретному организму). Поэтому клетки-мишени отбираются по экспрессии специфических молекул HLA I — при отсутствии такой экспрессии или же "чужой" структуре молекул гистосовместимости запускается киллинговый механизм (так называемый "поцелуй смерти").
Приведённые данные указывают на то, что ЕК активируются при нарушении баланса между триггерными рецепторами, реагирующими не только на

микробные продукты, но и на структуры активно пролиферирующих собственных клеток, и ингибирующими рецепторами, реагирующими на HLA-молекулы I класса ("метки" своего). Такое сочетание неспецифических триггерных и специфических ингибирующих рецепторов позволяет ЕК эффективно реагировать на широкий круг мишеней — от чужеродных микробов, ксеногенных и аллогенных клеток до собственных патологически изменённых или даже просто излишне активных клеток.
Рис. 11. Механизм распознавания потенциальных мишеней естественными киллерами
На рисунке показано, что в случае отсутствия молекул HLA I на поверхности клетки, последняя становится потенциальной мишенью для естественнго киллера, осуществляющего неспецифическое распознавание широко представленных поверхностных структур ("вездесущих молекул"). При этом киллерный механизм (так называемый "поцелуй смерти") опосредован перфорином и гранзимами.
На мембране естественных киллеров содержатся рецепторы к γ-интерферону, ИЛ-2 и ИЛ-12, поэтому указанные цитокины способны активировать ЕК. Также естественные киллеры содержат кластеры CD 16 и CD56, по которым проводится лабораторная идентификация этих клеток.
Тучные клетки (тканевые базофилы). Эти клетки известны в качестве эффекторного звена атопических реакций, однако их вовлечение в иммунный ответ происходит при любой воспалительной реакции. Тучные клетки получили своё название в связи с наличием большого количества гранул, плотно выполняющих их цитоплазму (рис. 12). В этих гранулах содержится гистамин (биогенный амин, образующийся путём декарбоксилирования аминокислоты гистидина), гепарин (протеогликан, удерживающий путём ионных взаимодействий молекулы биогенного амина), некоторые ферменты (триптазы, химазы, карбоксипептидаза А) и хемотаксические факторы. Гепарин наделён не только антикоагуляционным, но и иммуномодулирующим действием. Основные
биологические эффекты гистамина состоят в повышении сосудистой проницаемости и вазодилатации в очаге его высвобождения. Сосудорасширяющий эффект связан с активацией синтеза простациклина и оксида азота (NO) эндотелиальными клетками. Повышение проницаемости сосудов возникает в связи
сконтрактильными изменениями цитоскелета эндотелиоцитов, что приводит
кувеличению межклеточных промежутков. Это способствует плазморрагии и отёку тканей, а также облегчает диапедез фагоцитов и их поступление в очаг воспаления.
Рис. 12. Тучная клетка
Поверхность тучной клетки густо покрыта высокоаффинными рецепторами к Fc-фрагментам IgE. В случае первичного поступления антигена в организм происходит синтез специфических IgE (сенсибилизация к антигену), которые связывают соответствующие рецепторы тучных клеток константными областями, ориентируя наружу свои антигенсвязывающие сайты. Связанные антитела начинают выполнять функцию антигенраспознающих рецепторов тучных клеток. Таким образом, эти клетки не синтезируют собственные рецепторы антигенного распознавания, а "наимают" секреторные рецепторы В-лимфоцитов. При повторном поступлении того же антигена происходит его связывание с IgE, что инициирует дегрануляцию тучных клеток и высвобождение (либерализацию) гистамина, который оказывает описанный биологический эффект. Указанный механизм является вполне физиологическим и способствует быстрому развитию воспаления при повторном проникновении антигена.
Базофильные гранулоциты крови также содержат гранулы с гистамином и рецепторы к Fc-фрагментам IgE. Отличие их от тучных клеток состоит в локализации и сроках вовлечения в реакции против патогена. Так, тучные клетки
содержатся в рыхлой соединительной ткани различных органов, а базофилы циркулируют в плазме крови. Поэтому базофильные гранулоциты поступают в очаг только в случае формирования воспаления, а значит, выполняют свою функцию с определённым опозданием по сравнению с тучными клетками. В то же время, при первичном проникновении патогена в системную циркуляцию первыми вступают в действие базофилы крови.
Функции базофильных гранулоцитов крови:
1.Продуцируют, запасают и высвобождают гистамин.
2.Содержат значительное количество высокоаффинных рецепторов к IgE, что позволяет им вовлекаться в иммунный ответ.
3.Высвобождают активатор плазминогена, участвующий в регуляции количества фибрина.
Эозинофильные гранулоциты содержат гранулы с биологически активными веществами, а также способны к фагоцитозу и хемотаксису. Агенты, содержащиеся в эозинофилах выполняют различные функции, в том числе противоаллергическую, способствуя расщеплению БАВ, которые выделяются в раннюю фазу атопических реакций. Так, гистаминаза осуществляет расщепление гистамина, арилсульфатаза В — лейкотриенов, а фосфолипаза D — тромбоцитактивирующего фактора. С другой стороны, именно эозинофилы опосредуют аллергические проявления в поздней фазе, т.е. их роль в аллергии неоднозначна.
Также эозинофилы играют важную роль в защите от гельминтов и простейших, приимая участие в реакциях антителозависимой клеточно-опосредованной цитотоксичности (АЗКОЦ). Антитела при этом относятся к IgE, реже — к IgA. Механизм АЗКОЦ состоит в следующем. На мембране эозинофила имеются рецепторы к Fc-фрагменту IgE. Когда Fab-фрагмент IgE присоединяется к антигенной детерминанте гельминта, к Fc-фрагменту этого антитела фиксируется эозинофил, что активирует эту клетку к реализации цитотоксического эффекта.
Функции эозинофильных гранулоцитов:
1.Уничтожение гельминтов, токсоплазмы, хламидий, лямблий, листерий (АЗКОЦ).
2.Синтез фибринолизина.
3.Выделение веществ, стимулирующих синтез ДНК в фибробластах.
4.Продукция факторов, тормозящих дегрануляцию базофилов крови и тучных клеток.
5.Захват гранул, содержащих гистамин, сорбция последнего на своей поверхности и последующее его разрушение за счёт гистаминазы.
6.Инактивация провоспалительных лейкотриенов и тромбоцитактивирующего фактора.
7.Потенцирование реакций поздней фазы атопии, что наряду с инактивационным воздействием на БАВ ранней фазы обеспечивает регуляторную функцию эозинофилов при атопии.
Тромбоциты являются активными переносчиками антигенов и иммунных комплексов, обладают выраженными цитотоксическими свойствами. Установлено, что тромбоциты содержат Fc-рецепторы и рецепторы к Clq-компоненту
комплемента, поэтому их активация возможна под влиянием иммунных комплексов, содержащих, как известно, и Fc-фрагменты антител, и С lq-компонент комплемента. При активации тромбоциты высвобождают биологически активные вещества (серотонин, адреналин, ТрА2), а также продуцируют свободные радикалы, катепсины, кислые гидролазы. Первые субстанции способствуют развитию реакции воспаления, а вторые — оказывают на патоген непосредственный повреждающий эффект. Чётко доказана цитотоксичность тромбоцитов при генерализованных протозойных инвазиях и гельминтозах с внутрисосудистым пребыванием патогена (например, шистосоматоз).
Эритроциты. Весьма интересна роль эритроцитов при инфекции. Известно, что мембраны эритроцитов чрезвычайно биологически активны и адсорбируют на своей поверхности большое количество "странствующих" в крови антигенов. Благодаря наличию рецепторов к Fc-фрагментам антител, Clq- и СЗЬ-компонентам комплемента, эритроциты способны осуществлять иммунную адгезию частиц, нагружённых указанными структурами. При этом они выполняют дезинтоксикационную функцию, а также доставляют фиксированные патогены для макрофагов селезёнки и печени.
Сами эритроциты не способны уничтожить фиксированные патогены, поскольку лишены факторов агрессии. Поэтому они становятся мишенью для атаки других компонентов врождённого иммунитета, в частности тромбоцитов, которые могут образовывать тесные контакты с эритроцитами.
Известно, что в условиях анемии инфекции протекают более тяжело. Этот факт объясняется не только гипоксией, но и недостаточной функцией эритроцитов как компонентов врождённого иммунитета организма.
Резюме. Таким образом, компоненты врождённого иммунитета являются чрезвычайно разнородными по структуре, месту образования и функциональному эффекту. Их единственная общая черта — обеспечение противоинфекционной защиты на основании шаблонного распознавания. Сегодня склонны считать, что значение врождённой резистентности в борьбе с патогенами, по крайней мере, не меньше, чем собственно иммунных факторов. При этом основываются на следующих соображениях. Микробное вторжение в организм происходит практически каждую секунду, а клинически манифестные заболевания, при которых вовлекаются иммунные факторы, являются сравнительно редким событием. С другой стороны, без участия факторов врождённой защиты полноценная реализация иммунного ответа становится невозможной. Более того, как показали последние данные, выполнение таких ключевых и, казалось бы, специфических иммунных функций, как поддержание иммунной толерантности и обеспечение иммунной памяти, происходит в тесных взаимоотношениях с факторами врождённой резистентности и не могут быть корректно реализованы без их участия.
§5. Роль факторов приобретённого иммунитета
взащите от патогенов
1.Структура и функции системы приобретённого иммунитета
Иммунная система — это совокупность лимфоидных органов, тканей и клеток, обеспечивающих биохимическую, структурную и функциональную индивидуальность организма путём элиминации из него носителей чужеродной генетической информации (П.Ф. Литвицкий, 1992).
Основная функция иммунной системы — осуществление иммунного надзора, то есть защиты организма от эндо- и экзогенных веществ, имеющих признаки чужеродной генетической информации. Выделяют центральные и периферические органы иммунной системы. Центральными органами являются тимус и красный костный мозг, а периферическими — селезёнка, лимфатические узлы, лифоглоточное кольцо Пирогова, лимфоидная ткань кишечника (пейеровы бляшки, солитарные фоликуллы, аппендикс). В центральных органах зарождаются и развиваются клетки иммунной системы, а в периферических они функционируют, то есть специфически распознают разнообразные антигены. Таким образом, в центральных иммунных органах происходит антигеннезависимый этап созревания иммунокомпетентных клеток, а в периферических — антигензависимый.
Иммунная система не может пребывать в состоянии покоя, так как в организме постоянно отмирают старые клетки, появляются клетки с дефектами, сквозь защитные покровы непрерывно поступают антигены. Доказано, что постоянный контакт человека с окружающими микроорганизмами обеспечивает быстрое реагирование на антигены болезнетворных агентов. В то же время, длительное пребывание в изолированном пространстве (корабль, подводная лодка, космический аппарат) приводит к резкому снижению защитных сил организма.
1.1. Понятие об иммунокомпетентных клетках
Носителями иммунной функции являются иммунокомпетентные клетки (лимфоциты). В зависимости от места созревания различают тимус-зависимые (Т-лимфоциты) и тимус-независимые (В-лимфоциты) клетки. Буква "В" в названии последних происходит от сокращения названия иммунного органа птиц (бурсы Фабрициуса), где происходят активные В-клеточные реакции. Принципиальной особенностью иммунокомпетентных клеток является наличие на их поверхности специальных рецепторов для распознавания антигенов. Так, Т-лимфоциты содержат Т-клеточные антигенраспознающие рецепторы (ТАГРР), а В-лимфоциты — иммуноглобулиновые рецепторы (мономеры IgM). По химической структуре такие молекулы относятся к суперсемейству иммуноглобулинов. Так, на поверхности любого В-лимфоцита содержится до 100000
