
6 курс / Гастроэнтерология / Актуальные_вопросы_хирургической_гепатологии,_гастроэнтерологии
.pdfВыводы.
1.Оптимизация хирургической тактики при ГДЯК должна основываться на балльной оценке прогноза риска рецидива кровотечения в стационаре, в этом случае она носит упреждающий характер и способствует конкретизации выбора сроков выполнения операций.
2.Высокую частоту встречаемости при ГДЯК в качестве ассоциированной с Hp микрофлоры штаммов Staphylococcus aureus, обладающих ускоренной плазмокоагулазной реакцией и выраженной гемолитической активностью, следует рассматривать в качестве фактора, препятствующего стабилизации гемостаза в язве и способствующего развитию рецидива кровотечения.
3.Включение в комплекс консервативных мероприятий у больных с эндоскопической оценкой кровотечения Forrest IВ, IIA и IIВ антибактериальных препаратов, обладающих антихеликобактерной и антистафилококковой направленностью действия, наряду с соблюдением предложенных принципов оптимизированной хирургической тактики достоверно улучшает результаты лечения больных ГДЯК.
Список литературы:
1.Гостищев В. К. Дистальная резекция желудка в неотложной хирургии гастродуоденальных язв / Гостищев В. К., Евсеев М. А., Головин Р. А., Ивахов Г. Б. //Общая хирургия, 2010, № 9, с. 22-30.
2.Ефименко Н. А. Кровотечение из хронических гастродуоденальных язв: современные взгляды и перспективы лечения/Ефименко Н. А., Лысенко М. В., Асташов В. А. // Хирургия, 2004, № 3, с. 56-60.
3.Лобанков В. М. Хирургия язвенной болезни на рубеже XXI века// Хирургия, 2005, № 1, с. 58-64.
4.Панцирев Ю. М. Хирургическое лечение прободных и кровоточащих гастродуоденальных язв / Панцирев Ю. М., Михалев А. И., Федоров Е. Д. // Хирургия, 2003, № 3, с.43-49.
5.Ткачев А. В. Оценка отдаленных результатов эрадикационной терапии и качества жизни у больных язвенной болезнью, осложненной кровотечением или перфорацией / Ткачев А. В., Пасечников В. Д., Чернов В. Н.// Российский журнал гастроэнтерологии, гепатологии, колопроктологии, 2002, № 6, с. 44-53.
И. С. Куклин, Н. А. Никитин, С. И. Куклин
Сравнительная оценка двух способов лечения инфицированных послеоперационных ран, сочетанных с наружными мочевыми свищами
ГБОУ ВПО Кировская ГМА Минздравсоцразвития России, г. Киров
Введение. Одной из сложных проблем в хирургии и урологии на современном этапе является развитие гнойновоспалительных осложнений в послеоперационном периоде. Трудность лечения гнойно-воспалительных осложнений связана с селекцией и распространением в хирургических стационарах резистентных к большинству антибактериальных препаратов штаммов возбудителя, а также с возникновением вторичного иммунодефицитного состояния больных в послеоперационном периоде, на фоне которого эффективность антибактериальной терапии снижена. Применение природных и синтетических антибиотиков подавляет защитные иммунные реакции, усиливаяимеющуюсяиммуносупрессию,оказываетнеблагоприятноевоздействиенафизиологическиетканевыепроцессы, ведет к развитию дисбактериоза, создавая тем самым условия для эндогенного инфицирования мочевых путей условно патогенной флорой [1,2].
Возрастание числа сложных операций с применением современных технологий увеличение объема и продолжительности оперативных вмешательств, повышение травматичности тканей и кровопотери, способствуют развитию послеоперационных инфекционных осложнений, в первую очередь – раневой инфекции, несмотря на применение современных методов профилактики, совершенствования способов стерилизации инструментария, соблюдение санитарно-гигиенических требований [7].
Число послеоперационных гнойных осложнений в плановой абдоминальной хирургии составляет в среднем 6-8 % (0,8-2 % – при «чистых» операциях, до 20 % – при контаминированных) [2].
В урологии наиболее часто гнойно-воспалительные осложнения со стороны раны возникает после операций по поводу гнойного пиелонефрита и пионефроза — от 6,8 до 42 %, после операций по поводу аденомы простаты до-
стигает 29,8% [5].
Ифекции области хирургического вмешательства оказывают большое влияние на длительность госпитализации пациентов, при их возникновении значительно увеличиваются сроки пребывания пациента в стационаре до 16,7 дней и увеличивается стоимость госпитализации [3].
Проблема заживления ран и создание оптимальных условий для улучшения регенерации мягких тканей остается одной из актуальных проблем хирургии, несмотря на многообразие средств и методов, предложенных с этой целью. На современном этапе предлагается большое количество методов, способов, антимикробных препаратов для лечения ран и раневой инфекции. Однако высокий процент инфекционных осложнений у больных, развитие резистентности микроорганизмов к используемым лекарственным препаратам, большое количество побочных эффектов,снижениеобщейиместнойиммуннойреактивностиорганизматребуютдальнейшегоизучения,разработки и совершенствования методов лечения.
Цель работы. Оценить эффективность применения озонированной композиции растительных масел в лечении инфицированных послеоперационных ран, сочетанных с наружными мочевыми свищами.
Материал и методы. В основу работы положен опыт лечения 66 больных в возрасте от 50 до 81 лет (средний возраст 68 лет), из них 4 женщины и 62 мужчин. Все пациенты перенесли оперативные вмешательства по поводу различной урологической патологии, требующей формирования временного наружного мочевого свища. Одномо-
94
ментная аденомэктомия произведена у 12 (18,2%) больных, 2 этап аденомэктомии – у 37 (56%), трансуретральная резекция аденомы предстательной железы – у 10 (15,2%), трансуретральная резекция рака предстательной железы – у 1 (1,5%), нижняя уретеролитотомия – у 1(1,5%), пиелолитотомия – у 5 (7,6%).
Анализируемые пациенты были разделены на две сравнимые группы: 1-я группа (основная) – 35 больных и 2-я группа (сравнения) – 31 больной. Пациенты обеих групп были сопоставимы по возрасту, сопутствующим заболеваниям, объему операции, длительности заболевания.
Восновной группе в местном лечении гнойных ран применялась озонированная композиция растительных масел, полученная по специальной методике, в виде аппликаций на раневую поверхность. Перевязки производились один раз в день.
Озонотерапия является перспективным лечебным методом, отличающимся простотой использования, высокой эффективностьюихорошейпереносимостью.Впоследниегодывпрактикугнойнойхирургиивнедреныразличные методылечениясприменениемозона.Эффективностьозонотерапииобусловленафизико-химическимибиологиче- скими свойствами озона, определяющими бактерио-, фунги- и вируцидный эффекты. Среди других эффектов озона выделяют: дезинтоксикационный, противовоспалительный, антигипоксический [6,9].
На современном этапе развития хирургии к новым препаратам и средствам для лечения ран предъявляются высокие требования. Лечебные препараты должны обладать антисептическими, антибактериальными, бактериостатическими, некролитическими свойствами, оказывать стимулирующее действие на репаративные процессы в ране, усиливать защитные силы организма. В последнее время предпочтение отдают препаратам, создаваемым на основе природногосырья,таккаконинетребуютдлясвоего производствамногочисленныхсинтезов,которыенеизбежно ведут к накоплению в препаратах сопутствующих веществ, ответственных за побочные эффекты. Кроме того, немаловажным фактором является их дешевизна. К таким препаратам относятся озонированные растительные масла. Озонированные масла оказывают длительное воздействие малых доз активных производных форм - озонидов на ткани. Озониды обладают бактерицидными и дезинфицирующими свойствами, передают активный кислород крови и тканям, ускоряют процессы заживления ран. Установлено, что их антисептические свойства в сотни раз активнее, чем таковые у озонированных растворов [6].
Наружное применение озонированного масла дает возможность использовать высокие концентрации озона, которые оказывают прямое окислительное действие на мембрану микроорганизмов.
Вгруппе сравнения для этих же целей использовалась мазь «Левомеколь».
Общее лечение в обеих группах было идентичным и включало использование антибактериальных, дезинтоксикационных, противовоспалительных, иммуномоделирующих и десенсибилизирующих средств. Санация ран наряду с местным применением препаратов включала их адекватное дренирование и иссечение гнойно-некротических тканей, а также дренирование мочевых путей, направленное на минимизацию выделения мочи через свищ. Кроме этого, проводилось симптоматическое лечение сопутствующих заболеваний.
Динамику течения раневого процесса оценивали с помощью клинического, бактериологического и морфометрического методов исследования. Учитывали наличие и характер осложнений, скорость заживления раны, субъективную реакцию пациентов на местное применение препаратов, длительность пребывания больных в стационаре.
Результаты исследования и их обсуждение. При первичном бактериологическом исследовании раневого отделяемого у всех пациентов обеих групп подтверждено микробное загрязнение ран. При бактериологическом исследовании раневого отделяемого выявлены: кишечная палочка в 23 (34,8%) случаях, стафилококки – в 16 (24,2%), протей – в 3 (4,5%), клебсиелла – в 9 (13,6%), синегнойная палочка – в 13 (19,7%), энтеробактер – в 15 (22,7%), цитробактер – в 4 (6,0%), энтерококк – 1 (1,5%). У 53 (80,3 %) больных из раны высевали монокультуру, у 13 (19,7%) − микробную ассоциацию.
У больных основной группы уже после первых перевязок с использованием озонированной композиции растительных масел значительно уменьшались объем отделяемого из раны и проявления инфекционно-воспалительного процесса (гиперемия, перифокальный отек, инфильтрация тканей). Микроскопическая картина характеризовалась положительными бактериологическими изменениями.
Элиминация микроорганизмов в основной группе происходила в среднем через 5,1 ± 0,6 суток, в группе сравнения – через 7,4 ± 0,8 суток. Сроки заживления ран в основной группе составили 9,5 ± 1,1 дня, в группе сравнения – 17,2 ± 2,2 дня. Во время лечения каких-либо побочных эффектов и аллергических реакций вследствие применения озонированной композиции растительных масел отмечено не было. Основным критерием, по которому оценивали эффективность проводимой терапии, была длительность лечения больного в стационаре. В основной группе она оказалась достоверно меньше — 12,2 ± 1,2 дня (в группе сравнения — 17,3 ± 1,8 дня; р < 0,05).
Выводы.
1.Применение озонированной композиции растительных масел для местного лечения инфицированных ран, сочетанных с наружными мочевыми свищами, у больных, перенесших оперативные вмешательства по поводу различной урологической патологии, требующей формирования временного наружного мочевого свища, обусловило позитивный клинический эффект, что выражалось в ускорении заживления ран и сокращении времени пребывания больных в стационаре.
2.Широкий спектр антимикробного, противогрибкового и антивирусного действия наряду с отсутствием побочных эффектов и аллергических реакций позволяет рекомендовать озонированную композицию растительных масел при местномлеченииинфицированныхран,сочетанныхсмочевымисвищамивхирургическойиурологическойпрактике.
Список литературы:
1. Курт Г. Оптимальная терапия инфекций мочевыводящих путей// Клиническая микробиология и антимикробная химиотера-
пия, 1999, №1, с. 23-30.
95
2.Рациональная антимикробная фармакотерапия: Руководство для практикующих врачей. Под ред. Яковлева В. П., Яковлева С. В. Москва, 2003.
3.Хлебников Е. П., Кубышкин В. А. Антибиотикопрофилактика инфекции области хирургического вмешательства в плановой абдоминальной хирургии// Русский медицинский журнал, 2003, №24.
4.Плешков В. Г. Влияние инфекций области хирургического вмешательства на длительность госпитализации пациентов хирургических отделений многопрофильных стационаров / Плешков В. Г., Голуб А. В., Москалев А. П., Галкин Д. В., Беденков А. В., Козлов Р. С. // Альманах клинической медицины, 2007, №16, с. 158-164.
5.Мустафаев Э. М. Роль озонотерапии в профилактике гнойно-воспалительных осложнений после трансуретральной резекции аденомы предстательной железы / Мустафаев Э. М., Мартов А. Г., Наумов А. Г., Синюхин В. Н., Шакир Ф., Меринов Д. С., Амелин А. В., Альбицкая А. Ю.// Урология, 2007, №1, с. 18-19.
6.Кияшко М. Н. Озонотерапия: методические рекомендации / Кияшко М. Н., Кирьянова В. В. /Санкт-Петербург. 2008, – 12 с.
7.Блатун Л. А. Местное медикаментозное лечение ран. Проблемы и новые возможности их решения// Хирургия, 2007, №1.
8.Озонотерапия: методические рекомендации. Под ред. С. П. Перетягина, О. В. Масленникова. Н. Новгород, 1996, 12с.
А. А. Кулаков, С. А. Максимова
Хирургия толстого и тонкого кишечника у больных вич/спид
ГОУ ВПО «Саратовский государственный медицинский университета имени В.И. Разумовского», кафедра факультетской хирургии и онкологии, г.Саратов, МУЗ Городская больница №1, г. Энгельс
Введение. ВИЧ-инфекция входит в группу медленных вирусных инфекций и характеризуется прогрессированием иммунодефицита, в результате чего развиваются вторичные патологические процессы в виде оппортунистических инфекций и опухолей, которые оказывают влияние на прогноз основного заболевания.
ЧислобольныхВИЧ/СПИДвмире,втомчислеивРоссии,продолжаетнеуклоннорасти.Попоследнимданным, в Российской Федерации количество больных достигает 416 тыс. человек, из которых более 11000 в настоящее время уже умерли [1]. С увеличением числа ВИЧ-инфекцированных больных и увеличением средней продолжительности их жизни растет число обращений за медицинской помощью к хирургам. Например, в США среди хирурги- ческихбольных,количествоВИЧ-инфицированныхсоставляет5,3%[2],причемввозрастеот21до40летихчисло может достигать 30% [3]. В африканских странах эти показатели еще выше. Так, в Южноафриканской Республике среди общехирургических больных количество ВИЧ-инфицированных достигает 12%[4]. В Российской Федерации отмечены аналогичные тенденции [5,6].
Сложности в лечении ВИЧ-инфицированных больных представляют оппортунистические инфекции и опухоли [7,8]. Абдоминальные хирурги чаще сталкиваются с атипичными микобактериозами, туберкулезом, цитомегаловирусной инфекцией, лимфомой, саркомой Капоши, приводящие к перфорации, непроходимости кишечника или кровотечению [1,10,11].
Туберкулез у ВИЧ-инфицированных больных поражает кишечник с частотой до 70%. Характерны боль в животе, анемия, лихорадка, потеря массы тела. Пассаж бария по кишечнику, колоноскопия, УЗИ, КТ и лапароскопия с бактериологическим исследованием аспирированной жидкости помогают поставить диагноз [12]. Описан случай множественных перфораций тонкой и толстой кишок туберкулезной этиологии у ВИЧ-инфицированной. Пациентка выжила после оперативного лечения – ушивания перфораций в сочетании с противотуберкулезной терапией, антибиотиками и парентеральным питанием [13].
Цитомегаловирусная инфекция является наиболее частой абдоминальной инфекцией у больных СПИДом, причем 70% больных погибает после операций по поводу абдоминальной хирургической патологии [14]. При цитомегаловирусном илеоколите выполняется экстренная лапаротомия в связи с прогрессированием процесса, возникновением кишечных кровотечений и перфораций. Объем вмешательства-субтотальная колэктомия, частичные резекциикишкиивыведениенаружныхтонко-итолстокишечныхстом.Послеоперационная летальностьсоставила от 71 до 87%, причиной которой были сепсис и пневмоцистная пневмония [15]. Для диагностики цитомегаловирусногоколитарекомендуетсяиспользоватькомпьютернуютомографию,приэтомнаиболееважнаярольотводится таким признакам, как утолщение кишечной стенки в сочетании с ее изъязвлением [16].
Неходжкинская лимфома – частая абдоминальная опухоль у ВИЧ-инфицированных больных, вызывающая кишечную непроходимость или желудочно-кишечные кровотечения, а, иногда, и внутренние кишечно-мочепузырные свищи [17]. Описано поражение неходжкинской лимфомой печени у больного ВИЧ-инфекцией. Диагноз был поставлен на основании жалоб на боль в правом подреберье и подтвержден данными УЗИ и КТ. После правосторонней гемигепатэктомии больной удовлетворительно себя чувствовал через год после операции. Рекомендуется сочетать хирургическое лечение с химиотерапией [18].
Саркома Капоши (СК) в 40-80% поражает перианальную область, желудок, кишечник. Опухолевые узлы располагаются в подслизистом слое, имеют синеватый или бледно-розовый вид, вызывают кровотечения, перфорацию или обтурацию тонкой кишки [19, 20]. При обтурации тонкой кишки СК у больного СПИД с успехом выполнена ее резекция, рецидива саркомы не было до смерти больного. Авторы рекомендуют активное хирургическое лечение этой патологии [21].
Аноректальная патология выявляется у 24% больных ВИЧ-инфекцией [22]. Анальные поражения в 97% случаев встречаются у мужчин-гомосексуалистов [23]. У ВИЧ-инфицированных обычны анальные бородавки, иногда возникают анальные трещины и часто образуются периaнальные абсцессы, приводящие к обширному разрушению параректальных тканей и вынуждающие выполнять превентивную колостомию [24]. Лишь от 16 до 40% операционных ран заживают в течение 3-х месяцев после операции. Еще тяжелее идет выздоровление у больных с уровнем CD4 клеток<50/мм3. В группе из 20 больных СПИДом, которым выполнялись аноректальные операции, 1/3 из них
96
умерли в течение 6 месяцев [25]. Поэтому некоторые хирурги считают, что показания к оперативному лечению у этой категорий больных должны ставиться крайне осторожно [23]. Считается, что геморроидэктомия этим больным не показана [26, 27]. С другой стороны, приводятся наблюдения, что в 53% случаев после геморроидэктомии наступает заживление, в 30% случаев – улучшение и лишь в 17% случаев улучшения не было [28]. Рак прямой кишки все чаще встречается у ВИЧ-инфицированных пациентов. Наиболее часто морфологически верифицируется эпидермоидная и клоакогенная карцинома. Наилучшие результаты приносит комплексное лечение: оперативное в сочетании с лучевой и химиотерапией [29].
В доступной нам отечественной литературе мы встретились с единичными работами, посвященными оказанию помощи больным ВИЧ/СПИД с патологией тонкого и толстого кишечника. В этих работах отсутствуют рекомендации о тактике при решении вопросов об объеме вмешательств и ведении больных в послеоперационном периоде. По нашему мнению, необходимым этапом работы на пути совершенствования медицинского обслуживания является стандартизация хирургической помощи больным ВИЧ/СПИД.
Целью нашей работы является анализ результатов лечения больных ВИЧ/СПИД с заболеваниями тонкой и толстой кишки в хирургических стационарах.
Материалы и методы. В период с 1996 по 2008 гг.. в Центрах СПИД по Саратовской и Ульяновской областям, а также в Республике Мордовия состояло на учете 18381 ВИЧ-инфицированных больных, из них у 367 (2,0%) диагностирован СПИД. С различными хирургическими заболеваниями было госпитализировано 534 пациента (2,9%). Нами проанализированы результаты хирургического лечения у 419 больных с различной хирургической патологией, из которых 19(4,5%) поступили с заболеваниями тонкой и толстой кишки. Эта, наиболее сложная группа пациентов и стала предметом нашего анализа.
Согласно классификации акад. РАМН В. И. Покровского (1989) в исследуемой группе 3 больных (15,8%) нахо-
дились в стадии II Б ВИЧ-инфекции, 10(52,6%) – II В, 1(5,2%) – III А, 3(15,8%) – III Б, 1(5,2%) – IIIВ и 1(5,2%) в IV
стадии. Возраст больных колебался от 19 до 50 лет. Длительность ВИЧ-инфекции составляла от 2 до 12 лет. Результаты. Из 19 больных госпитализированных в хирургические стационары, 4(21,0%) поступило с гемор-
роидальным кровотечением, 2(10,5%) – по поводу подкожного парапроктита, 4(21,0%) – по поводу ишиоректального парапроктита, 1(5,2%) – пельвиоректального парапроктита, 1(5,2%) – с кондиломами перианальной области. В 2 случаях (10,5%) больные поступали с открытой травмой живота и колото-резанными ранами толстой кишки. 1 пациент (5,5%) находился на лечении по поводу неспецифического язвенного колита, 2(10,5%) – с язвенным энтероколитом. Один больной (5,2%) поступил со специфичным для ВИЧ-инфекции абдоминальным туберкулезным энтероколитом, перитонитом, второй (5,2%) – с неходжкинской лимфомой кишечника с перфорацией подвздошной кишки. Наиболее частой сопутствующей патологией были наркомания, гепатиты В, С и их ассоциации – у 11 пациентов (57,8%), у 2 больных (10,5%) был выявлен туберкулез легких (10,5%), у 1(5,3%) – туберкулезный мезаденит.
12 пациентов (63,1%) оперированы, остальные лечились в хирургических стационарах медикаментозно. Операции, хирургические манипуляции и осложнения, развившиеся в раннем послеоперационном периоде, при-
ведены в таблице № 1.
Таблица 1. Операции и послеоперационные осложнения у больных ВИЧ/СПИД.
Операции и хирургические |
Осложнения |
Количество больных |
||
|
|
|||
манипуляции |
|
|
||
Абс. |
% |
|||
|
||||
|
|
|||
|
|
|
|
|
Лапаротомия, резекция илеоцекального угла с |
Нагноение лапаротомной раны |
1 |
8,3 |
|
выведением концевых стом |
||||
|
|
|
||
|
|
|
|
|
Лапаротомия, правосторонняя гемиколэкто- |
Перитонит. Сепсис |
1/1 |
8,3/50,0 |
|
мия, илеостомия |
||||
|
|
|
||
|
|
|
|
|
1)Видеолапароскопия. |
|
|
|
|
2)Лапаротомия, ушивание перфоративных язв |
|
1 |
8,3 |
|
подвздошной кишки |
|
|
|
|
|
|
|
|
|
Резекция тощей кишки, энтеростомия |
Прогрессирование перитонита. |
1/1 |
8,3/50,0 |
|
Сепсис |
||||
|
|
|
||
|
|
|
|
|
Лапаротомия, ушивание раны толстой кишки |
|
1 |
8,3 |
|
|
|
|
|
|
Лапаротомия, колостомия |
|
1 |
8,3 |
|
|
|
|
|
|
Вскрытие и дренирование парапроктита |
|
5 |
41,6 |
|
|
|
|
|
|
Электрокоагуляция кондилом |
|
1 |
8,3 |
|
|
|
|
|
|
Всего: |
|
12/2 |
100,0 |
|
|
|
|
|
|
*-в знаменателе – умершие пациенты
Обращает на себя внимание отказ от использования хирургами эндовидеохирургических технологий для диагностики и лечения у этой сложной категории больных, что, на наш взгляд, связано с недостаточной технической обеспеченностью больниц и слабым владением этими технологиями дежурными хирургами.
97

3 (15,8%) пациентов умерло (один не был оперирован). Настораживает, что процент летальных исходов у этих больных растет сравнительно с ранее приводимыми нами цифрами [20]. Причиной смерти во всех случаях было прогрессирование перитонита, сепсис.
Из трудностей, возникающих в процессе лечения, следует отметить частый отказ ВИЧ-инфицированных больных от предложенной операции, самовольнй уход из стационара, а также неоднозначное отношение хирургов к этой сложной категории больных, искусственное сужение показаний для оперативного лечения, особенно в плановом порядке. Так, один из больных, не смотря на клинику разлитого перитонита, не был оперирован и отказ от операции был связан с подозрением на СПИД. Больной умер.
По нашим данным, структура осложнений и летальности у больных с хирургическими заболеваниями и ВИЧ/ СПИД выше, чем аналогичные показатели у неинфицированных больных с подобной патологией. Это совпадает с данными зарубежных авторов, указывающих на более высокую частоту осложнений у больных ВИЧ/СПИД [19,21,22,23]. Считается,что послеоперационный периоду больных ВИЧ/СПИД характеризуетсядлительной лихорадкой, лейкопенией, снижением репаративных процессов, что вынуждает снимать швы с послеоперационных ран в поздние сроки [24]. Это является одним из основных аргументов для того, чтобы более часто выполнять больным ВИЧ/СПИД эндовидеохирургические операции [4,25].
По нашим данным, послеоперационный период у оперированных больных (в 62% случаев) протекал тяжело, с нагноением ран, прогрессированием перитонита. В анализах крови у этих больных мы наблюдали лейко- и лимфопению. У пациентов длительное время сохранялись гипертермия, лейкоцитоз со сдвигом лейкоцитарной формулы влево, гипопротеинемия, нарастание дефицита массы тела. У больных в стадии вторичных заболеваний, с количеством CD4 клеток менее 200, отмечалась более выраженная лейкопения. Сдвиг лейкоформулы влево, как правило, уменьшался, что свидетельствовало не о положительной, а об отрицательной динамике в состоянии пациента. Выполнениебольшихпообъемуоперацийутакихбольныхбылорискованно,апрогноздляжизнибыл,вбольшинстве случаев, неблагоприятным.
Приведем клинический пример сложности диагностики и выбора рациональной хирургической тактики. Больная Т., 40 лет, поступила в одну из клиник г. Саратова 30.06.09г. с направительным диагнозом: «Опухоль
слепой кишки» с жалобами на боль в животе, слабость, запоры, похудание. В июне у нее впервые выявлена ВИЧинфекция в стадии IIIБ, фаза прогрессирования, орофарингеальный кандидоз, дефицит массы тела более 10%. Уровень CD4+клеток -10/мм3, CD4/ CD8=0,08. Антиретровирусной терапии не получала. При поступлении состояние средней тяжести, истощена. Живот несколько вздут, мягкий, при пальпации болезненный больше в правой половине. Напряжения мышц брюшной стенки и симптомов раздражения брюшины нет. При колоноскопии от 3.07 в восходящей ободочной кишке обнаружена язва 3*2,5*0,5см. с неровными краями, покрытая фибрином, края эластичные, мягкие, выполнена биопсия. При гистологическом исследовании – слизистая толстой кишки с диффузноочаговой воспалительной инфильтрацией. Заключение: Рак восходящей ободочной кишки? Специфическая язва восходящей ободочной кишки?
Больной назначена консервативная терапия: в/венная инфузия, антибиотики, анальгетики. 6.07 у больной резко ухудшилось состояние: появилась резкая боль в животе и многократная рвота. С подозрением на перфорацию полого органа она взята в операционную. При лапаротомии в животе обнаружено 300мл мутного выпота без запаха. Выявлены язвы тонкой кишки, одна из них, в 10см от илеоцекального угла – с перфорацией (фото 1).
Фото 1. Язва подвздошной кишки с перфорацией.
Выраженный мезаденит, один из конгломератов лимфоузлов в брыжейке – с абсцедированием (40 мл. гноя без запаха). Выполнена аппендэктомия (червеобразный отросток гиперемирован, отечен) – фото 2, наложена петлевая илеостома.
98
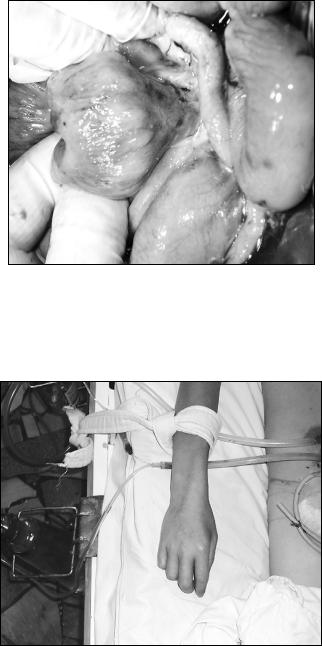
Фото 2. Изменения в червеобразном отростке.
Брюшная полость санирована, оставлен дренаж в малом тазу. В послеоперационном периоде больная получала зивокс,метрагил,инфузионнуютерапию.10.07убольнойвновьпоявиласьклиникапослеоперационногоперитонита, в связи с чем выполнена релапаротомия, при которой выявлена перфоративная язва тощей кишки в метре от связки Трейца. На переднюю брюшную стенку выведена петлевая еюностома с участком перфорации. Брюшная полость дренирована 3-х канальными дренажами для проточно-промывного дренирования с активной аспирацией (фото 3).
Фото 3. Активное дренирование брюшной полости.
13.07 по дренажам из брюшной полости стало поступать кишечное отделяемое, в связи с чем выполнена релапаротомия II. В 16см от предыдущей перфорации выявлена новая перфоративная язва, в связи с чем произведена резекция 30см тощей кишки вместе с перфоративными язвами и еюностомой. 2-х ствольная еюностомия с ретроградной интубацией тонкой кишки. В послеоперационном периоде у больной нарастала полиорганная недостаточность и 14.07 в 14.30 наступила смерть больной.
Таким образом, данный пример показывает, что тактика хирургического лечения ВИЧ-инфицированных больных остается сложной, неотработанной и нуждается в дальнейшем изучении. Возможно, что лишь объединение усилий хирургов, гастроэнтерологов, врачей центров СПИД позволит продвинуться вперед в этом направлении.
Выводы:
1.В настоящее время имеется тенденция по нарастанию количества пациентов с ВИЧ/СПИД в структуре больных, обращающихся за неотложной хирургической помощью, с чем связана необходимость более глубокого изучения течения клиники экстренных заболеваний и послеоперационного периода у этих пациентов.
2.Доля больных ВИЧ/СПИД с заболеваниями кишечника, обращающихся за медицинской помощью в хирургические стационары, невелика (4,5%). Однако это сложная категория пациентов с высокой летальностью (15,8%) нуждается в пристальном внимании врачей всех специальностей.
3.ЯзвенныйэнтероколитупациентовсВИЧ-инфекциейостаетсянерешеннымвопросом каквдиагностическом, так и в тактическом плане, отличается «злокачественным» течением и часто приводит к летальным исходам.
99
Список литературы:
1.Ладная Н. Н. Развитие эпидемии ВИЧ-инфекции в регионах Российской Федерации в 2007г / Ладная Н. Н., Соколова Е. В., Юрин О. Г., Кравченко А. В., Буравцова Е. В., Нарсия Р. С. и др. // Эпидемиология и инфекционные болезни. 2008. №3. С.7-12. 2.Adkins M. S. Esophageal perforation in a patient with acquired immunodeficiency syndrome /Adkins M. S., Raccuia J. S., Acinapura A. J.//Ann. Thorac. Surg. 1990. Vol.50(2). Р.299-300.
3.Yoshida E. M. Perforation of the jejunum secondary to AIDS-related gastrointestinal Kaposi's sarcoma / Yoshida E. M., Chan N. H., Chan-Yan C., Baird R. M. // Can. J. Gastroenterol. 1997. Vol.11 Р.38-40.
4.BondoM.HIVinfectioningeneralsurgicalpatientsattheGa-Rankuwa/MEDUNSAcomplexSouthAfrica /BondoM.,ModibaM.C., Becker P.// East.Afr. Med. J. 2001. Vol.78(8). P.395-397.
5.Блувштейн Г. А. Гнойные и ангиохирургические осложнения у наркозависимых и ВИЧ – инфицированных больных / .Блувштейн Г. А., Лосев Р. З., Куликова А. Н., Тихонова Л. А., Кулаков А. А.// Анналы хирургии. 2008. №5. С.62-67.
6.Евсюков О. А. Особенности течения и хирургического лечения острого аппендицита у ВИЧ-инфицированных больных / Евсюков О. А., Кубышкин В. А., Сундуков А. В. // Хирургия. 2008. №12. С.12-16.
7.Calore E. E.Bone marrow pathology in AIDS / Calore E. E., Tanaka P. Y., Perez N. M., de Almeida L. V. // Pathol. Res. Pract. 2004. Vol.200(9). Р.591-597.
8.Montejo M. Pyomyositis in AIDS / .Montejo M., Aguirrebengoa K., Urkijo J.C., Mendoza F., Prieta R., Mateos I. et al. // Enferm. Infecc. Microbiol. Clin. 1990. Vol.8(7). Р.441-442.
9.Deziel D. J. Major abdominal operations in acquired immunodeficiency syndrome / Deziel D. J., Hyser M. J., DoolasA., Bines S. D., Blaauw B. B., Kessler H.A. //Am. Surg. 1990. Vol.56(7). Р.445-450.
10.Chinoy R. F. Intractablediarrhea and melena inanAIDS patient / Chinoy R. F., PradhanS.A.//IndianJ. Gastroenterol.1990.Vol.9(2). Р.159-160.
11.Scoazec J. Y. Non-Hodgkin's lymphoma presenting as a primary tumor of the liver: presentation, diagnosis and outcome in eight patients / Scoazec J.Y., Degott C., Brousse N., Barge J., Molas G., Potet F. et al.// Hepatology. 1991. Vol.13(5). Р.870-875. 12.Schanaider A. Intra-abdominal tuberculosis in acquired immunodeficiency syndrome. Diagnosis and management / Schanaider A., Madi K.// Int. Surg. -1995. – Vol. 80, №2. – Р.147-151.
13.Midiri G. A case of multiple intestinal perforations due to TBC in a female patient with HIV-1 infection / Midiri G., Urbano V., LombardiA., CovottaA. et al.// G. Chir. – 1993. –Vol. 14, №4-5. –Р. 227-230.
14.Wexner S. D. Emergency colectomy for cytomegalovirus ileocolitis in patients with the acquired immune deficiency syndrome / Wexner S. D., Smithy W. B., Trillo C., Hopkins B. S. et al. // Dis Colon Rectum. -1988. – Vol. 31, №10. – Р.755-761.
15.Kram H. B. Intestinal perforation due to cytomegalovirus infection in patients withAIDS / Kram H. B., Shoemaker W. C.// Dis Colon Rectum. – 1990.-Vol. 33, №12.-Р.1037-1040.
16.Murray J. G. Cytomegalovirus colitis inAIDS: CT features / Murray J. G., Evans S. J., Jeffrey P. B., Halvorsen R.A. Jr // AJRAm. J. Roentgenol. – 1995. – Vol. 165, №1. – Р. 67-71.
17.Wilson S. E. Acquired immune deficiency syndrome (AIDS). Indications for abdominal surgery, pathology, and outcome / Wilson S. E., Robinson G., Williams R.A., Stabile B. E. et al. //Ann. Surg. – 1989. – Vol.210, №4. – Р.428-433.
18.PicciocchiA. Major liver resection for non-Hodgkin's lymphoma in an HIV-positive patient: report of a case / PicciocchiA., Coppola R., Pallavicini F., Riccioni M. E. et al. // Surg. Today. -1998. –Vol. 28, №12. – Р.1257-1260.
19.Агапов В. В. О проблеме СПИД для хирургов / Агапов В. В., Дубошина Т. Б., Мышкина А. К// Вестник хирургии.-1989.-
№8.-С.130-133.
20.Yoshida E. M. Perforation of the jejunum secondary to AIDS-related gastrointestinal Kaposi's sarcoma / Yoshida E. M., Chan N. H., Chan-Yan C., Baird R. M.// Can. J. Gastroenterol. – 1997. – Vol. 11, №1. – Р.38-40.
21.Wheeler D. W. Palliative surgery for acute bowel obstruction caused by Kaposi's sarcoma in a patient with AIDS / Wheeler D. W., Baigrie R. J. // Int. J. Clin. Pract. – 2003. – Vol. 57, №4. –Р.347-348.
22.Beck D. E. Proctologic management of the HIV-positive patient / Beck D. E., Jaso R. G., Zajac R.A.// South Med. J. – 1990.-Vol. 83, №8.-Р. 900-903.
23.Stratmann H. Experiences in surgery of proctologic diseases in patients with HIV infection / Stratmann H., Kaminski M., Lauschke H., HirnerA.// Chirurg. 1999. – Vol. 70, №12. – Р.1475-1479.
24.Wastell C. Surgery and human immunodeficiency virus-1 infection / Wastell C., Cerless D., Keeling N. //Am. J. Surg. – 1996. – Vol. 172. – P.89-92.
25.Lord R. V.Anorectal surgery in patients infected with human immunodeficiency virus: factors associated with delayed wound healing //Ann. Surg. – 1997. –Vol. 226, №1. – Р.92-99.
26.Кузин М. И. Особенности работы хирурга с ВИЧ-инфицированными больными // Хирургия.-1991.-№10.-С.6-10. 27.Смирнов Г. Г. Хирургическая помощь ВИЧ-инфицированным и больным СПИДом / Смирнов Г. Г., Булискерия Т. Н., Хачатрян Н. Н., Володина В. Н. и др.// Хирургия.-2000.-№7.-С.46-50.
28.Safavi A. Anorectal surgery in the HIV+ patient: update / Safavi A., Gottesman L., Dailey T. H. // Dis Colon Rectum. -1991. – Vol. 34, №4. – Р.299-304.
29.Ruiz Molina J. M. Cancer of the anal canal / Ruiz Molina J. M, Gomez Aceytuno R., Gallardo Rincon D., Herrera R. et al. // Rev. Gastroenterol. Mex. – 1997. –Vol. 62, №3. – Р.184-188.
Н. А. Никитин, Р. В. Головин
Сравнительная характеристика некоторых способов комбинированной герниопластики при послеоперационных вентральных грыжах
ГБОУ ВПО Кировская ГМА Минздравсоцразвития России, г. Киров
Введение. Послеоперационные вентральные грыжи (ПОВГ) возникают у 2-20 % больных, перенесших лапаротомию, и по частоте занимают второе место после паховых грыж [2]. Лечение ПОВГ остается актуальной проблемой абдоминальной хирургии, о чем свидетельствует большое число рецидивов заболевания, доходящих до 20% и более в общехирургических стационарах и в интервале от 1 до 5% в специализированных герниологических центрах [1,4].
Современнаягерниологиянемыслимабезиспользованиясетчатыхсинтетическихматериалов[6].Приэтомэндопротез используют в одном из нескольких вариантов расположения по отношению к мышечно-апоневротическому слою передней брюшной стенки: onlay, sublay, inlay.
100
Основным недостатком пластики сетчатым протезом является развитие послеоперационных осложнений: нагноение, серома, гематома, отторжение протеза, формирование кишечных спаек и свищей [3,4,5,6,7].
Частота раневых осложнений после пластики передней брюшной стенки при ПОВГ варьируется от 20,9
до 67 % [4].
Современная хирургия ПОВГ должна включать в себя не только ликвидацию грыжи, но и восстановление нарушенной анатомии и сниженной функции передней брюшной стенки при исключении существенного повышения внутрибрюшного давления и натяжения тканей. В противном случае она будет носить паллиативный характер, особенно когда речь идет о грыжах средних и больших размеров. Отсутствие этого этапа в оперативном лечении ПОВГ у лиц молодого и среднего возраста ограничивает выбор профессии и существенно снижает качество жизни пациента [5]. Большинство способов пластики по вышеуказанным технологиям не решают этот вопрос.
Проблему восстановления топографии передней брюшной стенки и ее функций на сегодняшний день призваны решать комбинированные способы пластики с одновременным использованием для пластики местных тканей и эндопротезовсразличнымивариантамиихразмещения.ВрезолюцииVIIгерниологическойконференции(Москва, 2010) подчеркнуто, что технологии «onlay» и «sublay» являются комбинированными: в первом случае протез размещается над апоневрозом, во втором – под апоневрозом, однако эти технологии в своей первоначальной сути не являются ненатяжными.
Насегодняшнийденьсуществуютипродолжаютразрабатыватьсякомбинированныеспособыпластикипередней брюшной стенки, устраняющие натяжение тканей, однако далеко не все они направлены на восстановление анато- миипереднейбрюшнойстенки.Большинствоизнихвключаютвсебяманипуляциинамышечно-апоневротических структурах. Мышечные структуры при этом используются в качестве ложа для эндопротеза.
При ПОВГ с этой целью отдается предпочтение прямым мышца живота. Прямые мышцы живота находятся в более благоприятных условиях: они сохраняют точки прикрепления и свою непрерывность, хотя и функционируют в условиях выраженной деформации, резкого расхождения и изгиба. Прямые мышцы значительно медленнее теряют свою функцию и более длительное время сохраняют возможность ее восстановления [5].
Цель исследования. Улучшить результаты лечения больных ПОВГ срединных локализаций путем внедрения в практику нового способа комбинированной герниопластики, направленного на восстановление анатомии передней брюшной стенки.
Материалы и методы исследования. Нами разработан способ аллопластики вентральных грыж срединных локализаций, обеспечивающий надежное устранение грыжевого дефекта, сохранение футлярности прямых мышц по медиальному контуру, восстановление их анатомии и анатомии белой линии живота (патент РФ № 2398530 от 10.09.2010г.). Сущность способа заключается в следующем. После продольного рассечения передних листков влагалищ прямых мышц живота на всю длину грыжевых ворот, отступя от последних на 1/2 их ширины, сшивание медиальныхапоневротическихлоскутовосуществляютбезихотсепаровкиотмышцполиниям,расположеннымна расстоянии 1,5-2,0см от краев лоскутов. В образовавшиеся над прямыми мышцами живота между медиальными и латеральными лоскутами апоневроза диастазы, апоневротические границы которых при суммарном рассмотрении выглядят как два, помещенных друг в друга овала с малым внутренним и большим наружным периметрами, непрерывными синтетическими швами вшивают выкроенный по форме и размерам наружного овала сетчатый трансплантат сначала к латеральным, затем к медиальным листкам рассеченных влагалищ прямых мышц живота с дополнительной фиксацией его узловыми швами к срединной линии. Операцию заканчивают послойным ушиванием раны с установкой дренажей для последующей вакуумной аспирации. Принципиальными моментами предложенногоспособа являются:отсутствиенеобходимостивразворачиваниимедиальныхлистковапоневротических лоскутов, увеличение задних стенок влагалищ прямых мышц за счет перемещения передних листков, сохранение футлярности прямых мышц по медиальному контуру с устранением их латерализации и восстановлением анатомии, воссоздание белой линии живота и фиксация аллопротеза по двойному контуру.
За период с 2008 по 2010 годы на базе хирургических отделений Северной городской клинической больницы г. Кирова прооперировано 193 пациента с ПОВГ срединных локализаций. Из них пластика местными тканями выполнена у 41(21,25%) пациента, как правило, при грыжах малых размеров, аллопластика – у 152 (78,75%) при грыжах средних и больших размеров.
Все плановые пациенты проходили тщательное догоспитальное обследование и осмотр смежных специалистов, в том числе оценку функции внешнего дыхания (ФВД). Предоперационная подготовка проводилась с учетом сопутствующей патологии. Всем больным проводилась неспецифическая профилактика тромбоэмболических осложнений: эластическая компрессия нижних конечностей, ранняя активизация больных, гепаринотерапия с первых 12 часов после операции и в течение 5-7 дней послеоперационного периода. Для профилактики послеоперационных раневых осложнений за 30 минут до операции или интраоперационно вводились антибиотики цефалоспоринового ряда. Во всех случаях выполнялось дренирование раны в течение 2-5 дней в зависимости от количества отделяемого. В послеоперационном периоде выполнялся ультразвуковой контроль течения раневого процесса на 10 сутки.
Аллопластика выполнялась с использованием эндопротезов «Prolene» или «Ultrapro». Пластика предложенным комбинированным способом применена в 48 случаях, комбинированным способом Белоконева В.И. – в 49, по тех-
нологии «onlay» – в 38, «inlay» – в 4, «sublay» – в 13.
Результаты и их обсуждение. При анализе течения послеоперационного периода больные с пластикой «inlay» и «sublay» по причине небольшого числа наблюдений исключены из исследования. В раннем послеоперационном периоде после пластики предложенным способом осложнений со стороны послеоперационной раны и летальных исходов не отмечено ни в одном случае.
101
Средние сроки нахождения дренажей в подкожной клетчатке составили 5,4±0,6 суток, среднее ежесуточное количество отделяемой серозной жидкости по ним – 51,2±1,3 мл, средний койко-день пребывания в стационаре –
13,17±0,45к/д.
В то же время указанные показатели при комбинированной пластике по Белоконеву составили 9,8±1,7 суток, 75,4±1,6 мл и 17,16±1,28 к/д соответственно, а при пластике по технологии «onlay» – 14,1±0,3 суток; 98,5±3,2 мл; 18,68±2,3 к/д.
Меньшее количество раневого отделяемого и более короткие сроки дренирования при предложенном способе герниопластики мы объясняем более высоким соотношением активной всасывающей поверхности, какой является поверхность обнаженных мышц, к общей площади раневой поверхности. В сроки наблюдения от 6 мес. до 2 лет рецидивов грыж не выявлено.
Выводы. Предложенный способ комбинированной герниопластики при ПОВГ срединной локализации, направленныйнасохранениефутлярностипрямыхмышцживотапомедиальномуконтуру,восстановлениеихтопографии и анатомии белой линии живота без существенного уменьшения размеров брюшной полости и повышения внутрибрюшного давления, обладает профилактической направленностью в отношении развития сером и может быть рекомендован для широкого применения.
Список литературы:
1.Адамян А. А, Накашидзе Д. К., Чернова Л. М.//Хирургия, 1994, №7, с.45-47.
2.Деметриашвили З. М. Лечение послеоперационных вентральных грыж / Деметриашвили З. М., Магалашвили Р. Д., Лобжа-
нидзе Г. В.// Хирургия, 2008, №11, с. 44-46.
3.Загиров У. З. Анатомо-функциональное обоснование нового способа комбинированной пластики срединных вентральных грыж / Загиров У. З., Салихов М. А., Исаев У. М.// Хирургия, 2008, №7, с. 41-42.
4.Жебровский В. В. Ранние и поздние послеоперационные осложнения в хирургии органов брюшной полости. Киев: КГМУ, 2000.
5.Любых Е. Н. О некоторых вопросах герниологии и путях их решения/ Любых Е. Н., Полубкова Г. В.// Герниология, 2009,
№2(22), с.14-17.
6.Мирзабекян Ю. Р. Прогноз и профилактика раневых осложнений после пластики передней брюшной стенки по поводу послеоперационной вентральной грыжи / Мирзабекян Ю. Р., Добровольский С. Р.// Хирургия, 2008, №1, с. 66-71.
7.Нелюбин П. С. Хирургическое лечение больных с послеоперационными и рецидивными вентральными грыжами / Нелюбин П. С., Галота Е. А., Тимошин А. Д. // Хирургия, 2007, №7, с. 69-74.
Н. А. Никитин, Е. С. Прокопьев
Заболевания тонкой кишки в структуре причин желудочно-кишечных кровотечений
ГБОУ ВПО Кировская ГМА Минздравсоцразвития России, г. Киров
Введение. Несмотря на инновационные подходы в диагностике и лечении хирургических заболеваний, желудочно-кишечные кровотечения до сих пор остаются камнем преткновения в ургентной хирургии. Это, прежде всего, обусловлено высокими цифрами заболеваемости и неудовлетворительными результатами лечения пациентов с данной патологией [5,6]. Особую опасность представляют рецидивы кровотечений, летальность при которых до-
стигает 60-90% [1,4].
Увеличение количества больных с желудочно-кишечными кровотечениями обусловлено не только разнообразием их причин, но и совершенствованием диагностических исследований. На сегодняшний день для поиска источника кровотечений широко применяют эндоскопические методы: фиброэзофагогастродуоденоскопия (ФЭГДС), фибкроколоноскопия (ФКС). По показаниям они могут преследовать и лечебный эффект.
Наиболее частой причиной желудочно-кишечных кровотечений с явными клиническими симптомами является язвенная болезнь желудка и двенадцатиперстной кишки (ДПК). Именно поэтому кровотечения язвенной этиологии так активно обсуждаются в современной литературе, благодаря чему определилась стратегия лечения больных с данной патологией [2,3].
Сдругой стороны имеется небольшое количество заболеваний, когда кровотечения имеют скудные симптомы
ввиде изменения характера и окраски каловых масс. Однако рецидивирующий характер подобных кровотечений может приводить к значительной анемизации больных, а при интенсивном кровотечении приводит к летальным исходам. Речь, прежде всего, идет о патологии тонкой кишки. В практике данные пациенты в большинстве случаев поступают и выписываются из стационаров с формулировкой «желудочно-кишечное кровотечение неясной этиологии», поскольку ФЭГДС и ФКС в подобных ситуациях оказываются неинформативными. Поиск источника при помощи видеокапсул требует специального оборудования, является дорогостоящим и возможен лишь в крупных специализированных центрах. С этих позиций тактические аспекты лечения больных с патологией тонкой кишки до сих пор требуют активного изучения.
Цель исследования. Изучениезаболеванийтонкойкишкивструктурепричинжелудочно-кишечныхкровотечений.
Материал и методы. В основу работы положен анализ историй болезни 550 больных в возрасте от 15 до 90 лет, оперированных по поводу желудочно-кишечных кровотечений различной этиологии в хирургических отделениях Северной городской клинической больницы г. Кирова за период с 2000 г. по 2010 г. Всем больным в предоперационном периоде выполнены общий и биохимический анализ крови, произведена оценка свертывающей системы, определение скрытой крови в кале (реакция Грегерсена), ФЭГДС. ФКС пациентам с клиническими признаками профузного толстокишечного кровотечения экстренно не проводилось.
102
530 (96,2%) пациентов госпитализировано с клиническими признаками высокого желудочно-кишечного кровотечения (при локализации источника в пищеводе, желудке, ДПК), что подтверждалось при проведении ФЭГДС. С признаками тонко- и толстокишечных кровотечений – 20 (3,8%) больных.
Результаты и их обсуждение. Согласно классификации В.И. Петрова, Н.А. Ерюхина, И.С. Шемякина (1987) желудочно-кишечные кровотечения у 386 (70,2%) больных имели язвенную природу: язвенная болезнь желудка и ДПК выявлена в 361 (93,5%) случае, постгастрорезекционный синдром в виде пептических язв гастроэнтероанастомоза – в 25 (6,5%). У 164 (29,8%) пациентов желудочно-кишечные кровотечения носили неязвенный характер (таблица 1).
Таблица 1. Причины неязвенных желудочно-кишечных кровотечений
Причина кровотечения |
Количество больных |
||
(абс.) |
(%) |
||
|
|||
|
|
|
|
Синдром Маллори-Вейса |
63 |
38,4 |
|
|
|
|
|
Острые язвы желудка и ДПК |
39 |
23,7 |
|
|
|
|
|
Новообразования желудка: |
|
|
|
- злокачественные |
26 |
15,9 |
|
- доброкачественные |
7 |
4,3 |
|
Варикозное расширение вен пищевода и желудка |
7 |
4,3 |
|
|
|
|
|
Заболевания ДПК и тонкой кишки: |
|
|
|
- новообразования |
8 |
4,9 |
|
- дивертикулы |
3 |
1,8 |
|
Заболевания толстой кишки: |
|
|
|
- дивертикулярная болезнь |
5 |
3,1 |
|
- злокачественные новообразования |
3 |
1,8 |
|
- неспецифический язвенный колит |
1 |
0,6 |
|
|
|
|
|
Гастроэзофагеальная рефлюксная болезнь (язва пище- |
2 |
1,2 |
|
вода) |
|||
|
|
||
Всего: |
164 |
100,0 |
|
|
|
|
|
Среди пациентов с энтерогенными новообразованиями в 7 (4,3%) случаях имело место наличие доброкачественных опухолевых процессов стенки и брыжейки тонкой кишки, в 1 (0,6%) – полип ДПК. У 2 (1,2%) больных причинами неязвенных кровотечений явился дивертикул Меккеля, у 1 (0,6%) – дивертикул нисходящей части двенадцатиперстной кишки.
В отличие от кровотечений язвенной этиологии оперативные вмешательства на тонкой кишке предусматривали иссечение патологического очага (клиновидное иссечение опухоли и резекция дивертикула).
При гистологическом исследовании удаленных образований тонкой кишки были получены следующие результаты. Исследование дивертикулов тонкой кишки выявило признаки воспаления в данных образованиях в 2 случаях. В 1 наблюдении имело место гетеротопия слизистой оболочки желудка в стенку дивертикула Меккеля, при этом источником кровотечения явилось изъязвление прилегающей стенки подвздошной кишки. Среди опухолей тонкой кишки в 3 исследованиях обнаружены доброкачественные образования, исходящие из мышечной оболочки стенки кишки (лейомиомы), в 1 – имел место железистый полип. В 2 случаях опухоли носили сосудистый характер (кавернозная гемангиома и гломус-ангиома), в 2 остальных наблюдениях диагностирована гетеротопия клеток поджелудочной железы в стенку тонкой кишки.
Заболевания тонкой кишки как причина желудочно-кишечных кровотечений, в исследуемой группе выявлены тольколишьинтраоперационноу11пациентов,чтосоставило6,7%вструктуренеязвенныхкровотеченийи2%среди всех причин желудочно-кишечных кровотечений. При гистологическом исследовании, большинства из них (помимо дивертикулов) имелись признаки гастроинтестинальных стромальных опухолей, которые трудны не только для клинико-инструментальной диагностики, но и для микроскопической, поскольку требуют дорогостоящего оборудования. В настоящее время для полной интраоперационной верификации выявленного образования необходимо проведение цитологических исследований с целью выбора оптимального объема оперативного вмешательства.
Выводы:
1.Заболевания тонкой кишки, как причина желудочно-кишечных кровотечений, по сей день остаются трудными для диагностики.
2.Для выявления заболеваний тонкой кишки как причины желудочно-кишечного кровотечения необходимо опираться на клинические проявления и максимально использовать все имеющиеся в лечебно-профилактических учреждениях диагностические мероприятия, вплоть до диагностической лапаротомии, что полностью обеспечивает выявление и устранение дальнейшего прогрессирования заболевания.
Список литературы:
1.Гостищев В. К. Проблема выбора метода лечения при острых гастродуоденальных язвенных кровотечениях / Гостищев В. К., Евсеев М. А. //Хирургия, 2007, №7, с. 7-10.
103
