
4 курс / Акушерство и гинекология / Диссертация_Агрба_И_Б_Органосохраняющее_хирургическое_лечение_родильниц
.pdf81
ность послеоперационного койко-дня варьировала в пределах 4–14 дней, составив в среднем 7,3 ± 1,28 дней. Необходимо уточнить, что пролонгирование стационарного лечения в послеоперационном периоде было обусловлено назначением парентеральных препаратов железа у больных анемией 2–3-й степени.
Послеоперационное ведение родильниц основной группы и группы сравнения основывалось на следующих принципах:
1)антимикробная терапия (цефалоспорины 3-го поколения, метронидазол, фентиконазол) с целью профилактики гнойно-септических осложнений в послеоперационном периоде,особое значение это имело при истинном врастании плаценты с сопутствующей анемией 2–3-й степени;
2)консервативная гемостатическая терапия для профилактики кровотечений (транексамовая кислота);
3)утеротоническая терапия препаратами окситоцина;
4)коррекция анемии препаратами железа с целью улучшения оксигена-
ции тканей и улучшения репаративных процессов в матке.
Одним из ключевых аспектов послеоперационного ведения пациенток с аномалией прикрепления плаценты считали проведение антимикробной профилактики и терапии. Как известно, в современной хирургии профилактике инфекционных осложнений придается большое значение, поскольку даже при строжайшем соблюдении условий асептики в операционной крайне сложно избежать бактериальной контаминации любой хирургической раны (Стрижаков А.Н. и Давыдов А.И., 2008; Cronen G. et al., 2005). В то же время, послеоперационная хирургическая инфекция не только ухудшает репарацию резаных тканей, но и существенно отягощает течение послеоперационного периода.
Наиболее действенным способом защиты хирургического пациента от возможной контаминации собственной условно-патогенной флорой, населяю-
82
щей кожу и органы мочеполовой системы, по праву считается антимикробная профилактика (АМП).
Под хирургической АМП подразумевают предупреждение инфекций, возникающих вследствие хирургических или других инвазивных вмешательств либо имеющих прямую связь с ними, но не лечение фоновой инфекции, на устранение которой направлено вмешательство. Сущность АМП заключается в достижении необходимых концентраций антибактериальных средств в тканях до момента их возможной микробной контаминации и поддержание этого уровня в течение всей операции и первых 3-4 часов после хирургического вмешательства. Задача АМП – снизить до минимума риск развития послеоперационных инфекционных осложнений (Баев О.Р. и др., 2010; Баринов С.В. и др., 2012; Белобородова Н.В., 2009).
По степени риска развития инфекционных осложнений выделяют четыре типа хирургических вмешательств: «чистые», «условно чистые», «загрязненные», «грязные» (Taylor E.W., 1997).
Внутриматочную хирургию в зависимости от типа выполняемой операции можно отнести к «условно чистой», реже – «загрязненной» категориям. Однако не зависимо от вида градации, согласно рекомендациям Европейской ассоциации хирургов (European Surgical Association), и «условно чистые» и «загрязненные» типы операций являются абсолютным показанием к периоперационой АМП. Причем если при «условно-чистых» операциях применение антимикробных средств можно ограничить в рамках профилактического курса, то при «контаминированных» вмешательствах нередко требуется пролонгированная антибактериальная терапия. В общепризнанной классификации степени загрязненности хирургических вмешательств трансцервикальная электрохирургическая резекция плацентарной площадки не упоминается. Вместе с тем, очевидно, что данную операцию целесообразно отнести к «грязным» вмешательствам, требующим пролонгации введения антимикробных химиопрепа-
83
ратов.
Существуют определенные принципы АМП инфекционных осложнений хирургических вмешательств, которые объединены А.Н. Стрижаковым и А.И. Давыдовым в монографии авторов «Влагалищная хирургия (2008):
1)лекарственное средство должное вводиться не ранее, чем за один час до начала операции;
2)основным способом введения антимикробных препаратов является внутривенный;
3)выбранный препарат должен хорошо проникать в ткани – зоны риска инфицирования;
4)продолжительность профилактического использования антимикробных средств не должна превышать 24 часов;
5)при «условно чистых» операциях ограничиваются 1-2 терапевтическими дозами препарата;
6)если длительность хирургического вмешательства превышает период полувыведения лекарственного средства, используемого для антибиотикопрофилактики, и/или кровопотеря составляет свыше одного литра, необходимо вводить повторную дозу антибиотика;
7)антимикробный препарат не должен вступать в фармакокинети-
ческие взаимодействия со средствами для анестезии и миорелаксантами.
Время введения первой дозы лекарственного средства – один из наиболее важных аспектов хирургической АМП. Его определяют, исходя из основной цели АМП – создать в околораневых тканях или потенциальном очаге инфекции бактерицидные концентрации антимикробного препарата и сохранить их в течение всей оперативной агрессии, а также в первые 3-4 часа после операции (решающий период для адгезии и размножения попавших в рану микробов) (Яковлев С.В., 2009). Считается, что оптимальное время для профи-
84
лактического введения антибиотика – не ранее, чем за один час до операции, так как к моменту инцизии в тканях создаются адекватные концентрации лекарственного средства. При использовании цефалоспоринов АМП можно начинать в операционной за 15-20 мин до разреза. В таком случае максимальная концентрация антимикробного средства в тканях обеспечивается к моменту разреза – одному из «критических» эпизодов операции, когда, собственно, и начинается контаминация раны (Яковлев В.П. и Яковлев С.В., 2003). Именно последних рекомендаций мы придерживались в своих исследованиях.
По данным А.Н. Стрижакова и А.И. Давыдова (2008), главные принципы выбора лекарственного средства для АМП заключаются в следующем:
-не следует назначать антимикробные средства с очень широким спектром действия (цефалоспорины третьего-четвертого поколений, карбапенемы, фторхинолоны, уреидопенициллины), которые используют для лечения инфекционных осложнений и которые способствуют более быстрому формированию резистентности микроорганизмов;
-не рекомендуется применение препаратов с очень коротким периодом полувыведения (бензилпенициллин, ампициллин) из-за необходимости их частого повторного введения (каждые 1-2 часа);
-не использовать средства с бактериостатическим эффектом (тетрациклины, хлорамфеникол, сульфаниламиды), так как назначение бактериостатиков не обеспечивает быстрого эффекта и не способствует санации раневой поверхности и тканей, обсемененных микроорганизмами;
-по возможности не применять антибиотики с потенциально высоким уровнем природной или приобретенной резистентности бактерий (пенициллин, ампициллин, амоксициллин, карбенициллин, гентамицин, котримоксазол), а также препараты, способствующие быстрому развитию резистентности (карбенициллин, тикарциллин, пиперациллин
85
и азлоциллин);
-не использовать препараты с токсичным побочным действием (аминогликозиды, полимиксины);
-при выполнении операций, сопряженных с относительно большой кровопотерей, не применять средства, повышающие риск кровотечений (цефамандол, цефотетан, цефоперазон, карбенициллин, тикарциллин, пиперациллин и др.).
Поэтому при резекции плацентарной площадки мы использовали 2 схе-
мы АМП:
1)при неосложненном хирургическом вмешательстве, отсутствии анемии – цефазолин 2,0 г + метронидазол 0,5 г внутривенно однократно во время вводного наркоза; со 2-х суток послеоперационного периода
– переход на таблетированную форму пролонгированного офлоксацина (400 мг/сутки) до третьих суток послеоперационного периода;
2)на фоне анемии 2-3 степени и/или осложненный преморбидный фон и/ли кровопотеря свыше 400 мл – цефазолин 2,0 г + метронидазол 0,5 г внутривенно во время вводного наркоза и далее через 5-6 часов в течение 24 часов; со вторых суток послеоперационного периода – переход на таблетированую форму пролонгированного офлоксацина (400
мг/сутки) до седьмых суток послеоперационного периода.
У 7 родильниц с анемией 2–3-й степени (Hb < 87 г/л) для коррекции железодефицитной анемии был использован препарат железа в виде карбоксимальтозатного комплекса многоядерного железа(III)-гидроксида (Феринжект). Препарат железа (карбоксимальтозат) использовался для парентерального (внутривенного) введения. По мнению Л.И. Дворецкого и др. (2008) парентеральное применение препаратов железа обосновано в следующих ситуациях:
- нарушение всасывания при заболеваниях желудочнокишечного тракта (энтериты, синдром недостаточности всасывания, резекция тонко-
86
го кишечника, резекция желудка с включением двенадцатиперстной
кишки);
-обострение язвенной болезни желудка или 12-перстной кишки;
-непереносимость препаратов железа, предназначенных для перорального приема;
-необходимость более быстрого насыщения организма железом.
Внаших исследованиях у больных с аномалией прикрепления плаценты
ижелезодефицитной анемией 2–3-й степени требовалось не только быстрое насыщение организма железом, но и его адекватное восполнение, учитывая продолжающиеся сукровичные выделения из половых путей.
Более того, у данного контингента больных существенно возрастает риск непереносимости лекарственных средств для приема внутрь, что ставит под сомнение целесообразность «пробной терапии» пероральными препаратами железа. Железа карбоксимальтозат вводили внутривенно капельно в дозе 200 мг (4 мл раствора препарата, разведенного в 100 мл 0,9% раствора хлорида натрия) 2 раза в неделю. Причем его назначение было оправдано и у родильниц, которым проводилась инфузия эритроцитарной массы.
Результаты динамики клинических показателей крови до и после восполнения дефицита железа представлены в таблице 5.
Безусловно, исходные показатели крови у пациенток, которым была восполнена кровопотеря, были выше, чем у родильниц, получавших только железа карбоксимальтозат. Соответственно, и темпы прироста показателей насыщенности железом у этих женщин первоначально были выше. Однако после третьей дозы препарата они фактически сравнялись с таковыми родильниц, которым не проводилась гемотрансфузия.
Изучение отдаленных (до 6 лет наблюдения) результатов электрохирургической гистерорезектоскопии у пациенток с врастанием плаценты показало, что восстановление менструального цикла в течение 6 месяцев отмечено у
87
Таблица 5
ПОКАЗАТЕЛИ ГЕМОГЛОБИНА (HB), ГЕМАТОКРИТА (HT) И КОЛИЧЕСТВА ЭРИТРОЦИТОВ ДО И ПОСЛЕ ЛЕЧЕНИЯ
РОДИЛЬНИЦ С АНЕМИЕЙ 2–3-Й СТЕПЕНИ, ПОЛУЧАВШИХ ТОЛЬКО ФЕРИНЖЕКТ (А) И ФЕРИНЖЕКТ В КОМПЛЕКСЕ С ИНФУЗИЕЙ ЭРИТРОЦИТАРНОЙ МАССЫ (Б)
|
Hb, г/л |
Ht, % |
Эритроциты, |
||||
Сутки после |
*1012/л |
||||||
|
|
|
|
||||
|
|
|
|
|
|
||
операции |
А |
Б |
А |
Б |
А |
Б |
|
|
|||||||
|
|
|
|
|
|
|
|
0–1 |
74,6±7,5 |
68,6±6,2 |
22,3±4,7 |
20,7±2,7 |
2,6±0,6 |
2,3±0,4 |
|
|
|
|
|
|
|
|
|
2 |
77,2±8,1 |
67,4±6,6 |
21,1±5,4 |
20,6±2,2 |
2,6±0,5 |
2,3±0,5 |
|
|
|
|
|
|
|
|
|
6 |
87,1±7,4 |
83,5±3,9 |
23,3±4,6 |
24,9±3,1 |
3,2±0,7 |
3,1±0,6 |
|
|
|
|
|
|
|
|
|
10 |
89,6±4,5 |
83,5±3,9 |
23,3±4,6 |
24,9±3,1 |
3,3±0,9 |
3,2±0,8 |
|
|
|
|
|
|
|
|
|
14 |
92,4±5,6 |
88,7±5,7 |
25,1±3,3 |
25,2±3,5 |
3,5±1,2 |
3,4±0,9 |
|
|
|
|
|
|
|
|
|
67,9% (19) женщин, в течение года – у 32,1% (9), при этом у 66,6% (6) женщин длительность восстановления менструального цикла до 1 года была связана с грудным вскармливанием. В последующем 60,7% (17) пациенток не планировали беременности. Из 39,3% (11) женщин, планировавших беременность, роды наступили в 72,7% (8) наблюдений, из них в 1 случае были роды двойней. У этой пациентки последовый период осложнился полным плотным прикреплением плаценты, приведшим к ручному отделению и выделению последа (рис. 42).

88
НБ; 39
Рисунок 42. Отдаленные результаты электрохирургической гистерорезектоскопии у пациенток с врастанием плаценты (%)
ВМЦ-6 - восстановление менструального цикла в течение 6 мес ВМЦ-12 - восстановление менструального цикла в течение 12 мес НБ - не планировали беременности ОБ - отсутствие беременностей
У 2 пациенток, не включенных в настоящее исследование из-за малого
числа наблюдений диагностирована наиболее тяжелая форма патологии при-
крепления плаценты – placentа percreta (прорастание плаценты), когда ворси-
ны хориона пенетрировали миометрий и периметрий. У этих больных произ-
ведена лапаротомия, иссечение патологического фрагмента матки с восстанов-
лением ее целостности (рис. 43-46).
Проведенные нами исследования убеждают в высокой эффективности
электрохирургической гистерорезектоскопии в лечении родильниц с аномали-
ей прикрепления плаценты. Однако в данном контексте справедливо огово-
риться, что органосберегающая внутриматочная хирургия оправдана строго
при наличии определенных условий, главным из которых является отсутствие
полного либо обширного патологического процесса. При полном врастании

89
Рисунок 43. Наблюдение placenta percreta. Трансвагинальная эхография.
Стрелкой обозначена область прорастания плаценты
Рисунок 44. Наблюдение placenta percreta. Лапаротомия.
После мобилизация матки обнаружен дефект в ее стенке с неровными краями, имбибированный темной кровью
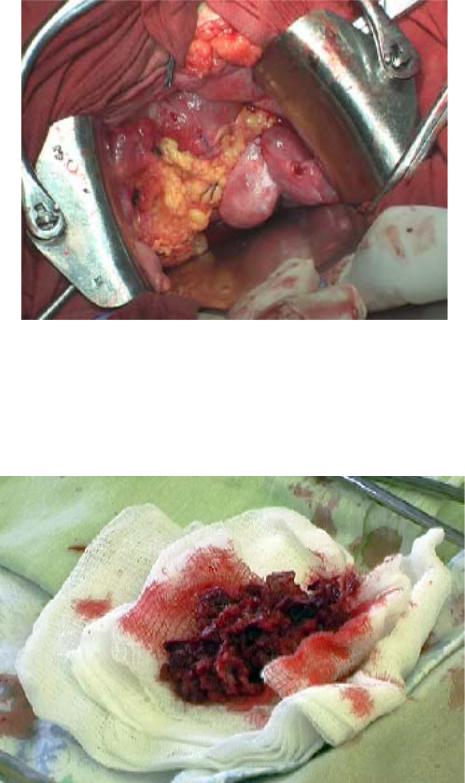
90
Рисунок 45. Наблюдение placenta percreta. Лапаротомия.
Операция завершена; выполнена репозиция сальника с целью улучшения репарации шва на матке и обеспечения надежного гемостаза
Рисунок 46. Наблюдение placenta percreta. Макропрепарат.
