
zadat-fkh
.pdf
4.10 Составить уравнение зависимости Кр от температуры для реакции окисления аммиака
4 NН3 + 5 О2 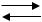 4 NО + 6 Н2О,
4 NО + 6 Н2О,
если известно, что при 1000 К Кр = 44,35 атм. Вычислить Кр реакции при температуре 1400 К. Принять ∆Н = ∆Н0298.
4.11 Йодистый водород диссоциирует при нагревании до температуры 280 °С на 17,8 %, а при нагревании до 520 °С на 24,48 %. Определить степень диссоциации при нагревании до 300 °С.
4.12 Упругость диссоциации |
РbО2 при |
600 К |
равна 9,4 .10-31 атм, а |
при |
||
800 К равна 2,3. 10-21. Определить температуру, при которой РbО2 будет |
||||||
разлагаться на воздухе. |
|
|
|
|
|
|
4.13 Для реакции |
|
|
|
|
|
|
2 СО2 |
2 СО |
+ О2 |
|
|
||
Кр = 4,033.10-16 Па при 1000 К. Вычислить Кр этой реакции при 2000 К, |
если |
|||||
среднее значение теплового эффекта ∆Н = |
561,3 кДж/моль. |
|
||||
4.14 Упругость диссоциации |
Нg2Cl2 |
. NН3 |
при |
440 К равна 35,2 мм рт.ст., |
||
а при 458 К равна 66,2 мм рт.ст. Определить значение теплового эффекта реакции
Нg2Cl2 · NН3 |
Нg2Cl2 + NН3 |
4.15 Для реакции |
|
СН4(г) + Н2О |
СО(г) + 3Н2(г) |
зависимость константы равновесия от температуры выражается уравнением lg Кр = 9876 / Т + 8,81 lg Т - 1,96.10-3Т – 11,4.
Определить тепловой эффект данной реакции при 1000 К.
4.16 Константа равновесия реакции
2 НСl(г)  Н2 + Сl2
Н2 + Сl2
может быть выражена уравнением lg Кр = - 9586 /Т + 0,441 lg Т - 2,16.
Вычислить тепловой эффект данной реакции при 1000 К.
4.17 Вычислить тепловой эффект при 1200 К для данной реакции:
Fе3О4(т) + Н2(г)  3 FеО(т) + Н2О(г) ,
3 FеО(т) + Н2О(г) ,
если
lg Кр = - 3378 /Т + 3,648.
4.18 Равновесие в системе, возникающее при восстановлении диоксида олова водородом
41

SnО2(тв) + 2 Н2(г)  Sn(тв) + 2 Н2О(г)
Sn(тв) + 2 Н2О(г)
характеризуется уравнением
lg Кр = - 2968 /Т - 1,655 lg Т - 9,08.10-5Т + 8,416.
Рассчитать значение Кр и ∆Н для данной реакции при 1073 К.
4.19 |
Зависимость Кр от температуры для реакции |
||
|
Fе3О4(т) + Н2(г) |
3 FеО(т) + Н2О(г) |
(1), |
|
выражается уравнением: |
|
|
|
lg Кр = - 3378 /Т + 3,648, |
|
|
|
а для реакции |
|
|
|
FеО(т) + Н2(г) |
Fе(т) + Н2О(г) , |
(2), |
|
уравнением: |
|
|
|
lg Кр = -748 / Т + 0,573. |
|
|
|
Определить равновесный состав газовой фазы (в объемных процентах) |
||
при 800 °С для реакции |
|
|
|
|
Fе3О4(т) + 4 Н2(г) |
3 Fе(т) + 4 Н2О(г) |
(3). |
|
Вычислить тепловой эффект для реакции |
(3) при этой температуре. |
|
4.20 |
Константа равновесия реакции |
|
|
|
2 СН3ОН(г) |
2 Н2(г) + НСООСН3(г) |
|
|
рассчитывается по уравнению |
|
|
|
lg Кр = 3149/Т - 5,43. |
|
|
|
Вычислить тепловой эффект данной реакции. |
||
4.21. Для реакции |
|
|
|
С6Н6(г.) + 3 Н2 |
С6Н12(г.) |
|
|
константа равновесия выражается уравнением
lg Кр = 9590 /Т - 9,9194 lg Т + 0,002285Т + 8,565.
Рассчитать ∆Н298 для данной реакции при температуре 500 К.
4.22. Определить тепловой эффект реакции
СН3СНО(г) + Н2(г)  С2Н5ОН(г) при 500 К, если
С2Н5ОН(г) при 500 К, если
lg Кр = 1522 /Т + 5,42 lg Т - 2,29.10-3Т + 2,186.
Задача 5 |
|
5.1 Вычислить Кр реакции |
|
2 С2Н5ОН(г) |
СН3СОСН3 (г) + СО(г) + 3Н2 |
при температуре 500 К |
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. |
|
5.2 Вычислить Кр реакции |
|
N2 + 1/2 О2 |
N2О |
при температуре 1000 К |
по методу Темкина-Шварцмана и любым |
другим методом, используя |
справочные данные. |
42

5.3 Вычислить Кр реакции |
|
|
Н2S |
Н2 |
+ 1/2 S2 |
при температуре 1000 К |
|
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. |
||
5.4 Вычислить Кр реакции |
|
|
4 НСl + О2 |
2 Н2О(г) + 2 Сl2 |
|
при температуре 900 К |
|
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. |
||
5.5 Вычислить Кр реакции |
|
|
SО2 |
О2 + 1/2 S2(г) |
|
при температуре 800 К |
|
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. |
||
5.6 Вычислить Кр реакции |
|
|
С2Н6(г) |
С2Н4(г) + Н2 |
|
при температуре 900 К |
|
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. |
||
5.7 Вычислить Кр реакции |
|
|
СО2 + 3 Н2 |
СН3ОН(г) + Н2О(г) |
|
при температуре 700 К |
|
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. |
||
5.8 Вычислить Кр реакции |
|
|
СО2 + Н2 |
НСООН(г) |
|
при температуре 500 К |
|
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. |
||
5.9 Вычислить Кр реакции |
|
|
СО + 3 Н2 |
СН4(г) + Н2О(г) |
|
при температуре 700 К |
|
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. |
||
5.10 Вычислить Кр реакции |
|
|
4 НСl + О2 |
2 Н2О(г) + 2 Сl2 |
|
при температуре 700 |
К |
по методу Темкина-Шварцмана и любым |
другим методом, используя |
справочные данные. |
|
5.11 Вычислить Кр реакции |
|
|
С2Н6 + СО |
СН3СОСН3(г) |
|
при температуре 500 К |
|
по методу Темкина-Шварцмана и любым другим |
методом, используя справочные данные. 43

5.12 Вычислить Кр реакции
Н2О(г) |
|
Н2 + 1/2 О2 |
|
при температуре 900 К |
|
по методу Темкина-Шварцмана и любым другим |
|
методом, используя |
справочные данные. |
||
5.13 Вычислить Кр реакции |
|
||
СН4 + 2 PCl5 |
|
2 PCl3 + CН2Cl2 + 2 НCl |
|
при температуре 500 К |
|
по методу Темкина-Шварцмана и любым другим |
|
методом, используя |
справочные данные. |
||
5.14 Вычислить Кр реакции |
|
||
Н2 + СО2 |
|
СО + Н2О(г) |
|
при температуре 800 К |
|
по методу Темкина-Шварцмана и любым другим |
|
методом, используя |
справочные данные. |
||
5.15 Вычислить Кр реакции |
|
||
2 NО + О2 |
|
2 NО2 |
|
при температуре 700 К |
|
по методу Темкина-Шварцмана и любым другим |
|
методом, используя |
справочные данные. |
||
5.16 Вычислить Кр реакции |
|
||
N2 + 3 Н2 |
|
2 NН3 |
|
при температуре 1000 К |
по методу Темкина-Шварцмана и любым |
||
другим методом, используя |
справочные данные. |
||
5.17 Вычислить Кр реакции |
|
||
2 СО + 2 Н2 |
|
СН3СООН(г) |
|
при температуре 900 К |
|
по методу Темкина-Шварцмана и любым другим |
|
методом, используя |
справочные данные. |
||
5.18 Вычислить Кр реакции |
|
||
Н2 + Cl2 |
|
2 НCl |
|
при температуре 600 К |
|
по методу Темкина-Шварцмана и любым |
|
другим методом, используя |
справочные данные. |
||
5.19 Вычислить Кр реакции |
|
||
Н2 + Br2 |
|
2 НBr |
|
при температуре 700 К |
|
по методу Темкина-Шварцмана и любым другим |
|
методом, используя |
справочные данные. |
||
5.20 Вычислить Кр реакции |
|
||
2 Cl2 + 2 Н2О(г) |
К |
4 НСl(г) + О2 |
|
при температуре 900 |
|
по методу Темкина-Шварцмана и любым другим |
|
методом, используя |
справочные данные. |
||
|
|
|
44 |

5.21 Вычислить Кр реакции
2 Н2 + S2(г)  2 Н2S(г)
2 Н2S(г)
при температуре 900 К по методу Темкина-Шварцмана и любым другим методом, используя справочные данные.
5.22 Вычислить Кр реакции |
|
|
|
|
2 SО2 + О2 |
2 S О3 |
|
|
|
при температуре 800 К |
по методу Темкина-Шварцмана и любым другим |
|||
методом, используя |
справочные данные. |
|
|
|
|
|
Задача 6 |
|
|
6.1 Вычислить выход этанола по уравнению реакции |
|
|
||
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
при температуре |
||
из смеси этилена |
и воды стехиометрического состава |
|||
250 оС и давлении 8106,40 |
кПа, lg Кf = - 4,1958, где Кf [кПа-1]. |
|
||
6.2 Вычислить выход этанола по уравнению реакции |
|
|
||
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
|
температуре |
|
из смеси этилена |
и воды стехиометрического состава при |
|||
300 оС и давлении 12156,0 кПа, lg Кf = - 4,5657, где Кf [кПа-1]. |
|
|||
6.3 Вычислить выход этанола по уравнению реакции |
|
|
||
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
|
|
|
из смеси этилена |
и воды стехиометрического состава при температуре |
|||
300 оС и давлении 15199,5 кПа, lg Кf = - 4,5657, где Кf [кПа-1]. |
|
|||
6.4 Вычислить выход этанола по уравнению реакции |
|
|
||
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
при температуре |
||
из смеси этилена |
и воды стехиометрического состава |
|||
350 оС и давлении 15199,5 |
кПа, lg Кf = - 4,8758, где Кf [кПа-1]. |
|
||
6.5 Вычислить выход этанола по уравнению реакции |
|
|
||
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
|
температуре |
|
из смеси этилена |
и воды стехиометрического cостава при |
|||
350 оС и давлении 20266,0 |
кПа, lg Кf = - 4,8758, где Кf [кПа-1]. |
|
||
6.6Вычислить выход этанола (в молярных процентах) по уравнению реакции
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
при температуре |
250 оС, давлении 10133,0 кПа и соотношении в |
исходной смеси n(Н2О) : n(С2Н4) = 0,2:1, если lg Кf = - 4,1958, где Кf[кПа-1].
6.7Вычислить выход этанола (в молярных процентах) по уравнению реакции
45
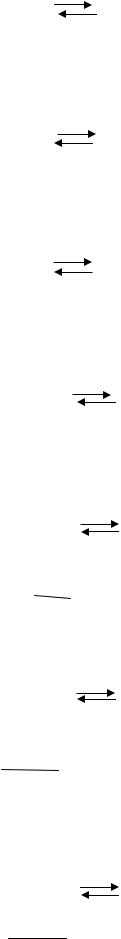
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
при температуре |
250 оС, давлении 10133,0 кПа и соотношении в |
исходной смеси n(Н2О) : n(С2Н4) = 0,4:1, если lg Кf = - 4,1958, где Кf [кПа-1].
6.8Вычислить выход этанола (в молярных процентах) по уравнению реакции
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
при температуре |
250 оС, давлении 8106,4 кПа и соотношении в |
исходной смеси n(Н2О) : n(С2Н4) = 0,4:1, если lg Кf =- 4,1958, где Кf [кПа-1].
6.9Вычислить выход этанола (в молярных процентах) по уравнению реакции
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
при температуре |
250 оС, давлении 8106,4 кПа и соотношении |
исходной смеси n(Н2О) : n(С2Н4) = 0,6:1, если lg Кf = - 4,1958, где Кf [кПа-1].
6.10Вычислить выход этанола (в молярных процентах) по уравнению реакции
при |
С2Н4 (г) + Н2О(г) |
С2Н5ОН(г) |
|
соотношении в |
||
температуре 250 оС, давлении 8106,4 кПа и |
||||||
исходной смеси n(Н2О):n(С2Н4) = 0,8:1, если lg Кf = |
- 4,1958, где Кf [кПа-1]. |
|||||
6.11 Вычислить выход пропанола, |
получаемого при гидратации пропилена |
|||||
по уравнению реакции |
|
|
|
|||
под |
С3Н6 (г) + Н2О(г) |
С3Н7ОН(г) |
|
оС из смеси |
||
давлением |
20266 кПа и температуре 250 |
|||||
стехиометрического состава. Для данной реакции |
|
|
||||
|
lg Кf = 1920 |
- 7,8856, где Кf [кПа-1]. |
|
|
||
|
|
Т |
|
|
|
|
6.12 Вычислить выход пропанола, |
получаемого при гидратации пропилена |
|||||
по уравнению реакции |
|
|
|
|
||
под |
С3Н6 (г) + Н2О(г) |
С3Н7ОН(г) |
|
оС из смеси |
||
давлением |
20266 кПа и температуре 200 |
|||||
стехиометрического состава. Для данной реакции |
|
|
||||
|
lg Кf = |
1920 |
- 7,8856, где |
Кf [кПа-1]. |
|
|
|
|
Т |
|
|
|
|
6.13 Вычислить выход бутанола, |
получаемого при гидратации бутилена из |
|||||
смеси бутилена и воды стехиометрического состава |
при температуре 250 оС |
|||||
и давлении 15199,5 кПа по уравнению реакции |
|
|
||||
|
С4Н8 (г) + Н2О(г) |
С4Н9ОН(г). |
|
|
||
Для данной реакции |
- 8,4006, где Кf [кПа-1]. |
|
|
|||
|
lg Кf = |
1845 |
|
|
||
|
|
Т |
|
|
|
|
46
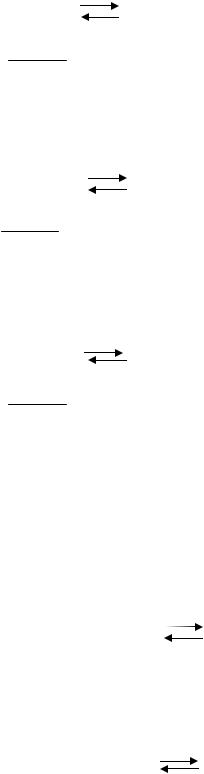
6.14 Вычислить выход бутанола, получаемого при гидратации бутилена из
смеси бутилена и воды стехиометрического состава при температуре 250 оС |
|
и давлении 20266,0 кПа по уравнению реакции |
|
С4Н8 (г) + Н2О(г) |
С4Н9ОН(г). |
Для данной реакции |
- 8,4006, где Кf [кПа-1]. |
lg Кf = 1845 |
|
Т |
|
6.15 Вычислить выход бутанола, получаемого при гидратации бутилена из
смеси бутилена и воды стехиометрического состава при температуре 200 оС |
|
и давлении 15199,5 кПа по уравнению реакции |
|
С4Н8 (г) + Н2О(г) |
С4Н9ОН(г). |
Для данной реакции |
- 8,4006, где Кf [кПа-1]. |
lg Кf = 1845 |
|
Т |
|
6.16 Вычислить выход бутанола, получаемого при гидратации бутилена из смеси бутилена и воды стехиометрического состава при температуре 200 оС и давлении 20266,0 кПа по уравнению реакции
С4Н8 (г) + Н2О(г) |
С4Н9ОН(г). |
Для данной реакции |
- 8,4006, где Кf [кПа-1]. |
lg Кf = 1845 |
|
Т |
|
6.17 Вычислить выход уксусноэтилового эфира из смеси этилового спирта и уксусной кислоты стехиометрического состава по уравнению реакции
С2Н5ОН (г) + СН3СООН(г) 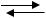 СН3СООС2Н5 (г) + Н2О(г)
СН3СООС2Н5 (г) + Н2О(г)
при температуре 150 оС и давлении 10133,0 кПа, если для данной реакции
∆ G 0 = - 35082,84 - 23,4304 Т ln Т + 195,393 Т Дж/моль.
6.18 Вычислить выход уксусноэтилового эфира из смеси этилового спирта и уксусной кислоты стехиометрического состава по уравнению реакции
С2Н5ОН (г) + СН3СООН(г) |
СН3СООС2Н5 (г) + Н2О(г) |
|
при температуре 200 оС и давлении 10133,0 кПа, если для данной реакции |
||
∆ G 0 = - 35082,84 - 23,4304 Т ln Т + 195,393 Т |
Дж/моль. |
|
6.19 Вычислить выход уксусноэтилового эфира из |
смеси этилового спирта |
|
и уксусной кислоты стехиометрического состава по уравнению реакции |
||
С2Н5ОН (г) + СН3СООН(г) |
СН3СООС2Н5 (г) + Н2О(г) |
|
при температуре 250 оС и давлении 15199,5 кПа, если для данной реакции |
||
∆ G 0 = - 35082,84 - 23,4304 Т ln Т + 195,393 Т |
Дж/моль. |
|
6.20 Вычислить выход ацетонитрила СН3СN из смеси этилена и аммиака стехиометрического состава по уравнению реакции
47

С2Н4 (г) + NН3 (г)  СН3СN (г) + 2 Н2 (г)
СН3СN (г) + 2 Н2 (г)
при температуре 700 оС и давлении 20266 кПа, lg Кf = 1,5128, где Кf [кПа-1].
6.21 Вычислить выход ацетонитрила СН3СN из смеси этилена и аммиака стехиометрического состава по уравнению реакции
С2Н4 (г) + NН3 (г)  СН3СN (г) + 2 Н2 (г)
СН3СN (г) + 2 Н2 (г)
при температуре 800 оС и давлении 20266 кПа, lg Кf =2,4288, где Кf [кПа-1].
6.22 Вычислить выход ацетонитрила СН3СN из смеси этилена и аммиака стехиометрического состава по уравнению реакции
С2Н4 (г) + NН3 (г)  СН3СN (г) + 2 Н2 (г)
СН3СN (г) + 2 Н2 (г)
при температуре 900 оС и давлении 20266 кПа, lg Кf = 2,9557, где Кf [кПа-1].
4. ФАЗОВОЕ РАВНОВЕСИЕ
Задача 1 1.1 Какова точка кипения воды на горе, если барометр показывает 660 мм рт. ст., ∆Нисп. (Н2О) = 9,72 ккал/моль.
1.2 Удельный объем 1 кг жидкого газа С6Н5Сl при температуре кипения 132 оС равен 1,019.103 м3/кг; dP/dT= 2,736.103 Па/К. Теплота испарения при этой температуре кипения 307,231 кДж/кг. Определить плотность насыщенного пара.
1.3Давление пара этанола при 70 и 80 оС соответственно равно 540,9 и 811,8 мм рт. ст.. Рассчитать удельную теплоту испарения.
1.4Воздух насыщен парами воды при 25 оС. При какой температуре при
неизменном содержании водяных паров относительная влажность воздуха будет равна 80%, если при 25 оС давление водяного пара равно 23,76 мм рт.ст. и удельная теплота испарения воды равна 578,7 кал/г ?
1.5 Для зависимости теплоты парообразования метанола от Т предложено уравнение:
∆TH = ( 1115,873 – 173,636 lnТ ) Дж/моль.K
Насколько |
повысится температура кипения при увеличении давления на 1 |
мм рт. ст. |
при нормальной температуре кипения 64,7 oС ( Р =1атм). |
1.6 Давление пара воды при 99,5 оС равно 746,52 мм рт. ст., а при 100,5 оС равно 773,69 мм рт.ст.. Удельный объем насыщенного пара при 100 оС составляет 1,658 м3/кг. Какова теплота испарения при 100 оС? Плотность жидкой воды при 100 оС 1,00 .10 3кг/м3.
48
1.7 Теплота испарения воды при температуре кипения под давлением 1 атм равна 2255,176 кДж/кг. Найти изменение давления пара при увеличении температуры кипения под атмосферным давлением на 1 К (dР/dТ).
1.8Давление пара бензола при 20 и 30 оС соответственно равно 75 и 118 мм рт.ст. Рассчитать удельную теплоту испарения.
1.9Давление пара 2,2-диметилбутадиона-1 выражается уравнением
lgР = - 4849,3 /Т – 14,701 lg Т +53,1187, где Р [ мм рт.ст. ].
Рассчитать теплоту испарения: а) при 25 oС, б) в точке кипения 136,7 oС.
1.10 Упругость паров толуола можно выразить уравнением
lgР ( мм рт. ст. ) = −2866,5 - 6,7lgT + 27,65
T
Определить величину молярной теплоты испарения при 110,7 oС.
1.11Давление пара СО2 (тв.) равно 1 мм рт.ст. при - 134,3 оС, а при -114,4 оС 20 мм. рт. ст.. Рассчитать теплоту возгонки.
1.12Теплота испарения эфира в точке кипения (34,5 оС) равна 88,39 кал/г. Рассчитать: а) скорость изменения давления пара с температурой (dP/dT) в
точке кипения, б) точку кипения при 750 мм рт. ст., в) давление пара при
36,0 oС. Эфир (С2Н5)2О.
1.13 Давление пара твердого бензола равно 2,24 мм рт. ст. при - 30 оС и 24,5
мм рт. ст. при 0 oС, а давление пара жидкого бензола |
равно 46,3 мм рт.ст. |
при 10 oС и 118,5 мм рт. ст. при 30 oС. Из этих |
данных рассчитать: |
а) теплоту плавления C6H6, б) координаты тройной |
точки. |
1.14Давление пара ВСl 3при 10 oС равно 562,9 мм рт. ст.. Молярная теплота испарения BCl3 24886,42 Дж/моль. При какой температуре ВСI3 закипает под атмосферным давлением ( 760 мм рт.ст.)?
1.15Давление пара расплавленного железа при 2277 и 2376 оС соответственно равно 6666 и 13332 Па. Определить среднюю молярную теплоту испарения железа.
1.16Давление пара воды при 95 и 97 оС соответственно равно 84513 и 90920 Па. Вычислить молярную теплоту парообразования и количество теплоты, необходимое для испарения 100г воды.
1.17Давление пара иода при 90 оС составляет 3572,4 Па, а при 100 оС равно 6065,2 Па. Определить давление пара иода при 115 оС.
49
1.18 Вычислить давление насыщенного пара сероуглерода (СS2) при - 10 оС, если давление пара при 0 оС 16929 Па. Теплота парообразования сероуглерода 363,3 Дж/г. Определить массу насыщенных паров СS2 в помещении 5×10×3 м3 при - 10 оС и концентрацию его паров (кг/м 3 ) при этой температуре.
1.19 Давление пара жидкого брома изменяется с температурой по уравнению lnP = − 5083T - 4,08 lnT + 45,59
Найти: 1) уравнение зависимости теплоты испарения брома от температуры,
2)изменение энтропии при испарении 1 моль брома при 58 oС.
1.20Молярная теплота испарения ССl4 изменяется с температурой по уравнению
∆ Н = 10960 – 10,53 Т
Определить давление насыщенного пара ССl4 при 60 оС, если известно, что ССl4 кипит при 75 оС под давлением 1 атм.
Задача 2 2.1 Зависимость температуры плавления нафталина от давления выражается
уравнением
t(оC ) = 79,8 + 3,7 · 10 -7 · Р (Па) + 1,88 · 10-14 ·Р 2(Па)
Разность удельных объемов жидкого и твердого нафталина равна 0,146 см3/г. Рассчитать молярную теплоту плавления нафталина при 5,07 · 10 6 Па.
2.2 Определить теплоту плавления метана при 90,67 К, если зависимость температуры плавления метана от давления в интервале 101,33 - 202,66 Па
выражается уравнением
Тпл = 90,667 + 2.6 10-7 Р - 6,147· 10 -16 P2.
Изменение объема при плавлении составляет 2,69 см3/моль.
2.3 |
Зависимость температуры плавления |
олова от давления ( |
Па ) |
описывается выражением |
|
|
|
|
t пл ( оС) = 231,8 + 0,3257· 10 -7 |
Р, |
|
∆Нпл = 58,785 кДж/кг, плотность жидкого олова равна 6,988 .103 |
кг/м3. |
||
Найти плотность твердого олова. |
|
|
|
2.4 |
Определить приращение объема при плавлении 20 кг олова, если его |
||
теплота плавления равна 59,413 Дж/г, температура плавления 232 оС,
плотность |
твердого олова 7,18 г/см3; dT/dP = 3,25710-8 К/Па. |
|
2.5 Рассчитать изменение |
давления, требуемое для изменения точки |
|
замерзания |
воды на 1 К. |
При 0 oС теплота плавления льда 79,7 кал/г, |
плотность воды 0,9998 г/см3, |
плотность льда 0,9168 г/см3. |
|
50
