
- •Содержание
- •Г л а в а 6. Элементы и параметры электрических цепей переменного тока
- •Приложение
- •Введение
- •Электростатическое поле
- •1. Закон кулона
- •2. Напряженность электрического поля
- •3. Диэлектрическая проницаемость
- •Контрольные вопросы
- •Проводники в электрическом поле. Цепи постоянного тока. Токопроводящие материалы.
- •1. Электрический ток
- •2. Напряженность электрического поля, потенциал, напряжение и эдс
- •3. Электрическое сопротивление и проводимость
- •4. Закон ома
- •5. Законы кирхгофа
- •6. Соединение резисторов
- •7. Закон джоуля-ленца. Нагревание проводников.
- •8. Короткое замыкание и перегрузки. Тепловая защита.
- •9. Мощность
- •10. Электрические цепи с несколькими источниками энергии
- •11. Делитель напряжения
- •12. Потери напряжения и мощности в проводах
- •13. Передача электрической энергии по проводам
- •14. Токопроводящие материалы
- •Контрольные вопросы
- •Диэлектрики в электрическом поле. Изоляция электротехнических материалов. Диэлектрические материалы.
- •1. Строение диэлектрика.
- •2. Диэлектрик в электрическом поле. Поляризация диэлектрика
- •3. Электрическая емкость. Конденсаторы.
- •4. Соединение конденсаторов
- •5. Энергия электрического поля конденсатора
- •6. Электрический пробой диэлектрика
- •7. Диэлектрические материалы. Изоляция электротехнических материалов.
- •Контрольные вопросы
- •Магнитное поле. Электромагнетизм и электромагнитная индукция. Магнитные материалы.
- •1. Магнитное поле в неферромагнитной среде. Основные понятия
- •2. Напряженность и индукция магнитного поля
- •3. Магнитный поток.
- •4. Индуктивность.
- •5. Магнитные свойства веществ. Магнитная проницаемость
- •Магнитные свойства ферромагнитных материалов. Намагниченность.
- •7. Циклическое перемагничивание. Гистерезис.
- •8. Ферромагнитные материалы
- •9. Электромагнитные силы
- •10. Электромагнитная индукция
- •11. Вихревые токи
- •12. Эдс самоиндукции и взаимоиндукции
- •Контрольные вопросы
- •Линейные электрические цепи переменного тока
- •Основные определения
- •Сложение синусоидальных величин
- •Среднее значение синусоидальных величин
- •Контрольные вопросы
- •Элементы и параметры электрических цепей переменного тока
- •1. Цепь с активным сопротивлением
- •2. Электрическая цепь с индуктивностью
- •Резонанс напряжений
- •Параллельное соединение r, l, c – элементов
- •Контрольные вопросы
- •Трехфазные электрические цепи
- •Принципы построения трехфазных электрических цепей
- •Соединение звезда. Несимметричная нагрузка. Явление перекоса фаз
- •Нулевой провод
- •Мощность трехфазной системы
- •Контрольные вопросы
- •Нелинейные электрические цепи
- •Характеристики нелинейных электрических цепей и элементов
- •Электрическая цепь с нелинейным индуктивным элементом
- •Трансформаторы
- •Контрольные вопросы
- •Электрические машины переменного тока
- •Вращающееся магнитное поле
- •Устройство асинхронного двигателя
- •Принцип работы асинхронного двигателя
- •Регулирование числа оборотов асинхронного двигателя
- •Однофазные асинхронные двигатели
- •Синхронный генератор. Устройство и принцип работы
- •Синхронный двигатель. Принцип работы
- •Контрольные вопросы
- •Машины постоянного тока
- •Общие сведения
- •Устройство и работа генератора постоянного тока
- •Типы генераторов постоянного тока
- •Генератор с независимым возбуждением
- •Генератор с параллельным возбуждением
- •Генератор с последовательным возбуждением
- •Генератор со смешанным возбуждением
- •Двигатели постоянного тока
- •Контрольные вопросы
- •Переходные процессы в электрических цепях
- •Основные определения
- •2. Зарядка и разрядка конденсатора
- •3. Релаксационные колебания
- •4. Включение и выключение реальной индуктивной катушки при постоянном напряжении источника
- •5. Разрядка конденсатора на индуктивность
- •Контрольные вопросы
- •Современные способы получения электрической энергии. Виды силовых электростанций. Альтернативная электроэнергетика.
- •1. Тепловые электростанции (тэс)
- •Экологические проблемы тэс
- •2. Гидравлические электрические станции (гэс).
- •3. Гидроаккумулирующие электрические станции (гаэс)
- •4. Приливные электрические станции
- •5. Атомные электрические станции (аэс)
- •55Cs140→56Ba140→57La140→58Ge140→стабильное ядро;
- •37Rb94→38Sr94→39y94→40Zr90→ стабильное ядро.
- •Магнитогидродинамическое преобразование энергии (мгд-генераторы).
- •7. Термоэмиссионные генераторы
- •8. Солнечные электростанции
- •9. Электрохимические генераторы
- •10. Термоэлектрические генераторы
- •11. Геотермальные электростанции
- •12. Термоядерная энергетика
- •13. Водородная энергетика
- •14. Понятие о единой энергетической системе.
- •Контрольные вопросы
- •Атомно-молекулярная теория строения вещества
- •Структура и строение атома
- •Линейчатый спектр. Постулаты бора и квантование орбит
- •Корпускулярно - волновой дуализм нанообъектов. Волны де-бройля
- •Туннелирование
- •Классификация наноматериалов
- •8. Трехмерные наноматериалы
- •Размерные эффекты и свойства нанообъектов
- •Химические свойства наноматериалов
- •Тепловые свойства нанообъектов
- •Магнитные свойства нанообъектов
- •Функциональные и конструкционные углеродные наноматериалы.
- •Получение углеродных наноструктур
- •Применение и использование наноматериалов в практической деятельности
- •Контрольные вопросы
- •Приложение
- •Сложение векторов.
- •Метод комплексных чисел
- •Расчет цепей методом узлового напряжения
Атомно-молекулярная теория строения вещества
Эта теория является краеугольным камнем современной науки о материалах в природе. Все материалы состоят из молекул, т.е молекулы являются элементарными «кирпичиками» того или иного вещества или материала. Эти два слова являются для нас синонимами Эти кирпичики могут быть как большими (органические молекулы), так и иметь малый размер (молекулы неорганических и некоторой части органических материалов). В качестве примера можно привести следующие простейшие молекулы: воды Н2О, аммиака NH3, двуокиси углерода СО2, кислородаО2(Н2, N2), неона Ne (гелия He, аргона Ar и др. инертные газы.). Как видно из химических формул, а также из опыта эти кирпичики имеют сложное строение и, в свою очередь состоят из атомов.
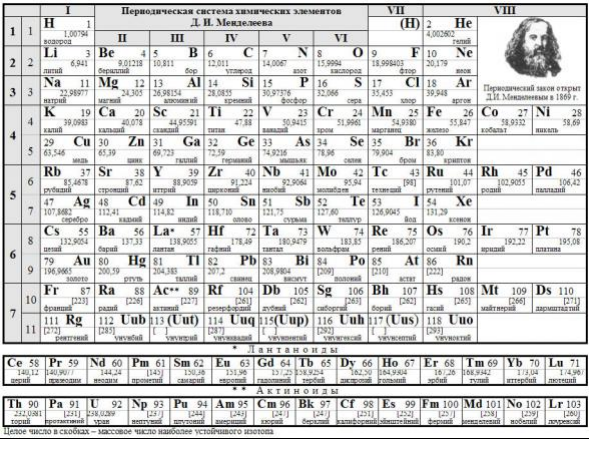
Атомы – «кирпичики» того или иного химического элемента. Химический элемент или элементарное вещество, состоит из атомов только одного сорта. Когда Д. И Менделеев составлял свою периодическую систему элементов ему были известны лишь 31 элемент. В настоящее время открыто уже 118 элементов. И все они вписываются в его систему элементов. Одни ин элементов встречаются в природе в свободном состоянии и известны несколько тысячелетий (Fe, Ag, Au,Hg и др). Другие открыты недавно. Ряд элементов стабильны , а другие короткоживущие.
Таблица Д.И. Менделеева
Структура и строение атома
Рассмотрим строение атома какого-нибудь элемента, например натрия 11Na23., с позиций протонно-нейтронной теории. Порядковый номер натрия в периодической системе Менделеева 11, массовое число 23. В соответствии с порядковым номером заряд ядра натрия равен +11. Следовательно, в атоме натрия имеется 11 электронов, сумма зарядов которых равна положительному заряду ядра. Заряд ядра атома равен сумме зарядов 11 протонов, находящихся в ядре, масса которых равна 11а.е.м. Т.к. массовое число натрия равно 23а.е.м., то разность 23-11=12 определяет число нейтронов в ядре атома натрия.
Протоны и нейтроны называются нуклонами. Ядро атома натрия содержит 23 нуклона, из, которых 11 (порядковый номер натрия) – протоны и 12 – нейтроны. Общее число нуклонов в ядре пишут вверху символического обозначения элемента.
С точки зрения классических законов физики непонятна устойчивость атома и линейчатый характер атомных спектров. К началу XX века опыты показали, что электроны представляют собой отрицательно заряженные частицы, являющиеся составной частью атома. Электрический ток является ни чем иным, как упорядоченным движением электронов вдоль металлического провода, и в этом смысле электрон есть квант электричества.
Исходя из этого, Э. Резерфорд предложил в 1910 г планетарную модель атома (рис. 171), в которой отрицательно заряженные электроны вращаются как планеты вокруг центрального положительно заряженного ядра, притягивающего их подобно Солнцу (напомним, что заряды одинаковых знаков отталкиваются, а противоположных притягиваются). Такая аналогия между атомом и Солнечной системой сразу же захватила воображение людей. Она действительно позволяет очень наглядно представить атом и объяснить некоторые его свойства, например, различия в энергии электронов. Однако пользоваться данной аналогией можно только до определенного предела. Основной ее недостаток следует из природы электрических зарядов: если на заряд действует магнитное поле или силы притяжения какого-нибудь атомного ядра, то заряд не может двигаться равномерно и прямолинейно. Его траектория будет
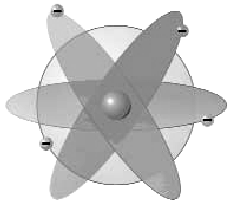

Рис .171 Модель атома Резерфорда Рис. 172Траектория, по которой двигался бы
электрон по законам классической физики
искривлена, а из теории Максвелла следует, что такой заряд при движении должен испускать электромагнитные волны, теряя при этом часть своей энергии (рис. 172). Таким образом, из законов классической физики неизбежно следовал вывод, что, двигаясь ускоренно по определенным орбитам, электрон, излучающий энергию в виде электромагнитных волн, со временем должен терять скорость и, в конце концов, упасть на ядро (что положило бы конец существованию атома).
Согласно теоретическим расчетам, атомы бы прекратили свое существование примерно за наносекунду, что, конечно же, противоречит долговременной стабильности атома в действительности. Кроме того, совокупность таких атомов должна была бы давать сплошной спектр излучения (Видимая часть спектра от красного до фиолетового и невидимая часть спектра, включающая инфракрасное и ультрафиолетовое излучение), а не линейчатый, наблюдаемый на опыте.
